KCNJ11合并PAX4基因突变致青少年起病的成人型糖尿病家系一例
2022-04-25钟胜利束燕雯顾天伟毕艳
钟胜利 束燕雯 顾天伟 毕艳
患者,女,31岁,因“口干、多饮、多尿17年”于2019年2月1日至南京大学医学院附属鼓楼医院门诊就诊。患者17年前因口干、多饮、多尿在外院行口服葡萄糖耐量试验(OGTT),诊断为“糖尿病”,初步予以饮食及运动控制,监测其空腹血糖为8~10 mmol/L(3.9~6.1 mmol/L,括号内为正常参考值范围,以下相同),加用二甲双胍0.5 g三餐前口服,患者后因呕吐、腹痛等消化道反应不能耐受,未规律服药,血糖控制不佳,6年前起应用门冬胰岛素30早、晚餐前10~12 U皮下注射,血糖控制尚可,2019年调整降糖方案为地特胰岛素10 U睡前皮下注射及二甲双胍0.5 g早、晚餐前口服(因胃肠道症状间断使用),血糖控制仍不佳,为进一步调整血糖水平至南京大学医学院附属鼓楼医院就诊。既往史:脂肪肝病史,无胰腺炎及胰腺手术史。患者系足月产,出生体重4.5 kg,出生时无低血糖史,生长发育与同龄人相当。家族史:患者外公、母亲、舅舅、爷爷、父亲均患有糖尿病。患者父亲为58岁男性,45岁诊断为糖尿病,起病初期间断服用二甲双胍,后改为三餐前门冬胰岛素联合睡前甘精胰岛素方案;有糖尿病视网膜病变、糖尿病足、糖尿病周围神经病变、糖尿病肾病病史。患者母亲为57岁女性,30岁诊断为糖尿病,间断服用二甲双胍,50岁起运用二甲双胍联合磺脲类及地特胰岛素降糖;有糖尿病视网膜病变、糖尿病肾病、糖尿病周围血管病变病史。患者外公及祖父80岁左右发现糖尿病,10年后相继去世(具体原因不详),患者家系系谱图见图1。体格检查:体温36.1 ℃,呼吸18次/分,血压99/65 mmHg,脉搏91次/分,身高164 cm,体重67.8 kg,BMI 27.5 kg/m2,腹型肥胖,无黑棘皮征等胰岛素抵抗体征,心、肺、腹体格检查未见明显异常,双下肢无水肿,足背动脉搏动可扪及。辅助检查:糖化血红蛋白(HbA1c)12%(4.2~6.0%);胰岛自身抗体检查结果均为阴性;空腹血糖13.0 mol/L(3.9~6.1 mmol/L),标准餐后2 h血糖15.4 mmol/L(<7.8 mmol/L);空腹C肽532.8 pmol/L(370.0~1 470.0 pmol/L),餐后2 h C肽680.8 pmol/L(空腹C肽的3~5倍);尿常规:尿葡萄糖(++++),尿酮体(++);甘油三酯0.78 mmol/L(0.56~1.70 mmo/L),低密度脂蛋白胆固醇2.40 mmol/L(1.89~3.10 mmo/L)。完善糖尿病并发症筛查:尿微量白蛋白/肌酐21.8 mg/g(0~30.0 mg/g);免散瞳眼底照相结果:糖尿病视网膜病变1期。颈动脉超声检查结果未见特殊异常。四肢踝动脉肱动脉收缩压比值(ABI)、糖尿病足经皮氧分压监测检查结果未见异常。肌电图检查结果:左侧尺神经感觉神经传导速度(SCV)正常,感觉神经动作电位(SNAP)波幅降低,余被检上下肢感觉神经及运动神经传导速度及波幅在正常范围内。患者起病年龄<25岁,有糖尿病家族史且呈常染色体显性遗传,起病后不依赖胰岛素治疗,符合青少年起病的成人型糖尿病(MODY)临床诊断标准。据MODY概率计算器测算[1],患者的MODY阳性预测值为75.5%,建议进一步行基因检测筛查单基因糖尿病,予完善基因检测。基因测序分析结果显示:1.KCNJ11基因有第1外显子c.11G>A,导致第4号氨基酸由精氨酸变异为组氨酸(p.R4H),为错义突变,在正常人群数据库中的频率为0.000 01,为低频变异(PM2);生物信息学蛋白功能预测软件SIFT、PolyPhen2、MutationTaster、GERP++、Revel均预测为有害(PP3);HGMD数据库无该位点的相关性报道;经家系验证分析,患者母亲该位点杂合变异;2.PAX4基因第5外显子c.776C>A,导致第259号氨基酸由丝氨酸变异为酪氨酸(p.S259Y),为错义突变。在正常人群数据库中的频率为0.000 10,为低频变异(PM2);生物信息学蛋白功能预测软件PolyPhen2、GERP++预测为有害,SIFT、MutationTaster、Revel均预测为良性;HGMD数据库无该位点的相关性报道;经家系验证分析,患者父亲该位点杂合变异(图2)。结合患者病史特点、基因检测结果及家系验证情况,修正诊断为KCNJ11-MODY合并PAX4-MODY。根据诊断调整治疗方案,因患者二甲双胍不耐受,同时考虑患者体型超重,且饮食控制一般,调整降糖方案为格列齐特缓释片90 mg、达格列净10 mg联合利拉鲁肽1.8 mg均每日1次,使用2周后患者自测空腹血糖4.0~5.0 mmol/L。2019年7月复查BMI 24.3 kg/m2,HbA1c 7.0%,行标准馒头餐试验:空腹血糖7.2 mmol/L,餐后2 h血糖9.3 mmol/L,空腹C肽607.5 pmol/L,餐后2 h C肽1 553.0 pmol/L。2020年2月起因疫情停用利拉鲁肽,2020年8月至南京大学医学院附属鼓楼医院门诊复诊BMI 25.2 kg/m2,空腹血糖9.3 mmol/L,餐后2 h血糖14.6 mmol/L,空腹C肽475.0 pmol/L,餐后2 h C肽1 134.0 pmol/L,HbA1c 8.9%,后予加用利拉鲁肽1.2 mg每日1次。患者不同时间的胰岛功能及血糖水平见表1。患者重新使用胰高血糖素样肽-1受体激动剂(GLP-1RA)后体重较前下降,血糖和HbA1c控制水平亦较前好转。

图1 患者家系系谱图:先证者Ⅲ-1、先证者父亲Ⅱ-6及先证者母亲Ⅱ-7均与先证者存在相同突变,余家系成员未进行基因检测(箭头表示先证者,圆圈表示女性,方框表示男性,空心表示血糖正常,实心表示临床诊断糖尿病,斜杠表示去世个体)
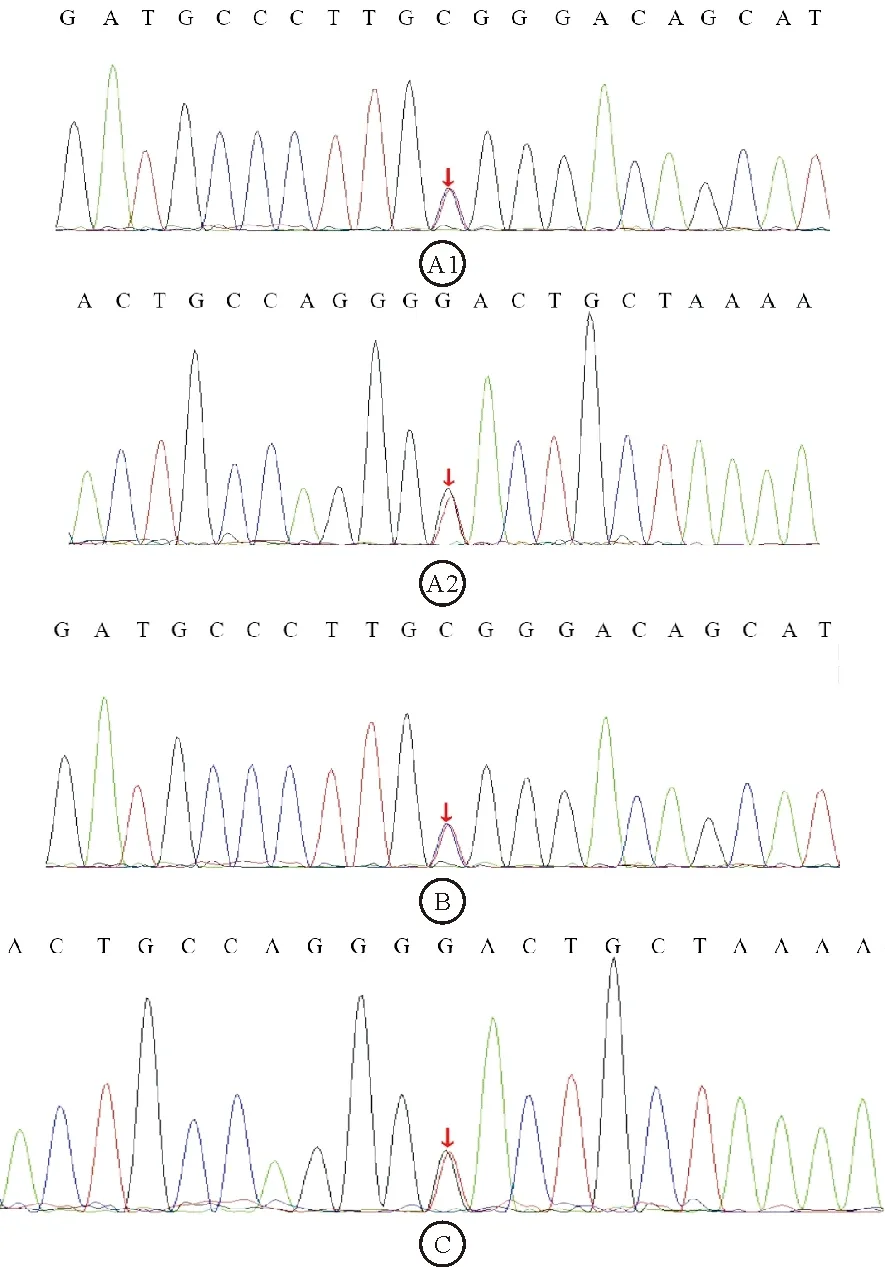
图2 患者及其家属二代测序分析结果:A1:先证者KCNJ11基因第1外显子c.11G>A杂合突变;A2:先证者PAX4基因第9外显子c.776C>A杂合突变;B:患者母亲KCNJ11基因第1外显子c.11G>A杂合突变;C:患者父亲PAX4基因第9外显子c.776C>A杂合突变
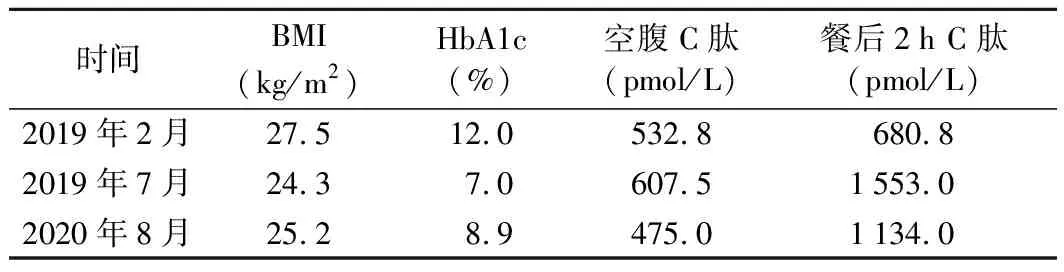
表1 患者不同时间的胰岛功能及血糖水平
讨 论
MODY是一组分子病因明确的特殊类型糖尿病,其致病基因编码的蛋白包括调控胰岛β细胞分化、发育的转录因子,参与糖、脂代谢的关键酶以及调控胰岛素分泌的K+ATP通道亚单位的组成蛋白,其临床诊断标准为:有连续三代及以上的糖尿病家族史并呈常染色体显性遗传,至少1人起病年龄<25岁,起病 5年内不依赖胰岛素且无酮症倾向。迄今已发现14种基因与MODY相关,其中KCNJ11-MODY及PAX4-MODY较为少见[2]。本文首次报道了KCNJ11及PAX4双基因突变致MODY家系一例,其中先证者的KCNJ11基因突变及PAX4基因突变分别遗传自其父母,既往文献尚无相关报道。
PAX4-MODY由PAX4基因突变导致,由Plengvidhya等[3]于2019年首次发现。PAX4基因位于染色体7q32,跨度5.6 kb,包含9个外显子;作为胰岛激素关键抑制基因,PAX4下调胰高血糖素和胰岛素的表达,也抑制了胰岛淀粉样蛋白和葡萄糖转运蛋白2的表达。PAX4基因在靶基因启动子的调控中起双重作用,即通过胰高血糖素、胰岛素、生长抑素、胰岛淀粉样多肽(IAPP)和生长素释放肽启动子的反式抑制及c-myc和Bcl-xL启动子的反式激活,促进胰岛增殖及保护细胞免受应激诱导的细胞凋亡[4]。PAX4基因敲除可导致兔的持续高血糖甚至死亡,此外还观察到包括糖尿病肾病、肝病、肌病和心肌病的发生。Sujjitjoon等[5]报道的PAX4 IVS7-1G>A突变的MODY家系存在严重糖尿病并发症,该家系中先证者妹妹10年内即出现视网膜病变和肾病,家系中大多数患者患有糖尿病并发症,包括视网膜病变和肾病,而部分亲属死于终末期肾病。其并发症的发生发展可能与长期高糖毒性及受影响组织中突变型PAX4的有害作用有关。本文报道的先证者及父亲均存在PAX4基因突变。先证者父亲起病10年即出现糖尿病视网膜病变,起病13年后出现糖尿病足并行左脚拇趾截断术,且合并糖尿病周围神经病变、糖尿病肾病等多种并发症。先证者目前已出现糖尿病视网膜病变。KCNJ11-MODY由KCNJ11基因突变所致,由Bonnefond等[6]于2012年首次报道,KCNJ11基因位于染色体11p15.5~12.2,与ABCC8基因共同编码K+ATP通道中的磺脲类受体1(SUR1)和内向整流钾通道Kir6.2,KCNJ11基因突变通过破坏K+通道的活性导致葡萄糖刺激的胰岛素分泌缺陷。其功能激活突变和功能失活突变分别导致高胰岛素血症及糖尿病(新生儿糖尿病或MODY)[7-9]。本文报道的先证者及母亲均存在KCNJ11基因突变。
KCNJ11-MODY患者对磺脲类药物敏感,其可直接作用于磺脲类受体,通过关闭K+ATP通道,促进胰岛素分泌,但不同突变其敏感程度大不相同[10-11],携带C166Y、I296L、L164P、T293N等突变位点的患者应用磺脲单药治疗效果欠佳[12]。一项纳入81例KCNJ11突变患者、中位随访时间为10年的研究发现,在服用磺酰脲类药物的患者中,93%能维持良好的血糖控制水平(随访时中位HbA1c为6.4%)[13]。多项研究表明,长期磺脲类药物治疗对KCNJ11相关糖尿病患者是一种可持续和安全的治疗,表现为内源性胰岛素生成的明显恢复,从而使大多数患者的血糖得到良好控制[14]。由于PAX4-MODY较为少见,与其治疗及预后随访相关的报道也较少,有文献指出,PAX4-MODY患者起病初期可通过饮食及口服降糖药物控制血糖,后期则依赖胰岛素治疗[15]。该患者初诊时曾使用胰岛素控制血糖,但效果欠佳。在明确诊断后予磺脲类药物格列齐特降糖治疗,考虑患者超重、平时饮食控制一般,且二甲双胍不耐受,即使最低剂量仍出现恶心呕吐等胃肠道反应,磺脲单药降糖效果可能不佳,且长期使用可能会进一步增加体重,故予联合应用达格列净及利拉鲁肽控制血糖。胰升糖素样肽1受体激动剂(GLP-1RA)、二肽基肽酶4抑制剂(DPP-4i)及钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)等新型降糖药物在常见MODY亚型中的治疗效果已有相关文献报道[16],但多集中于常见的HNF1α-MODY、GCK-MODY和HNF4α-MODY中,在PAX4-MODY及KCNJ11-MODY中的治疗经验有限。Jamaluddin等[17]指出,PAX4、KCNQ1、TCF7L2、KCNJ11、ABCC8、MTNR1B等基因突变可能影响DPP-4i的疗效。通过随访我们观察到,本例患者在调整治疗半年后血糖基本达标,且体重较前明显下降,提示降糖方案有效。同时患者因疫情原因停用GLP-1RA半年后不仅出现体重反弹,且血糖控制欠佳,重新使用GLP-1RA后体重较前下降,血糖和HbA1c控制水平亦较前好转,也间接提示新型降糖药物在该特殊类型糖尿病患者中具有较好疗效。
综上所述,我们首次报道了1例PAX4-MODY合并KCNJ11-MODY,提示MODY患者可同时存在多个基因突变,两个MODY家系在世系婚配过程中可能出现融合。同时,我们通过对先证者的临床特征及治疗转归进行分析,为少见MODY亚型的临床诊治提供参考,对新型降糖药物在MODY患者的应用具有一定启示。
