大颗粒T淋巴细胞白血病相关肾损伤一例
2022-04-25胡楠喻小娟赵涛苏涛
胡楠 喻小娟 赵涛 苏涛
患者,男,63岁,因“发热4周、下肢水肿伴尿量减少23天”于2019年4月24日来我院就诊。患者4周前无明显诱因出现发热,体温最高达38.2 ℃,伴咳嗽、少量白痰,血常规检查结果示淋巴细胞计数5.7×109/L(1.1~3.2×109/L,括号内为正常值参考范围,以下相同),WBC计数、Hb及PLT计数均正常。外院抗感染治疗后体温降至正常。23天前患者出现腹胀、双下肢水肿,伴尿量减少,测血压180/100 mmHg,血肌酐90 μmol/L(53~106 μmol/L),尿常规结果示:蛋白+++(5.98 g/24 h),RBC 5个/高倍镜视野(HPF),抗链球菌溶血素O(ASO)及抗环瓜氨酸多肽(CCP)抗体检查结果为阳性,抗核抗体检查结果为阴性,补体C3 0.88 g/L(0.90~1.80 g/L)。15天前复查淋巴细胞计数4.6×109/L,PLT计数104×109/L(100~300×109/L),血肌酐升至254 μmol/L,遂于1周前来我院就诊。既往史:2年前因多发双手指间关节疼痛伴抗CCP抗体175 IU/ml阳性诊断为类风湿关节炎,同时彩色超声检查结果示脾脏增大。23天前发现高血压,否认糖尿病史。流式细胞术外周血细胞免疫分型检查结果示淋巴细胞约占有核细胞92.7%,其中CD3+CD5-细胞约占淋巴细胞78.4%,表达CD7、CD8、TCRαβ、cCD3,部分细胞表达CD2、CD57,不表达CD4,考虑为异常T淋巴细胞(简称T细胞);骨髓检查结果示TCRB、TCRG基因克隆重排,诊断为大颗粒T淋巴细胞白血病,未治疗。入院体格检查:T 36.8 ℃,Bp 142/74 mmHg,P 75次/分,R 22次/分。全身皮肤黏膜未见皮疹,全身浅表淋巴结未触及肿大,心肺体格检查未见明显异常。腹部稍膨隆,腹软、无压痛,肝脾肋下未触及,移动性浊音(+),双下肢中度可凹性水肿。辅助检查:血常规:中性粒细胞计数0.6×109/L(1.8~6.3×109/L),淋巴细胞计数6.8×109/L,淋巴细胞百分比84.8%(20.0~50.0%),Hb 96 g/L(130~175 g/L),PLT计数76×109/L(125~350×109/L),网织红细胞176.3×109/L(24.0~84.0×109/L)。尿素氮58.59~63.69 mmol/L(1.80~7.10 mmol/L),肌酐280~327 μmol/L(44~133 μmol/L),尿素氮/肌酐比值51.7(10.0~15.0),抗CCP抗体140 RU/ml(<5 RU/ml),尿酸714 μmol/L(150~420 μmol/L),血清白蛋白30.0 g/L(40.0~55.0 g/L),补体C3 0.58 g/L(0.60~1.50 g/L)。尿常规检查结果:比重1.014,RBC 4~7个/HPF,尿蛋白电泳以白蛋白为主(85%),24 h尿蛋白定量10.85 g(<0.15 g),尿钠12.75 mmol/d(170.00~260.00 mmol/d),钠排泄分数(FENa)0.2%。病毒感染筛查(EB病毒、巨细胞病毒、乙型及丙型肝炎病毒等)未见明显异常。CT扫描及超声检查结果提示双侧胸腔积液、心包积液、双肾弥漫性病变,脾脏增大,腹腔大量积液。因患者表现为大量蛋白尿伴血尿、水肿、高血压、肾功能快速下降,考虑为急性肾炎综合征,急性肾损伤2期[改善全球肾脏病预后组织临床实践指南(KDIGO)分期]。抗中性粒细胞胞浆抗体(ANCA)、抗肾小球基底膜(GBM)抗体检查结果均为阴性,结合入院1个月前明确呼吸道感染病史,同时ASO水平升高,低补体C3血症,既往存在明确自身免疫病及血液系统肿瘤病史,考虑为重症增生性肾小球疾病。患者输注PLT后完善肾脏组织病理活检,免疫荧光检查结果示IgG-、IgA-、IgM+、C3++~+++、C1q-、FRA-、ALB-、IgG1-、IgG2-、IgG3-、IgG4-、κ+++、λ+++,肾小球毛细血管壁、系膜区颗粒样沉积。光镜检查结果:肾活检组织可见59个肾小球,21个缺血性硬化,集中分布在肾被膜下,其余肾小球毛细血管腔内细胞弥漫性增生,可见多数淋巴细胞、少量中性粒细胞浸润,部分淋巴样细胞核中等大小,染色质细腻,可见核仁(图1);肾小管上皮细胞空泡及颗粒状变性,多灶状刷毛缘脱落,灶状细胞崩解,裸基底膜形成,管腔内可见细胞碎片;多灶状萎缩,肾间质多灶状淋巴细胞及单核细胞浸润伴纤维化,小动脉管壁增厚伴玻璃样变,内膜纤维性增生硬化。电镜检查结果:肾小球毛细血管腔内细胞弥漫增生,以淋巴细胞样及单核细胞样细胞为主伴异型性(图2),节段系膜区低密度电子致密物沉积,基底膜无明显病变,上皮足突广泛融合。免疫组化检查结果:肾小球内可见较多中等大小异型淋巴细胞浸润,表现为CD20-、CD3+、CD4-、CD8+、TCRβ-、TIA1+、GranzymeB+、CD2-、CD7+、CD56-、Ki67 5%。综上,病理诊断符合肾小球毛细血管内增生性病变,肾小球内为异型大颗粒T细胞免疫表型,符合大颗粒T淋巴细胞白血病(T-LGLL)肾脏损害,同时合并感染后肾炎。最终诊断:T-LGLL伴肾脏内浸润,急性肾损伤(T-LGLL相关),肾小球毛细血管内增生病变伴白血病细胞肾小球内浸润,急性肾小管坏死;感染后肾小球肾炎;类风湿关节炎。建议加用免疫抑制剂治疗,患者要求回当地医院继续治疗,于1周后死于腹腔大出血。
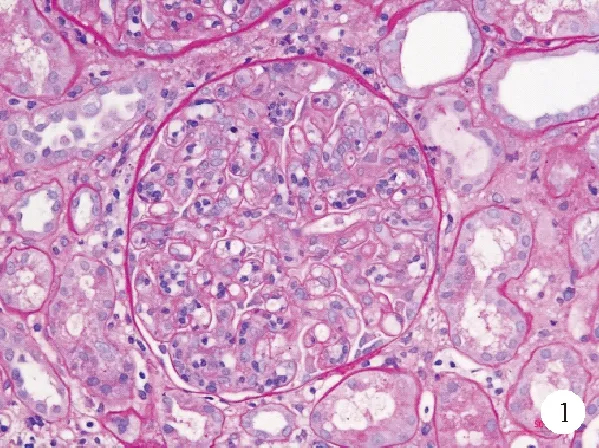
图1 患者肾组织光学显微镜检查结果(过碘酸-雪夫染色,×400)

图2 患者肾组织电子显微镜检查结果(×8 000)
讨 论
T-LGLL是一类少见的惰性淋巴细胞白血病,T细胞克隆性增殖与stat3基因突变、细胞活化后Fas介导的凋亡通路异常有关;也有研究发现外源性(如病毒感染)和内源性抗原持续刺激与T-LGLL发病有关[1-2]。T-LGLL的诊断根据临床表现及外周血细胞形态学、免疫表型分析提示克隆性增殖的大颗粒T淋巴细胞(T-LGL)并排除反应性LGL扩增等情况后可确诊[3-4]。
T-LGLL中T-LGL主要包括有杀伤作用的细胞毒性T细胞,其异常增生引起淋巴细胞亚群失衡、分泌炎症细胞因子[5-6],导致组织损伤。相关文献报告体外培养的T-LGLL患者外周血T细胞分泌FasL、IL-18等炎症因子的水平显著增加[5]。Ribes等[6]报道含有克隆性T细胞的外周血单个核细胞培养上清液可促使肾小管上皮细胞从静止状态到促炎状态的表型转换,其特征是核转录因子κB(NF-κB)核转位和炎性细胞因子或趋化因子的过度表达,表明在肾脏没有淋巴瘤细胞浸润时,循环中的克隆性T细胞可通过激活肾小管上皮细胞或促进具有抗肾脏细胞自身免疫反应活性的T/B细胞群,导致炎症损伤。近期报道的1例T-LGLL患者出现血尿、水肿及急性肾损伤,血清中抗GBM抗体阳性,肾脏组织病理活检结果表现为典型抗GBM病,提出T-LGLL可合并抗GBM病导致肾损伤[7]。此外,也有病例报道提出肾脏淀粉样变性(γ1重链型)可合并T-LGLL[8]。本例患者表现出肾小球毛细血管内皮弥漫增生及肿胀病变,这是导致急性肾损伤的主要病理改变,而另一突出的病理表现是被膜下集中分布的缺血硬化的肾小球,提示上游中等血管病变导致局部缺血。T-LGL与血管病变的关系尚未十分清楚。Audemard等[9]曾总结11例LGLL合并血管炎患者,发现血管炎在LGLL中的发病率为1%,明显高于普通人群,血管炎多累及小血管,偶也可见巨细胞动脉炎,皮肤或肾脏组织病理活检结果可见白细胞碎裂性血管炎、膜增生性肾小球肾炎、毛细血管内增生性肾小球肾炎及坏死性血管炎等,但均未观察到异形淋巴细胞在病变血管周围的浸润。因受穿刺肾活检取材的限制,我们无法观察上游中等血管病变的性质和程度。但本病例首次提出在T-LGLL患者的肾脏血管内皮周围可以观察到T-LGL浸润,并伴有相临近的内皮细胞增生,提示克隆性的细胞毒性T细胞作为效应细胞可能引起血管内皮损伤。
然而,导致本例T-LGLL患者发生急性肾损伤的原因较为复杂。T-LGLL因反复感染,可导致感染相关的肾脏疾病。本例患者出现低补体血症,肾脏可见补体C3沉积、电子致密物系膜区沉积的增生性肾小球疾病表现,感染后肾炎诊断明确。此外,本例患者无低血压表现,但出现血清尿素氮/肌酐比值显著升高、钠排泄分数下降及低蛋白血症,提示肾小球毛细血管内皮病变、低蛋白血症导致的肾灌注下降是加重T-LGLL患者肾损伤的原因之一。
本例男性患者有多发双手指间关节疼痛、抗CCP抗体阳性,诊断为类风湿关节炎。既往研究报道T-LGLL可合并多种自身免疫性疾病,其中最常见的是类风湿关节炎,在T-LGLL中可达11%~36%,大部分发生在T-LGLL确诊前[10]。且类风湿关节炎同样是以T细胞参与为主的自身免疫病,文献报告克隆性T-LGL在类风湿关节炎中的检出率为3.6%,提示两种疾病间存在关联。Lamy等[11]认为合并自身免疫性疾病是T-LGLL启动治疗的指征之一。
本例患者为少见T-LGLL引起的急性肾损伤,由此提示临床医生应提高对血液病患者合并肾脏疾病的认识,特别需要加强多学科之间的合作,以提高诊断的正确率。
