一例猪蓝耳病、伪狂犬病、猪链球菌病和副猪嗜血杆菌病混合感染的诊治
2022-04-25张垚垚王嘉珍程家园陈万杰
张垚垚,李 国,陆 阔,王嘉珍,程家园,陈万杰,李 郁
(安徽农业大学动物科技学院,安徽 合肥 230036)
猪蓝耳病是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种损害猪只繁殖系统以及呼吸系统的病毒性免疫抑制性传染病。妊娠母猪感染PRRSV后会出现流产现象,产死胎和木乃伊胎,保育猪感染后则表现出生长发育性能大幅降低[1]。猪伪狂犬病是由猪伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性传染病,其临床表现为妊娠母猪流产,产木乃伊胎、死胎或弱仔,初生仔猪和保育猪呕吐、腹泻、震颤、咳嗽及神经症状[2]。猪链球菌病是由猪链球菌(Streptococcus suis, SS)感染引起的人畜共患病,根据荚膜多糖抗原特性的不同,SS可分为35种血清型,即1~34型和1/2型[3]。该病可导致脑膜炎、败血症、肺炎、心内膜炎和关节炎,给养猪业带来重大经济损失。副猪嗜血杆菌病是由副猪嗜血杆菌(Haemophilus parasuis,HPS)引起的猪的一种传染病。临床上常出现关节炎、脑膜炎和浆膜炎等症状,其对保育阶段的猪只造成的威胁最大,常与其他病毒或细菌以混合感染的形式存在[4]。近年来,随着养殖规模的扩大、养殖密度的增加、动物与动物产品的频繁调运,种用动物的引进以及饲养管理不当等众多因素,使动物疫情发生日益频繁,多种病原混合感染现象较为常见,给养殖业造成巨大的威胁。文章以一例保育猪PRRSV、PRV、SS和HPS混合感染为例,对其进行总结报告,旨在为该类病原混合感染的防控提供借鉴。
1 发病情况和临床症状
某省一规模化肥育场现存16 000头保育猪。2021年9月中下旬该猪场部分60日龄保育猪自断奶后陆续发病,发病率约为10%,死亡率50%,病猪临床表现为消瘦、腹式呼吸、神经症状及急性死亡等症状。该猪场猪群均未进行疫苗免疫;对发病保育猪使用磺胺甲氧嘧啶、氟苯尼考、头孢噻呋及阿莫西林治疗均无明显效果。
2 样品详情和病理变化
该猪场于2021年9月28日送检7份保育猪病料组织(均为肺脏、肝脏、脾脏)至安徽农业大学动物传染病研究室进行检测,自编号为1—7,均取自60日龄保育猪。肺脏均有出血、淤血;肝脏均质脆、淤血,呈黑紫色;脾脏均质脆、淤血,呈黑紫色。
3 实验室检测
3.1 细菌和病毒核酸检测
将1—7号病料组织分别混样后进行研磨,取其上清液,分别用OMEGA微量DNA提取试剂盒和天隆科技病毒DNA/RNA提取试剂盒提取上清液中核酸作为模板。通过PCR方法检测6种细菌核酸和2种病毒核酸,包括SS、HPS、猪胸膜肺炎放线杆菌(APP)、多杀性巴氏杆菌(Pm)、猪丹毒丝菌(ER)、沙门氏菌(Salmonella)、PRV、猪圆环病毒2型(PCV2)。所用引物见表1,由通用生物(安徽)股份有限公司合成。通过实时荧光定量RT-PCR方法检测3种病毒核酸,即PRRSV、猪瘟病毒(CSFV)和非洲猪瘟病毒(ASFV)核酸。按照世纪元亨PRRSV、CSFV和ASFV通用型实时荧光RT-PCR检测试剂盒说明书操作。

表1 SS、HPS、APP、Pm、ER、Salmonella、PRV、PCV2鉴定引物序列
检测结果见图1。1号病猪SS、PRRSV和PRV核酸检测阳性,2号病猪PRRSV和PRV核酸检测阳性,3号病猪PRRSV核酸检测阳性,4号病猪为SS核酸检测阳性,5号病猪PRRSV核酸检测阳性,7号病猪SS、HPS、PRRSV和PRV核酸检测阳性,其余病原核酸检测均为阴性。通过世纪元亨PRRSV分型实时荧光RT-PCR检测试剂盒对PRRSV进行毒株类型检测,结果显示,PRRSV是非美洲型经典毒株、高致病性变异毒株和类NADC-30毒株的美洲型毒株。
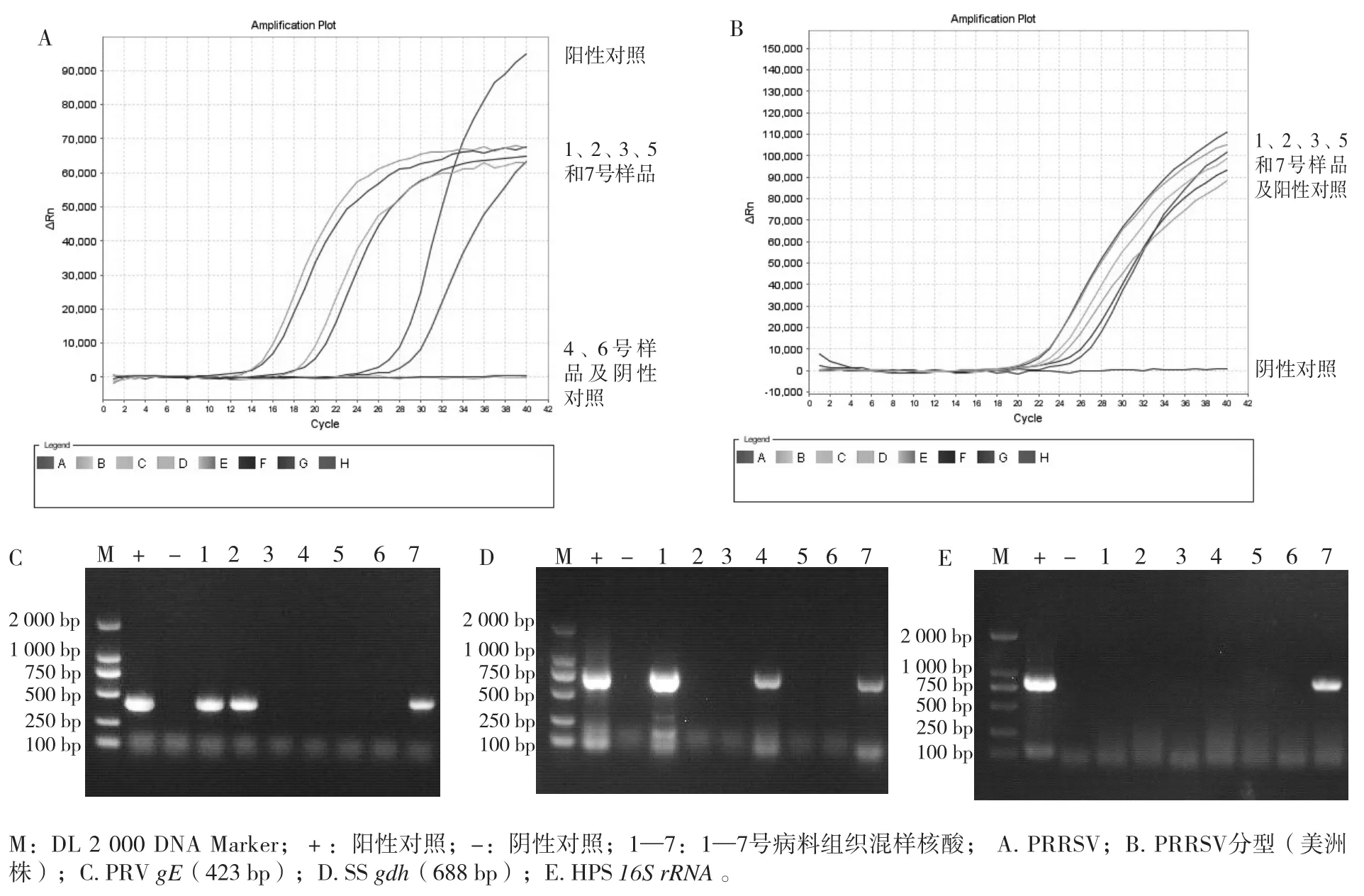
图1 病原检测结果
3.2 细菌分离培养及鉴定
3.2.1 细菌分离培养与形态学观察 无菌采集7头病猪的病料深层组织,分别划线接种于含5%小牛血清和1.5%烟酰胺腺嘌呤二核苷酸(NAD)的胰酪大豆胨琼脂(TSA)培养基,采用需氧培养方式,置37 ℃条件下培养18~24 h,观察细菌的生长情况,并挑取单个可疑菌落进行革兰氏染色,镜检,观察其形态特征。结果显示,在TSA培养基(含5%小牛血清和1.5% NAD)上存在两种不同形态的菌落:一种菌落呈灰白色半透明、表面光滑、边缘整齐针尖状,镜检为革兰氏阳性菌,显微镜下呈球形或卵圆形,链状排列;另一种菌落呈无色透明、光滑湿润、针尖状,镜检为革兰氏阴性菌,显微镜下呈球状、短杆状或长丝状。
3.2.2 分离菌PCR鉴定 利用煮沸法提取分离菌基因组DNA作为模板,通过PCR方法对分离菌进行鉴定,引物同表1。结果显示,自1号病猪肺脏和肝脏各分离出1株SS,4号病猪肺脏和脾脏各分离出1株SS,7病号猪肺脏分离出1猪SS和1株HPS,共计5株SS和1株HPS。见图2、图3。

图2 SS分离菌PCR鉴定结果
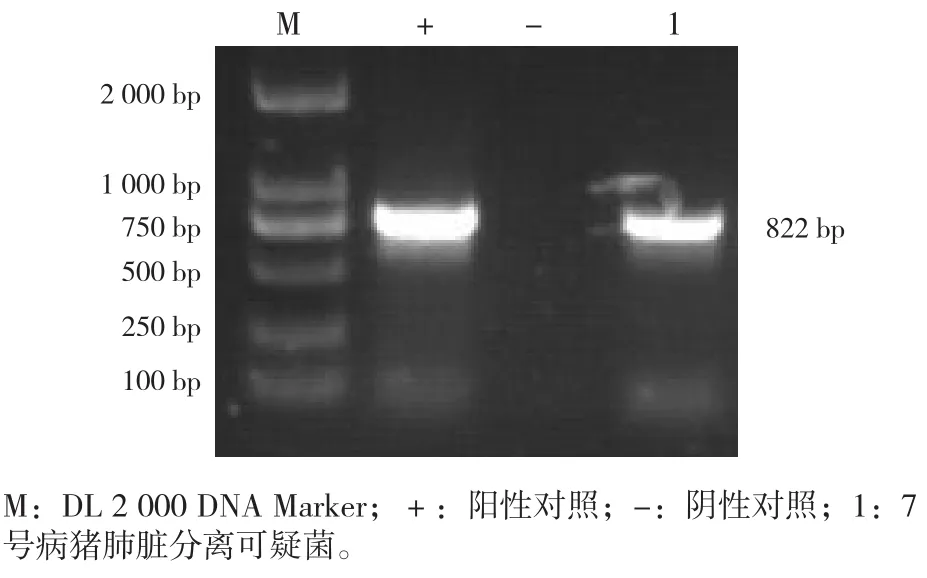
图3 HPS分离菌PCR鉴定结果
3.2.3 SS和HPS分离菌血清型鉴定 根据文献[5-6],利用PCR方法对分离的5株SS和1株HPS进行血清型鉴定。结果显示,1号病猪肺脏和肝脏分离的2株SS均为血清5型(720 bp),4号病猪肺脏分离的1株SS为血清9型(368 bp),脾脏分离的1株SS为血清29型(278 bp),7号病猪肺脏分离的1株SS为血清21型(160 bp),1株HPS为血清4型(320 bp)。见图4、图5。

图4 SS血清型PCR鉴定结果
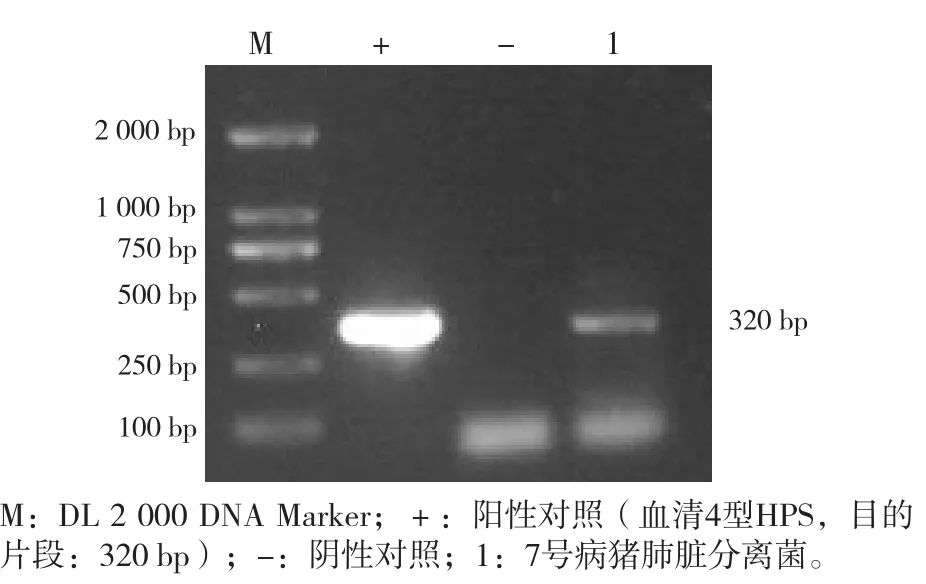
图5 HPS血清型PCR鉴定结果
3.3 药物敏感性试验
利用纸片琼脂扩散法(K-B法)进行药敏试验,挑取5株SS和1株HPS分离菌的纯培养物接种于TSB(含5%小牛血清和1.5% NAD)中培养18~24 h,校正菌液浓度至0.5麦氏比浊,在TSA培养基(含5%小牛血清和1.5% NAD)表面均匀涂布,室温干燥5 min后,选择18种药敏纸片贴于琼脂表面,置37 ℃条件下培养18~24 h后观察结果。根据美国临床试验室标准委员会(CLSI/NCCLS)2016执行标准判定结果。
结果显示,5株SS分离株均对头孢唑林、阿莫西林敏感;均对复方新诺明、四环素耐药;对青霉素、庆大霉素、氧氟沙星等抗菌药物表现不同程度的耐药。1株HPS分离株对卡那霉素、氧氟沙星、青霉素等抗菌药物敏感;对链霉素、恩诺沙星、环丙沙星中度敏感;对氟苯尼考、复方新诺明、头孢唑林等抗菌药物耐药。见表2、表3。
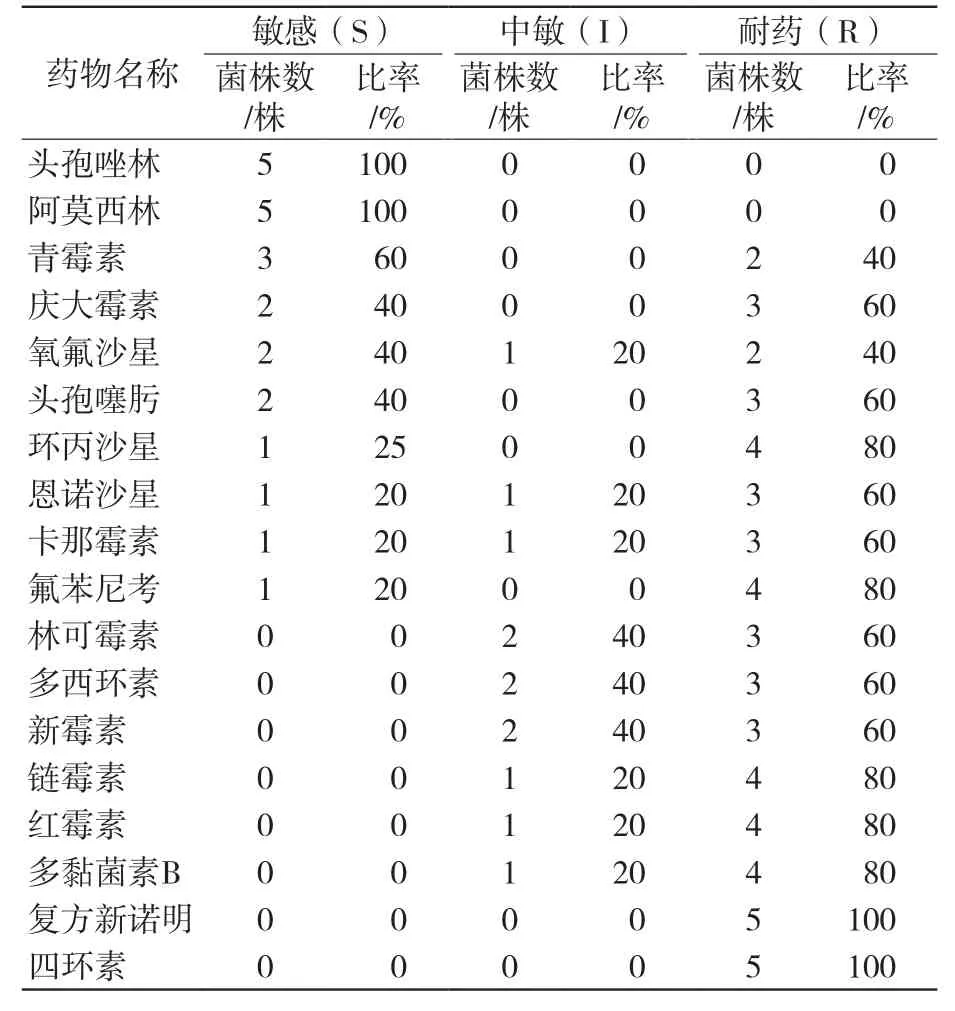
表2 5株SS分离株药敏试验结果

表3 1株HPS分离株药敏试验结果
4 诊断
根据流行病学调查、病猪临床症状、病理变化以及实验室检查结果,判定该猪场发病保育猪主要感染PRRSV(非美洲型经典毒株、高致病性变异毒株和类NADC-30毒株的美洲型毒株),同时混合感染PRV、SS和HPS。
5 讨论
近年来,养猪业发展模式由散养向集约化、规模化快速转变,加上猪病错综复杂,使猪场疾病的混合感染呈现升高趋势,给猪病的诊断和防治带来了一定的难度。在本病例中,病原核酸检测结果显示,PRRSV(美洲型毒株)阳性率为71.4%(5/7),而PRV和SS阳性率为42.9%(3/7),HPS阳性率为14.3%(1/7),提示PRRSV(美洲型毒株)是引起该猪群发病的主要病原。PRRSV属于免疫抑制性病原,猪只感染后会导致肺部巨噬细胞大量裂解,使巨噬细胞数量急剧减少,进而致使机体对其他细菌或病毒病原的免疫抵抗力下降[7],极易继发PCV2、PRV、SS、HPS、APP、Pm等常见病原。PRRSV分为欧洲型和美洲型两种血清型,在我国均有相关报道[8-9],而主要流行的是美洲型毒株,如广西地区检出率为25.6%(45/176)[10],天津地区检出率为26.3%(104/396)[11],安徽地区检出率为53.6%(223/416)[12],北京、辽宁和湖南地区检出率为44.0%(88/200)[13]。
猪蓝耳病和猪伪狂犬病均为免疫抑制性传染病,其引发的免疫抑制常导致其他多种病毒或细菌的混合感染,且尚无特效治疗药,因此疫苗免疫接种变得尤为重要。然而,该猪场保育猪均未进行任何疫苗免疫接种,加上60日龄的保育猪基本不再携带母源抗体,这就大幅增加PRRSV和PRV感染的几率。目前疫苗接种是防控猪蓝耳病和猪伪狂犬病的有效途径。我国主要以经典Bartha-K61株gE基因缺失疫苗来预防猪伪狂犬病,而针对猪蓝耳病主要有两种疫苗,即灭活疫苗和弱毒活疫苗。
本病例中,利用PCR方法对分离菌及血清型进行鉴定。从7头病猪分离到1株HPS和5株SS,其中1株HPS为血清4型,为我国主要流行血清型之一[14-17];5株SS有4种血清型,分别为血清5、9、21和29型,表明该场SS血清型呈现复杂多样的特点,给防治细菌性疾病带来较大的困难。SS、HPS为条件致病菌,与PRRSV、PRV等免疫抑制性病原混合感染时,更容易造成猪群死亡率升高,这可能是该猪场死亡率高的重要原因。抗生素疗法对细菌性疾病的治疗具有不可替代的作用,但抗生素的不合理使用或滥用导致细菌耐药性的产生,使得一些菌株对抗生素表现出不同水平的抗性。因此,在对病猪治疗前,通过药物敏感性试验筛选敏感药物,不仅能有效降低发病率和死亡率,而且在一定程度上减少细菌耐药性的产生。本病例中5株SS和1株HPS对阿莫西林、头孢唑林、青霉素等β-内酰胺类抗生素敏感,这与国内有关报道[18-19]基本一致,但该猪场曾使用阿莫西林等药物,无明显治疗效果,猪群仍持续发病并死亡,提示SS和HPS并非原发性病原。根据药敏试验结果,可了解该猪场细菌耐药性情况,为进一步合理用药提供依据,有利于细菌性疾病的治疗和防控计划的制定。
根据流行病学调查、病猪临床症状、病理变化以及实验室检查结果,判定该猪场存在PRRSV、PRV、SS、HPS多病原混合感染情况。为最大化降低养殖户经济损失,应积极采取综合防制措施,如加强饲养管理、药物防治、预防接种等,从而有效避免或减少疫病的传播和暴发。
