毒胡萝卜素诱导PC12 细胞凋亡的实验研究
2022-04-23黄赛玉
严 利,黄赛玉
(湘潭医卫职业技术学院临床学院,湖南 湘潭 411101)
凋亡(apoptosis)是缺血后神经元死亡的一种重要形式,凋亡信号途径包括外源性途径、内源性途径和内质网应激(endoplasmic reticulum stress,ERS)途径[1,2],其中前二者为经典凋亡途径,ERS 为近年来发现的一种新的凋亡途径[3]。毒胡萝卜素(Thapsigargin,TG)是一种不可逆性内质网钙离子ATP 酶抑制剂,可诱导内质网应激,而应激的持续存在将导致细胞凋亡[4]。目前,脑缺血后神经元凋亡的发生机制尚未明确,仍有待进一步研究。本研究主要探讨毒胡萝卜素诱导大鼠肾上腺髓质嗜铬细胞瘤(PC12)细胞的凋亡机制,以期为缺血后神经元凋亡的防治提供新的作用靶点。
1 材料与方法
1.1 材料 PC12 细胞株购自中国科学院上海细胞生物研究所;1640 培养基(Hyclone),胎牛血清和胰酶消化液(Gibco),青-链霉素溶液(碧云天),Thapsigargin 和MTT(Sigma),JNK3 和GM130(Proteintech),Caspase-3(CST),Annexin V-FITC/PI 双染细胞凋亡(长沙维尔生物有限公司),BCA 蛋白定量试剂盒(Wellbio),HRP goat anti-mouse IgG(Proteintech),HRP goat anti-rabbit IgG(Proteintech),Super ECL Plus 超敏发光液(Thermo pierce),显影液和定影液(WellBiology)。
1.2 细胞培养 PC12 细胞在含10%的胎牛血清、1%青-链霉素双抗的RPMI-1640 培养基中进行培养,培养装置为5%CO2、37 ℃饱和湿度培养箱,隔天换液,取细胞形态良好、对数生长期的细胞进行实验。
1.3 药物浓度及实验分组 1 mg 装的Thapsigargin 溶于1 ml DMSO 溶液中,储液浓度为1 mg/ml。取1 μl加入到10 ml 完全培养基中,终浓度为0.1 μg/ml。PC12 细胞分别经正常情况下培养5 h(正常组)和加入浓度为0.1 μg/ml的Thapsigargin 处理5 h(Thapsigargin 组)进行以下实验。
1.4 方法
1.4.1 MTT 法检测 两组设3 个复孔,处理5 h 后,每孔加入25 μl 溶解于DMEM的MTT 溶液(5 mg/ml),在培养箱中孵育4 h,弃掉培养液,加入150 μl DMSO 溶液,37 ℃摇床低速振荡10 min,用酶标仪检测细胞在490 nm 处的吸光度(A)值,计算出PC12 细胞的存活率。
1.4.2 Annexin V-FITC/PI 双染法检测 PC12 细胞凋亡率严格按照Annexin V-FITC/PI 双染细胞凋亡试剂盒(货号:KGA108)的说明书检测PC12 细胞凋亡率。用不含EDTA的胰蛋白酶进行消化,以冰冷的PBS 洗涤2 次,离心(2000 rpm/min,5 min)后收集细胞,收集(1~5)×105细胞。除去上清液,滴入500 μl Binding buffer 悬浮细胞,加入5 μl Annexin V-FITC及5 μl PI 使用液使其混匀,置于室温下避光5~15 min 后,1 h 内采用流式细胞仪检测其荧光强度。
1.4.3 Western blot 蛋白印迹法检测 收集两组PC12细胞,提取总蛋白,使用蛋白定量试剂盒检测蛋白浓度,按每孔上样量50 μg 进行SDS-PAGE 电泳,恒流冰浴电转至PVDF 膜上,5%牛血清白蛋白室温封闭2 h,加入相应一抗,抗JNK3(1∶500)、Caspase-3(1∶1000)和β-actin(1∶4000),4 ℃孵育过夜。用TBST 洗3 次,每次10 min。加入相应二抗37 ℃孵育1 h,TBST 漂洗4 次,ECL 显影和采图。β-actin 为内参,利用Quantity one 软件将目标条带与β-actin 条带吸光度值之比调为其蛋白表达水平的相对值。
1.5 统计学方法 采用SPSS 18.0 统计软件对数据分析,计量资料以()表示,比较采用LSD-t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 PC12 细胞的形态观察 PC12 细胞的形态呈圆形或锥形,贴壁不稳,易成团,胞间有突起相互连接,细胞折光性好,可见胞核,细胞状态稳定后生长速度快,成簇生长,见图1。
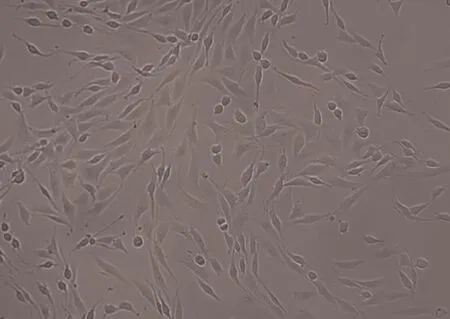
图1 显微镜观察正常培养条件下PC12 细胞的形态及结构(10×40)
2.2 Thapsigargin 对PC12 细胞存活率的影响 经0.1 μg/ml Thapsigargin 处理5 h的PC12 细胞存活率较正常培养的细胞明显减少。Thapsigargin 组吸光度A 值为(0.1497±0.0357),低于正常组的(0.2573±0.0093),差异有统计学意义(t=5.0490,P=0.0070)。
2.3 Thapsigargin 对PC12 细胞凋亡率的影响 正常组PC12 细胞绝大部分均为双阴性细胞,细胞结构完整,无明显细胞凋亡或死亡,而经Thapsigargin 处理后PC12 细胞的凋亡率明显增加,见图2。Thapsigargin 组早期凋亡率及总凋亡率高于正常组,差异有统计学意义(P<0.05),见表1。
表1 两组PC12 细胞凋亡率比较(,%)
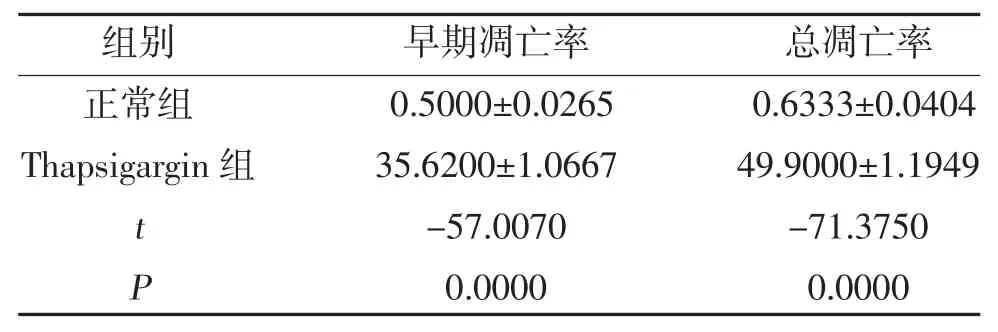
表1 两组PC12 细胞凋亡率比较(,%)
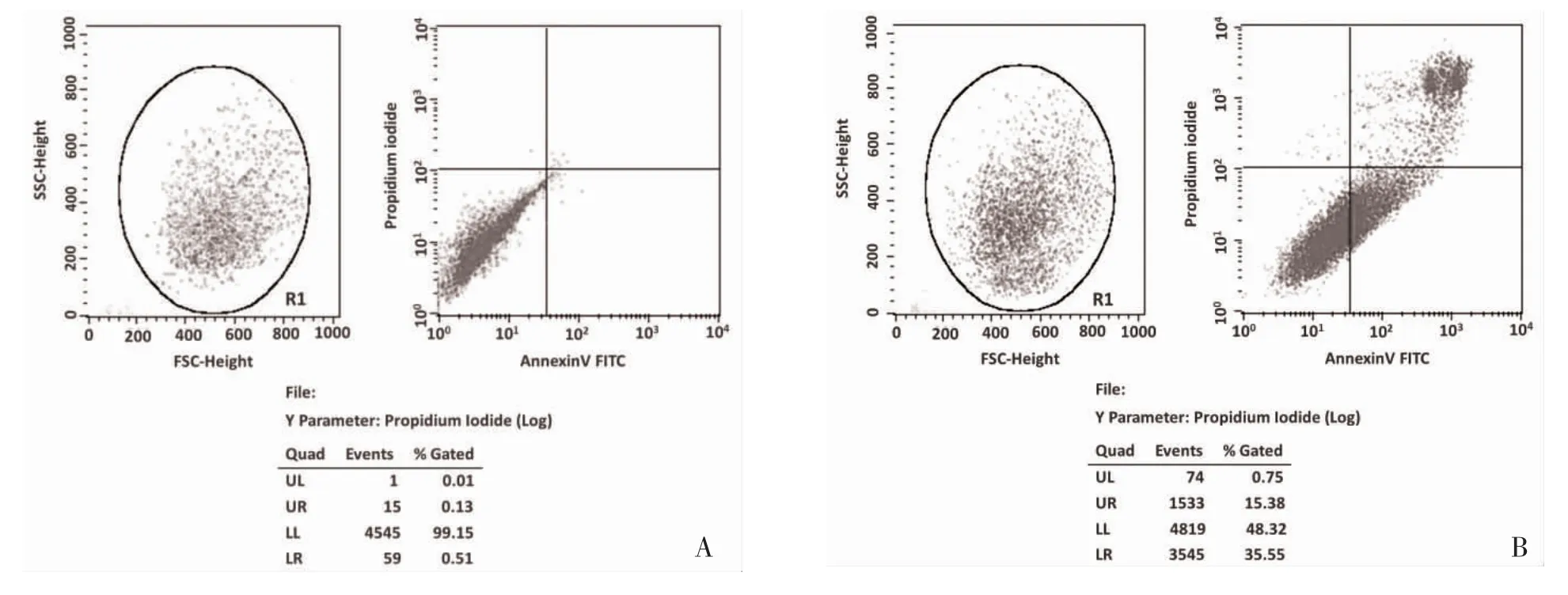
图2 AnnexinV-FITC/PI 法检测PC12 细胞的凋亡率流式细胞分析图
2.4 Thapsigargin 对PC12 细胞JNK3、Caspase-3 蛋白表达的影响 Thapsigargin 组JNK3、Caspase-3 蛋白表达高于正常组,差异有统计学意义(P<0.05),见表2。
表2 两组JNK3、Caspase-3 蛋白表达比较()
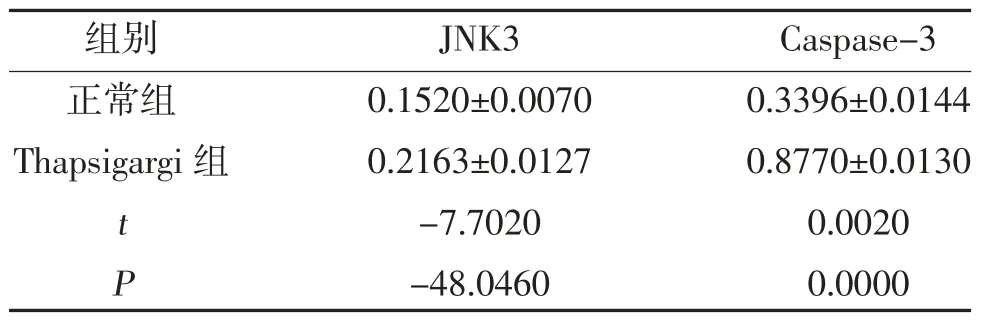
表2 两组JNK3、Caspase-3 蛋白表达比较()
3 讨论
随着人口老龄化的加剧及卒中危险因素的不断增多,脑卒中发病率逐年上升。脑卒中作为神经系统常见病、多发病,具有高复发率、高致死率、高致残率的特点,目前已经成为全世界成人中第2 死亡原因和第1 致残原因[5,6],其存活者中有50%~70%的患者会遗留严重残疾,给家庭和社会带来巨大的压力和沉重的经济负担[7]。卒中类型以缺血性卒中最常见,约占全部卒中类型的80%。脑缺血是由于血栓或栓子阻塞脑内动脉而导致血管闭塞,引起脑组织缺血缺氧、神经元受损的一系列临床症状和体征[8]。缺血后神经元的凋亡发生是一种多环节调控过程,包括兴奋氨基酸的释放、钙离子稳态失衡、热休克蛋白表达受阻及血脑屏障破坏等过程[9,10]。内质网作为细胞凋亡途径的调节器越来越受到重视。研究表明[11],Thapsigargin 可抑制内质网钙泵功能,诱导内质网中储藏钙的释放,增加胞质中Ca2+浓度,导致Ca2+环境失衡,引起神经元凋亡。本研究中利用Thapsigargin诱导PC12 细胞,建立缺血后神经元损伤模型,通过MTT 法检测存活率和Annexin V-FITC/PI 法检测凋亡率,结果显示Thapsigargin 组早期凋亡率及总凋亡率高于正常组,差异有统计学意义(P<0.05),提示经Thapsigargin 组处理后PC12 细胞的存活率较正常组明显减少,凋亡率较正常组明显增加。
JNK 是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族中的重要成员,主要参与细胞存活与凋亡、增殖与分化等多个生物学过程。JNK 主要包括JNK1、JNK2、JNK3 3 个成员,其中JNK3 是JNK 信号通路中非常重要的异构体之一,主要分布在中枢神经脑组织中,与神经元的凋亡关系密切[12,13]。大量的炎性介质、细胞因子、应激可以激活JNK3及其后的信号转导,有研究表明[14],帕金森病患者中JNK3 磷酸化可导致神经元损伤。此外,JNK3 可介导百草枯和鱼藤酮诱导的多巴胺能神经元死亡[15]。JNK3 还可启动Bcl-2、Caspase-3 等信号,介导神经细胞凋亡[16]。半胱氨酸蛋白酶-3(caspase-3)为细胞凋亡途径中的重要因子,在调节细胞凋亡过程中具有重要意义[17]。帕金森病动物实验中发现[18],脑细胞发生凋亡形态改变,其中有Caspase-3 被激活。Zhang Y 等[19]研究表明,在肌萎缩性脊髓侧索硬化症动物模型中,Caspase-1 和Caspase-3 被激活,同时发现Caspase-1 和Caspase-3的mRNA 表达水平明显增加。王丽晶等[20]在脑卒中相关性肌萎缩实验模型中发现,抑制Caspase-3 通路激活,可抑制肌细胞凋亡,增加肌纤维横截面积,对抗脑卒中相关性肌萎缩。本研究中Thapsigargin 组JNK3、Caspase-3 蛋白表达高于正常组,差异有统计学意义(P<0.05),提示JNK3、Caspase-3 可能参与了神经细胞损伤过程。Caspase-3 作为脑缺血损伤中发生神经细胞凋亡的一个关键酶以及执行者,抑制Caspase-3的活性,可在一定程度上减缓或阻止缺血性脑卒中的进程。
综上所述,经Thapsigargin 处理后PC12 细胞凋亡率增加,JNK3、Caspase-3 蛋白表达增加,推测Thapsigargin 诱导的神经元内质网应激中,可通过激活JNK3及其后的信号通路,促进Caspase-3 表达,介导神经细胞凋亡。
