PCI 对RelA的影响及血运重建后的作用机制研究
2022-04-23曹培东
曹培东,桂 春
(广西医科大学第一附属医院心内一科,广西 南宁 530021)
动脉粥样硬化(atherosclerosis)是一种以强烈的免疫活性为特征的炎症性疾病,经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是临床上最常见的治疗动脉粥样硬化性狭窄的方法。随着对该病认识的加深,选择性免疫调节干预可能是抗动脉粥样硬化治疗的新方向,然而血运重建后的免疫调节的相关机制尚未明确。RelA 又称NF-κB3、MGC131774 和p65,是NF-κB 家族的5 个成员之一。NF-κB 转录因子家族作为连接免疫和炎症的中心介质,是先天和后天免疫反应的关键参与者[1]。其中,RelA 转录因子对调节T 细胞活化和稳定至关重要[2]。本研究旨在验证PCI 对RelA 水平的影响,分析血运重建后RelA 可能的作用机制,现报道如下。
1 材料与方法
1.1 材料 收集2019-2021 年广西医科大学第一附属医院收治的冠状动脉狭窄≥90%的14 例动脉粥样硬化患者冠脉支架植入术前和术后的血清样本,患者均无心梗、中风、糖尿病病史。人磷酸化核转录因子p65(pNF-KB P65)酶联免疫分析(ELISA)试剂盒从上海酶联生物科技有限公司购买。人冠状动脉平滑肌细胞(HCASMCs)由武汉普诺赛生命科技有限公司提供。RelA-RNAi 慢病毒及阴性对照病毒购买于上海吉凯基因。
1.2 ELISA 检测及筛选目的基因 采用Elisa 法检测术前和术后血清中RelA的水平,每例重复3 次。芯片数据GSE28829 来自开放数据库GEO,包含13 个早期和16 个晚期颈动脉粥样硬化斑块样本。利用GEO2R分析GSE28829,选择校正后P<0.05 和|logFC|≥1的基因。在开放访问网站PubMed2ensembl 中输入“血运重建(revascularization)”“免疫调节(immunoregulation)”提取所有非重复基因。三者交集为目的基因。
1.3 功能富集分析 利用在线工具DAVID 对目的基因进行功能富集分析,其中基因本体论(GO)对涉及生物过程(BP)、细胞成分(CC)和分子功能(MF)的基因进行注释[3];京都基因和基因组百科全书(KEGG)处理基因组、生物途径、疾病和药物[4]。
1.4 构建蛋白质相互作用(PPI)网络和分析关键基因(Hub gene)使用开放数据库STRING 评估目的基因的PPI 信息,综合得分>0.4的被选为显著[5]。使用软件Cytoscape 3.8.2 构建PPI 可视化网络[6]。分子复合物检测(MCODE)用于发现给定网络中紧密连接的节点,筛选并可视化PPI 网络中的重要模块基因,筛选条件为等级截止=2,k-core=2,节点分数截止=0.2,最大深度=100(degree cut-off=2,k-core=2,node score cut-off=0.2,max depth=100)。PPI 中的Hub 基因通过CytosHubba 根据最大团簇中心性(MCC)原则,选择最短路径中的前6 个基因并进行功能富集分析。
1.5 TRRUST 数据库验证 结合位点TRRUST v2,根据用户输入的功能/途径/表型基因,查询关键调控因子并进行优先排序[7]。
1.6 实时定量PCR 将RelA-RNAi 慢病毒和阴性对照病毒分别转染HCASMCs,提取总RNA,用紫外分光光度计测定其浓度和纯度。用2-△△ct法分析mRNA的相对表达水平。
1.7 统计学方法 使用SPSS 23.0 统计学软件进行数据分析,计量资料以()表示,采用独立样本配对t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 PCI 手术前后RelA 水平比较 以标准品的水平为横坐标,OD 值为纵坐标,绘制标准曲线,并计算样品中RelA 水平(表1、图1)。术前RelA 水平为(13.59±2.69)μg/L,术后RelA 水平为(9.71±2.28)μg/L,支架置入前后RelA 差值为(3.88±3.68)μg/L,差值95%CI:1.75~6.01。术前RelA 水平高于术后,差异有统计学意义(t=3.939,P=0.002)。
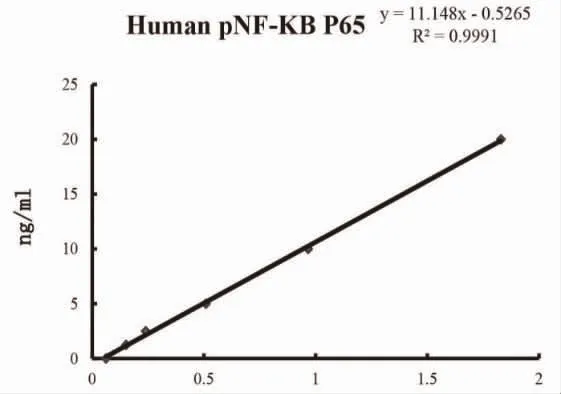
图1 RelA 水平的ROC 曲线图
表1 血清样本中RelA的浓度(,μg/L)
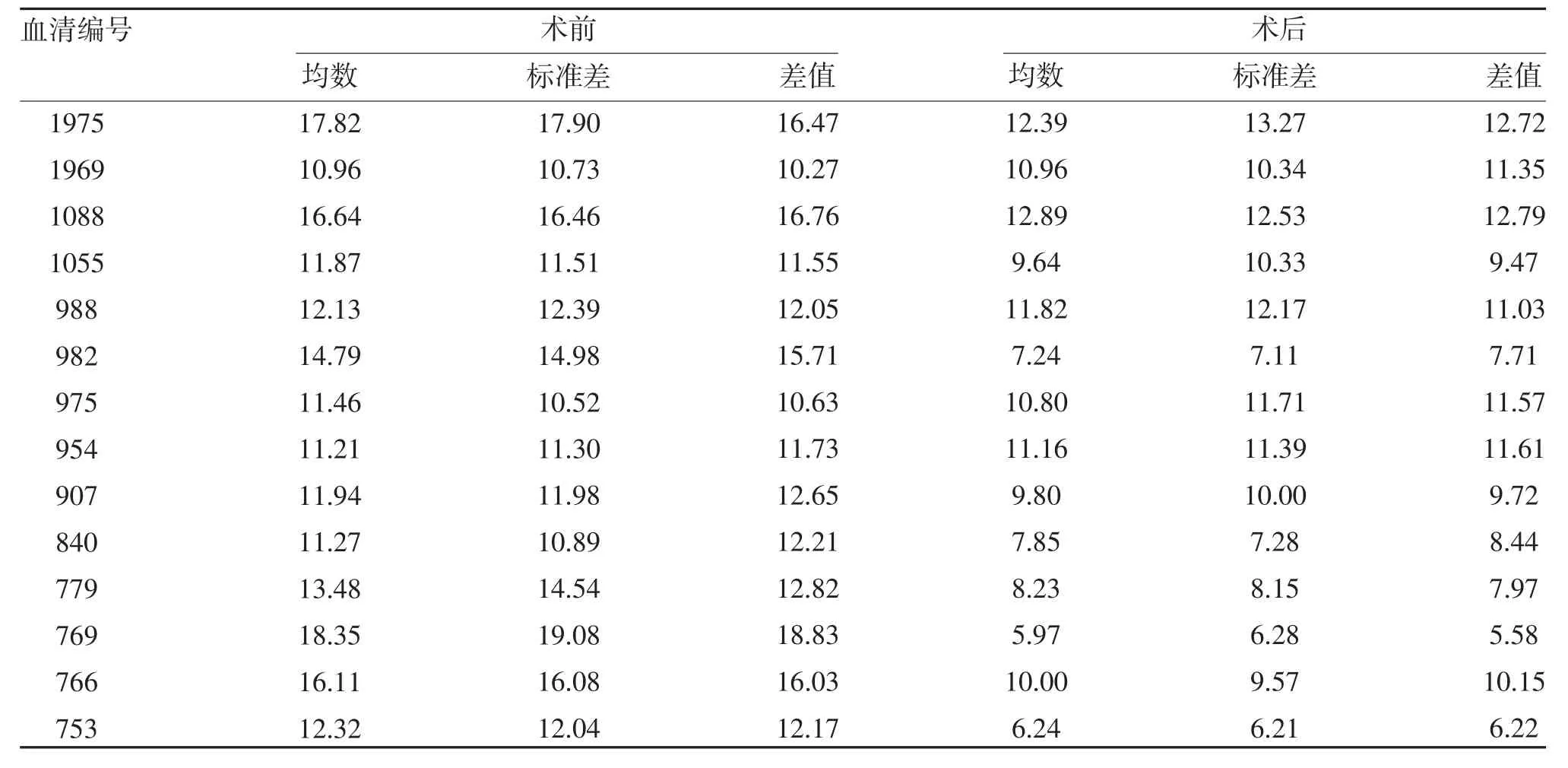
表1 血清样本中RelA的浓度(,μg/L)
2.2 目的基因的功能富集分析 利用GEO2R 分析,获得217 个与“动脉粥样硬化”相关的基因。在PubMed2ensembl 中获得了581 个与“血运重建”相关的基因,615 个与“免疫调节”相关的基因。三者之间的10 个重叠基因为目的基因(图2)。对其功能富集分析可见,目的基因主要通过白细胞跨内皮迁移途径参与防御反应(图3)。
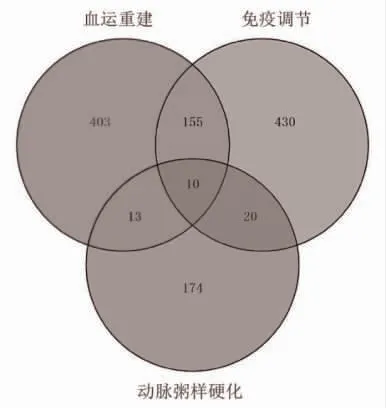
图2 目的基因图
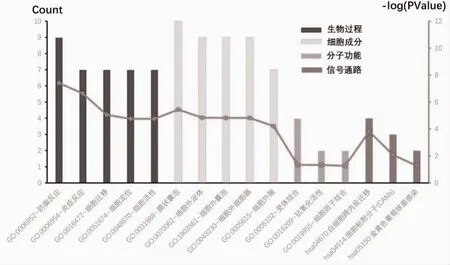
图3 目的基因的功能富集分析
2.3 Hub 基因的获得与功能分析 基于STRING 数据库构建的可视化PPI 网络(图4),模块基因(图5),由8 个节点和24 条边组成。根据MCC 方法筛选的6 个Hub 基因,包括PTPRC、ITGAM、VCAM1、MMP9、CXCR4 和SPP1,并均属于模块基因(图6)。富集分析显示,模块基因与目的基因的作用方向一致,其中关键基因主要富集在白细胞的跨内皮迁移途径中(表2)。

表2 模块基因的功能富集分析(前2 名)

图4 目的基因的PPI 网络

图5 模块基因

图6 关键基因
2.4 可调控关键基因的转录因子分析 在TRRUST数据库中,MMP9、VCAM1、CXCR4 均受RelA的靶向调节,见表3。
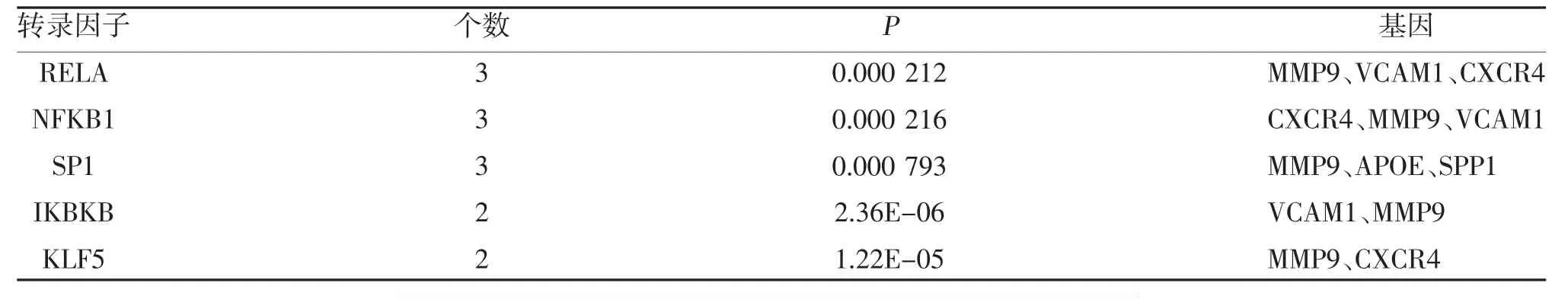
表3 可调控关键基因的转录因子分析
2.5 RelA 调控Hub 基因的mRNA 表达分析 抑制RelA 可降低HCASMCs 中VCAM1的mRNA 表达,促进MMP9 和CXCR4的mRNA 表达,见图7;引物序列见表4。

图7 实时定量PCR 检测

表4 引物序列
3 讨论
动脉粥样硬化是一种脂质驱动的中大动脉进行性炎症疾病[8]。随着人们对疾病的认识,有证据表明[9],动脉粥样硬化是一种基于病变内免疫激活和细胞因子信号传导的免疫介导疾病,免疫反应参与动脉粥样硬化的各个阶段。目前,动脉粥样硬化性疾病通常通过血管成形术和支架术来实现血管重建,但介入部位的炎症反应导致的再狭窄可能会再次降低治疗效果。因此,动脉内膜切除术和经皮介入等血管手术后再狭窄是动脉粥样硬化区抗炎治疗的首要条件[10]。随着免疫抑制剂对T 细胞免疫抑制作用的发现和对VSMCs 增殖的抑制,术后再狭窄以药物洗脱支架的形式得以预防[11]。然而,血运重建后的免疫调节机制尚未完全阐明。
RelA/p65 作为NF-κB 家族的成员之一,含量最为丰富,并具有特殊的反式激活结构域,是炎症反应基因的有效转录激活剂[12],可调控多个下游靶基因的转录活性,参与多种重要的细胞活动。已有研究表明[13],lncRNA H19 可通过上调RelA 促进动脉粥样硬化。miR-520c-3p 通过下调RelA 来抑制PDGF-BB介导的增殖、迁移和G2/M 期细胞百分比的降低,进而抑制动脉粥样硬化斑块形成[14]。此外,IL-8 诱导的中性粒细胞胞外陷阱通过激活巨噬细胞中的NF-κB 信号加重动脉粥样硬化[15]。本研究结果发现,PCI 术后RelA 水平较术前降低(P<0.05),这可能有利于减轻PCI 术后的炎症反应。
此外,本研究中生物信息学分析表明,参与血运重建后的免疫调节基因主要与防御反应有关,并通过白细胞跨内皮迁移途径发挥作用。白细胞通过激活的静脉壁迁移是一种基本的免疫反应,启动了白细胞在静脉壁内和通过静脉壁的极化运动,受刺激的血管细胞将导致一过性屏障的破坏[16]。因此,白细胞不受控制的跨内皮迁移能够加剧动脉粥样硬化进展[17]。同时,本研究结果显示,与免疫调节相关的VCAM1、MMP9 和CXCR4 均受RelA的直接调控,且RelA的降低抑制了HCASMCs 中VCAM1的mRNA 表达,促进了MMP9 和CXCR4的mRNA 表达。已有研究表明[18-20],VCAM1的表达能够促进炎症反应,加重动脉粥样硬化病变,CXCR4的表达则抑制动脉粥样硬化的炎症反应,限制动脉粥样硬化进展。MMP9 在动脉粥样硬化患者中表达较高[21],其水平升高不仅与斑块不稳定有关[22],还可增加炎性细胞因子的分泌,是心脏重塑中炎症反应的潜在生物标志物。因此,PCI 术后RelA的降低主要通过调节白细胞跨内皮迁移途径参与了免疫调节作用。
综上所述,PCI 术后RelA的降低参与了免疫调节,并主要发挥抑制炎症反应的作用,但其上调的MMP9 与斑块不稳定有关,这对PCI 术后的免疫调节治疗具有一定的指导意义。
