玫瑰花复合煎剂的毒性及免疫活性研究
2022-04-23郑小娟
郑小娟


[摘要]目的:玫瑰花复合煎剂的急性毒性反应及对小鼠免疫活性的研究。方法:采用最大耐受剂量法,以15000.mg/(kg·BW)剂量玫瑰花复合煎剂给予小鼠灌胃,观察动物在一周内的活动及中毒情况,考察小鼠是否有死亡现象,并进行大体解剖观察病理改变;在加S9与不加S9混合液的条件下进行Ames试验,以2.5、5.0、.10.0.g/(kg·BW)玫瑰花复合煎剂灌胃小鼠,进行小鼠骨髓嗜多染红细胞微核试验、小鼠精子畸形试验。保健功能试验:以300、600、1200.mg/(kg·BW)剂量组连续灌胃小鼠30天,另设玫瑰花组和蒸馏水阴性对照组,测定脏器/体重比值,小鼠的迟发型变态反应(耳肿胀法),小鼠抗体生成细胞数(Jerne改良玻片法)以及NK细胞活性(乳酸脱氢酶测定法),以考察其增强免疫力的作用。结果:急性经口毒性实验中,小鼠一般表现和行为均未见异常且无死亡;三项遗传试验结果均为阴性,未见遗传毒性;增强免疫力实验中,与阴性对照组相比,玫瑰花复合煎剂300、600、1200.mg/(kg·BW)各剂量组的小鼠左右耳片重量差值、溶血空斑数有显著性差异(P<0.05);600、.1200.mg/(kg·BW)剂量组小鼠NK细胞活性均有显著性差异(P<0.05);玫瑰花组小鼠左右耳片重量差值、溶血空斑数与阴性对照组相比均有显著性差异(P<0.05)。结论:玫瑰花复合煎剂无明显的急性毒性反应,属无毒级,且无遗传毒性;玫瑰花与黄精组成配伍联合应用其增强免疫功能较玫瑰花单方更加显著。
[关键词]玫瑰花;黄精;急性毒性;遗传毒性;免疫
[中图分类号]R392.11.
[文献标识码]A.
[文章编号]2096-5249(2022)03-0184-03
玫瑰花是蔷薇科植物玫瑰的干燥花蕾[1],《本草纲目拾遗》载:“玫瑰花活血、行血、健脾降火、理气调经、滋补养颜”。传统中医认为,玫瑰花甘、微苦,具有行气解郁、止痛和血及活血散瘀等功效,常用于肝胃气痛、月经不調,跌扑伤痛等,常被用来当作茶饮。
黄精为百合科黄精属(Liliaceae)的干燥根茎,主要包括滇黄精Polygonatum kingianum Coll.Et Hemsl、黄精Polygonatum sibiricum Red或多花黄精Polygonatum cyrtonema Hua[2]。主要化学成分有多糖、皂苷、蒽醌等[3]。药典记载,黄精性平、味甘,具有补气养阴、益肾健脾的功效。李时珍引《神仙草芝经》云:“黄精宽中益气,使五脏调和,肌肉充盈,骨髓坚强,其力倍增,多年不老,颜色明显,发白更黑,齿落更生”。我国传统医学认为,黄精可长期用于治疗脾胃虚弱、精血不足、肾虚亏损、倦乏无力等,自古以来就被认为是补益类中药中的上品[4]。
玫瑰花在免疫方面的试验研究较少,本研究主要探讨以玫瑰花及玫瑰花配伍黄精后对小鼠免疫指标的影响,同时对其毒理学试验进行评价,为临床应用提供一定的实验基础。
1材料与对象
1.1实验动物
昆明种小鼠420只,选用苏州大学昭衍新药研究中心培育的SPF级小鼠(合格证编号201900963)。雌雄各半,体重18~22g。
1.2受试物与试剂
玫瑰花组:取玫瑰花300g,加入12倍量水提取2次,每次2h,滤过,合并2次提取液减压浓缩至1g/mL。
玫瑰花复合煎剂:取玫瑰花、黄精各300g分别加入12倍量水提取2次,每次2h,滤过,合并2次提取液减压浓缩至1g/mL。实验时用蒸馏水配制,冷藏保存。
1.3主要仪器和试剂
100μL微量注射器、电子分析天平、手术器械、723分光光度仪、RPMI1640玻片架、显微镜、离心机、二氧化碳培养箱、SRBC、Hank’s液、DNFB、丙酮、乳酸脱氢酶、恒温水浴等。
1.4实验方法
急性经口毒性实验:采用最大耐受剂量法,设玫瑰花复合煎剂15000mg(/kg·BW)一个剂量组,小鼠20只,雌雄各半,随机分为给药组和对照组,均按20mL(/kg·BW)经口灌胃。灌胃前动物禁食12h,不限饮水。对照组灌胃等体积的生理盐水,期间试验小鼠正常饮食和饮水。连续观察一周,观察外表体征、精神状态等,每天记录小鼠的体重、饮水量、进食量的变化以及动物的中毒表现以及是否有死亡现象发生,实验结束后处死动物做大体解剖[5]。
遗传毒性试验:(1)Ames试验。将受试物高压灭菌后置于4°C冰箱保存,试验前用无菌去离子水等比例进行稀释,设立浓度为8、40、200、1000、5000μg/皿5个剂量组,采用平板掺入法,在加与不加体外活化系统(S9混合液)的条件下进行。试验同时设立溶剂对照组、未处理对照组(自发回变组)和阳性对照组。若受试物的回变菌落数高于自发回变菌落数的2倍以上,且具有一定的剂量反应关系,则表明细菌回复突变试验结果为阳性,整个试验在相同的条件下重复进行一次。(2)小鼠骨髓嗜多染红细胞微核试验。小鼠雌雄各半,随机分成5组(n=10),即2.5、5.0、10.0g(/kg·BW)剂量组,阳性对照组注射环磷酰胺40mg/kg,阴性对照组灌服等体积蒸馏水。给药2次,间隔24h,第2次给药后6h,将动物处死,制骨髓涂片、晾干、甲醇固定、Giemsa染色。镜检PCE,计算微核率。(3)小鼠精子畸形试验。雄性小鼠随机分成5组(n=10),即2.5、5.0、10.0g(/kg·BW)剂量组,阴性对照组和环磷酰胺阳性对照组(40mg/kg)。按20mL(/kg·BW)容量灌胃5d,继续喂养1个月,35d后处死,取出其两侧睾丸、附睾,放入生理盐水离心管中,制成精子悬液,过滤、滤液涂片,用体积分数1%的伊红染色,晾干,油镜下检查精子形态,记录畸形精子数,计算精子畸形率。
1.5增强免疫力实验
剂量选择:玫瑰花复合煎剂设300、600、1200mg(/kg·BW)三个剂量组,另设玫瑰花组和蒸馏水阴性对照组。各组小鼠每日灌胃量均为0.2mL/10(g·BW),连续灌胃30d。
脾脏/体重比值、胸腺/体重比值:试验结束时称量动物体重,于处死动物后,取出脾脏和胸腺,并进行称重,计算脾脏/体重比值、胸腺/体重比值。
二硝基氟苯诱导小鼠DTH试验(耳肿胀法):在小鼠右耳两面均匀涂抹DNFB溶液,以此进行攻击。攻击后24h颈椎脱臼处死小鼠,剪下左右耳壳,按要求进行称重。用左右耳重量之差表示DTH的程度。方法参照《保健食品检验与评价技术规范》(2003年版)试验方法进行[7]。
抗体生成试验(Jerne改良玻片法):脱纤维绵羊红细胞免疫5d处死动物,取脾脏制成脾细胞悬液,将表层培养基加热溶解后,放45~50°C水浴保温,与等量中性2倍的Hank’s液混合,分装小试管,每管0.5mL,向管内加入50μL10%SRBC,25μL脾细胞悬液,迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,待凝固后,放入二氧化碳培养箱1.5h,用SA緩冲液稀释的补体
(1∶8)加入到片架凹槽内,继续温育1.5h,计数溶血空斑数。
NK细胞活性测定(乳酸脱氢酶LDH测定法):颈椎脱臼处死小鼠,制备浓度为2×107个/mL的脾细胞悬液。将脾细胞和靶细胞YAC-1细胞各100μL分置于96孔培养板中,参考保健食品检验与评价技术规范(2003年版)操作,在490nm处测定OD值,计算NK细胞活性率。
1.6统计学分析
所有数据采用SPSS21.0软件进行处理。计量资—料用(x±s)表示,组间比较采用t检验;计数资料用[n(%)]表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2结果
2.1急性经口毒性实验
给予玫瑰花复合煎剂后,小鼠一般表现和行为均未见异常,观察期内未见动物死亡,灌胃最大给药剂量连续观察7d小鼠外观、精神等均无异常。对照组和给药组平日进食量和饮水量无显著差异,未出现毒性反应。实验结束时处死动物,大体解剖肉眼观察未见病理异常改变。说明玫瑰花复合煎剂对小鼠急性经口MTD值均大于15000mg(/kg·BW),按急性毒性分级,该受试物属于无毒级。
2.2遗传毒性试验结果
对TA97、TA98、TA100和TA102试验菌株,不同浓度受试物在加和不加S9条件下的回变菌落数与阴性对照组无显著差异(P>0.05),而阳性对照组回变菌落数均高于阴性对照组回变菌落数2倍以上(P<0.05)。玫瑰花复合煎剂细菌回复突变试验检测结果为阴性,重复试验仍得出相同结果。
与阴性对照组比较,玫瑰花复合煎剂各剂量组微核率无显著性差异(P>0.05);与阴性对照组比较,环磷酰胺阳性对照组微核率有显著性差异(P<0.01)。
与阴性对照组比较,玫瑰花复合煎剂各剂量组小鼠精子畸形率无显著性差异(P>0.05);与阴性对照组比较,环磷酰胺阳性对照组小鼠精子畸形率有显著性差异(P<0.01)。
2.3免疫功能试验结果
连续灌胃30d后,玫瑰花组、玫瑰花复合煎剂300、600、1200mg(/kg·BW)三个剂量组动物的脾脏/体重比值、胸腺/体重比值与阴性对照组相比,均无显著性差异(P>0.05),见表1。
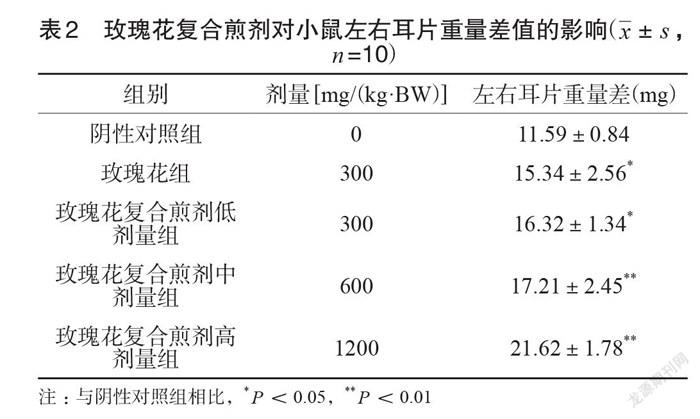
连续灌胃30d后,与阴性对照组相比,玫瑰花复合煎剂三个剂量组动物的左右耳片重量差值,300、600、1200mg(/kg·BW)三个剂量组动物均有显著性差异(P<0.05)。玫瑰花片组左右耳片重量差值也明显增加(P<0.05),见表2。
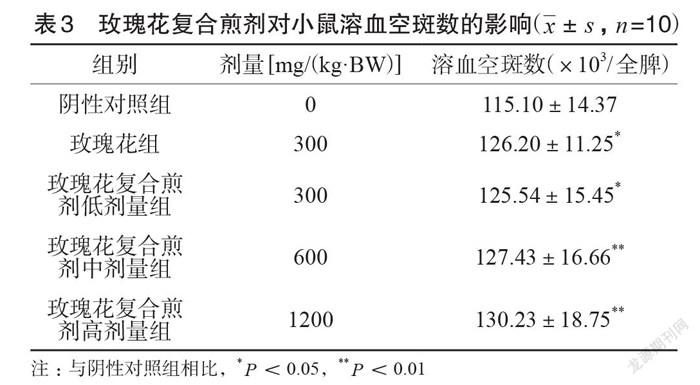
连续灌胃30d后,玫瑰花复合煎剂三个剂量组动物的溶血空斑数与阴性对照组相比,300、600、1200mg(/kg·BW)三个剂量组动物均有显著性差异(P<0.05)。玫瑰花片组溶血空斑数也明显增加(P<0.05),见表3。
连续灌胃30d后,玫瑰花复合煎剂三个剂量组、玫瑰花组动物的NK细胞活性与阴性对照组相比均有不同程度的增加,玫瑰花复合煎剂600、1200mg(/kg·BW)剂量组有显著性差异(P<0.05),见表4。
3结论
免疫是机体识别和排除抗原性异物,维护自身生理平衡和稳定的一种功能。人体的免疫系统由免疫器官(如胸腺、脾脏等)、免疫细胞(如吞噬细胞、淋巴细胞等)和免疫分子(如补体、细胞因子等)所组成,通过先天性免疫(非特异性免疫)和获得性免疫(特异性免疫)来执行,发挥免疫防御、免疫稳定和免疫监视三大功能。
玫瑰花含有黄酮类、多酚、多糖等多种化学成份,具有免疫调节、抗氧化、抗癌抗菌、降血脂和预防心脏病等生理活性[8]。黄精在临床中是重要的扶正固本类中药,常被用于补益脾肾、填精补肾,增强机体免疫的功效。黄精多糖作为黄精中主要的有效成分,具有多种生物活性[9-10],沈建利等[11]以黄精多糖(100、400、800mg/kg)灌胃环磷酰胺诱导的免疫抑制模型小鼠,免疫抑制小鼠的脏器指数、血清溶血素水平及吞噬指数显著提高(P<0.05);表明黄精多糖可增强机体免疫力。叶绍凡[12]的研究显示,给予黄精多糖,可显著提高运动小鼠胸腺指数、脾脏指数、CD3+、CD4+、CD4+/CD8+、巨噬细胞吞噬率、吞噬指数,与单纯运动组相比差异具有统计学意义,且作用呈现剂量相关性。提示黄精多糖可提高长期力竭训练小鼠的免疫能力,具有显著免疫增强效应。
本研究实验结果表明玫瑰花、黄精复合煎剂连续灌胃小鼠30d后,能显著提高小鼠的迟发变态反应、溶血空斑数以及NK细胞活性。可初步判定,玫瑰花及黄精配伍可增强动物细胞免疫、体液免疫和NK细胞活性,具有增强免疫力的功能,且功效较玫瑰花单用更加显著。本实验毒理结果表明,玫瑰花与黄精复合煎剂对小鼠急性经口毒性试验结果MTD值>15000mg(/kg·BW),属无毒级,小鼠骨髓嗜多染红细胞微核试验、小鼠精子畸形试验、Ames试验均未见遗传毒性,为用药剂量及安全性提供了参考。
