1 株血清7 型副猪嗜血杆菌的分离与鉴定
2022-04-22徐彦召宋会帅王子龙赵肖肖王建威李政良胡建和
徐彦召,宋会帅,王子龙,赵肖肖,王建威,李政良,胡建和,王 青
(河南科技学院动物科技学院,河南 新乡 453003)
副猪嗜血杆菌病(Haemophilus parasuisdisease)也称格拉泽氏病(Glasser's disease)。副猪嗜血杆菌病的病原为副猪嗜血杆菌(Hacmophius parasuis,HPS),属巴斯德氏杆菌科嗜血杆菌属,为革兰氏阴性细菌,显微镜下形态呈小短杆至长丝状。2020 年,经过详细的系统发育分析,副猪嗜血杆菌被重新命名为Glaesserella parasuis[1-2]。临床上该菌可感染仔猪和青年猪。发病猪表现为多发性浆膜炎、关节炎或脑膜炎等临床症状,成年猪多表现为隐性感染[3-4]。HPS对养猪业造成巨大的经济损失[5-6]。目前,养殖企业依靠抗菌药物治疗该病。但因抗生素的不合理使用,HPS对临床中常用的抗生素的耐药性愈发严重,抗生素残留也是动物性食品安全方面的重要隐患。自2020年7月1日起,我国已全面禁止在饲料中添加抗生素,力求养殖过程中减少使用抗生素,为社会提供安全、健康的动物性食品[7-8]。因此,亟须研究新的预防与治疗方法应对副猪嗜血杆菌病。
本研究从猪场送检的病料中分离得到1株HPS菌株,按照参考文献[1]中报道的血清型鉴定方法对分离株进行血清型鉴定,该菌株属于血清7型HPS,为进一步研究HPS致病机理提供参考。
1 材料与方法
1.1 试验材料
病料采自河南省南阳市某规模化猪场疑似感染HPS的病猪肺脏、胸腔积液。
金黄色葡萄球菌(ATCC25923)保存于河南科技学院预防兽医学实验室。
1.2 试剂与仪器
主要试剂:烟酰胺腺嘌呤二苷酸(NAD)、2×Taq PCR Master Mix、胶回收试剂盒、DNA Marker,均购自北京索莱宝生物科技有限公司;胎牛血清购自浙江天杭生物科技有限公司;胰酪大豆胨琼脂培养基(TSA)、胰酪大豆液体培养基(TSB)等相关的细菌培养基,均购自青岛高科技园区海博生物技术有限公司。
主要仪器:Trobot PCR 仪(Biometra 公司)、凝胶成像系统(Bio-Rad 公司)、Quanta 200 扫描电子显微镜(FEI 公司)、SW-CJ-1FD 超净工作台(苏州净化设备有限公司)、TG16-WS 离心机(湖南湘仪实验室仪器开发有限公司)、电泳仪(北京六一生物科技有限公司)、HITACHI-1010 离子溅射仪(日立公司)。
1.3 试验方法
1.3.1 细菌的分离、纯化培养及形态学观察
送检的病猪肺脏、胸腔积液等病料经表面消毒,于超净工作台中采用无菌操作,分别接种于含5%胎牛血清与1% NAD 的TSA 培养基(以下简称TSA 培养基),5%的CO2培养箱中37 ℃培养24~48 h,观察分离细菌的菌落形态,挑取针尖大小、透明光滑的露珠状可疑的菌落进一步纯化培养。
将疑似HPS菌落的纯培养物采用无菌PBS稀释,分别接种于常见的细菌分离培养基(麦康凯培养基、普通琼脂培养基)进行初步分离鉴定,观察分离细菌的生长状况。
于TSA培养基挑取可疑菌落进行细菌涂片、革兰氏染色,光学显微镜下观察,并将纯化后的细菌命名为NY2020株。
1.3.2 分离细菌的卫星试验
将上述分离菌株于TSA培养基上划线培养,次日挑取单克隆于TSB液体培养基(含5%胎牛血清与1%NAD)中培养至对数生长期。
无菌条件下,蘸取对数生长期的NY2020 株菌液水平划线于绵羊鲜血琼脂平板上;将培养至对数生长期的金黄色葡萄球菌(ATCC25923)于分离株NY2020 垂直方向划线,37 ℃继续培养24~36 h,观察分离株NY2020与金黄色葡萄球菌共同培养是否出现卫星生长的现象。
1.3.3 分离细菌的生化试验
于超净工作台中,采用接种环取少量上述分离的细菌菌液接种于生化管中,向生化管中加入5 μL的NAD因子,采用液体石蜡密封细菌生化培养管,37 ℃恒温培养
12~16 h,观察细菌生化反应管中的颜色变化。
1.3.4 分离细菌的PCR鉴定
将1.3.1 中分离纯化得到的分离株NY2020 接种于TSB液体培养基,37 ℃250 r/min培养过夜;取少量接种于TSA固体培养基中,继续培养过夜;挑取透明、露珠状的单菌落接种于TSB 液体培养基,37 ℃250 r/min 培养至对数生长期,以培养菌菌液为模板进行PCR鉴定。
1.3.5 分离细菌的电镜观察
将1.3.1 中分离纯化得到的分离株NY2020 接种于TSB 液体培养基,37 ℃250 r/min 培养过夜,3 000 r/min 离心收集菌体;菌体经2.5%戊二醛固定、不同浓度乙醇进行梯度脱水(无水乙醇脱水2次)、叔丁醇再次干燥菌体、离子溅射仪喷金,于环境扫描电子显微镜下观察分离株NY2020细菌的形态。
1.3.6 分离细菌血清型鉴定及其系统进化树的建立
根据参考文献[1]报道的HPS血清型多重PCR鉴定方法,设计应用于鉴定HPS 16S rRNA 的特异性鉴定引物HPS-UP或HPS-DP,结合目前国内流行的HPS血清型,设计应用于鉴定分离株血清型的一系列鉴定引物。
以纯化的NY2020 株菌液为模板,采用HPS-UP 或HPS-DP 和HPS 血清型鉴定引物分别扩增分离菌的16S rRNA 和funQ 基因,将得到的PCR 产物进行电泳检测,初步鉴定为阳性的样品送往生工生物工程(上海)技术服务有限公司进行测序。将所测得的分离株的funQ基因序列与NCBI中已登录的其他HPS参考株的序列进行同源比对并构建系统进化树。
2 结果与分析
2.1 分离株的分离纯化与形态观察(见图1)
由图1(a)可知,将疑似HPS感染的猪病料样品接种于TSA 培养基上,培养24 h 后,可见半透明、针尖状、露珠样菌落。由图1(b)可知,将分离菌进行革兰氏染色后,于普通光学显微镜油镜下观察,菌体呈红色,可初步判断分离细菌为革兰氏阴性菌;细菌呈短杆状分散排列。
将分离菌接种于常见的细菌分离培养基(麦康凯培养基和普通琼脂培养基)中,细菌无法生长。初步判定该分离菌的形态及革兰氏染色与HPS相符,将纯化后的细菌命名为NY2020株。

图1 分离株的菌落形态和染色鉴定Fig.1 Colony morphology and staining identification of isolated bacteria
2.2 分离株NY2020的卫星试验鉴定结果(见图2)
由图2 可知,与金黄色葡萄球菌接近的分离株NY2020 的菌落较大,离金黄色葡萄球菌较远的分离株NY2020 的菌落较小,说明金黄色葡萄球菌在生长过程中可为分离株NY2020 提供必需的生长因子,符合HPS 细菌的生长特性。

图2 分离株NY2020的卫星试验结果Fig.2 Satellite growth phenomenon result of isolated strain NY2020
2.3 分离株NY2020的生化试验鉴定结果(见表1)
将分离菌株接种于含NAD 因子的生化微量鉴定管,5%CO237 ℃条件下培养24 h。生化特性表明,该分离菌无法分解硫化氢、乳糖、肌醇、蔗糖、麦芽糖、甘油醇、葡萄糖。
参考《伯杰细菌鉴定手册》中HPS的生长特性,该菌生化鉴定结果基本符合HPS菌的生化培养特征。

表1 分离株NY2020的生化试验鉴定结果Tab.1 Biochemical test identification results of isolated strain NY2020
2.4 分离株NY2020的PCR及血清型鉴定(见图3)
由图3可知,采用HPS 通用型引物于821 bp处可以扩增得到一条清晰的核酸条带,采用7型HPS特异型性引物在490 bp 处可见一条清晰条带,与预期结果一致,确定该分离株NY2020为血清7型HPS。
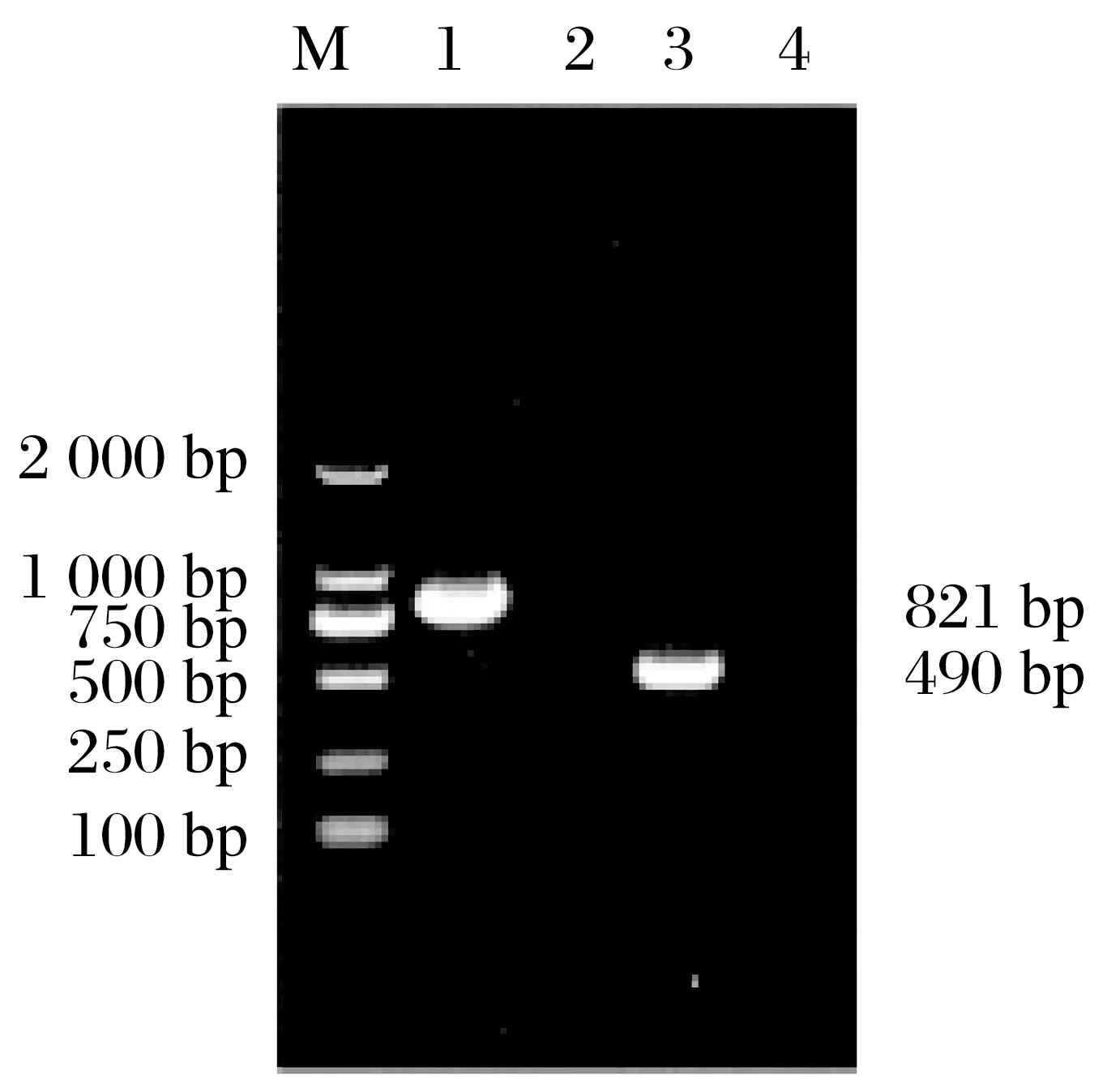
图3 分离株NY2020的PCR鉴定Fig.3 PCR identification of isolated strain NY2020
2.5 分离株NY2020的扫描电镜观察结果(见图4)
由图4可知,分离株NY2020经固定、脱水、干燥、喷金处理,在扫描电子显微镜观察下观察细菌形态,菌体呈短杆、长杆状。

图4 分离株NY2020的扫描电镜观察结果Fig.4 Scanning electron microscope observation results of isolated strain NY2020
2.6 分离株NY2020 16S rRNA的系统进化分析(见图5)
由图5 可知,分离株NY2020 16S rRNA 与GenBank 中HPS(登录号:AY126705.1)序列的同源性为100%,与血清7型HPS AY126705.1株为同一分支,进一步证实了该分离株NY2020为血清7型HPS。

图5 分离株NY2020的系统进化树Fig.5 Phylogenetic tree of isolated strain NY2020
3 讨论
感染HPS 可导致感染猪出现食欲减退、关节肿胀、呼吸困难、鼻腔有分泌物排出、流产以及共济失调等症状,严重可导致死亡;仔猪感染后可在短时间内发病,病死率高;急性发病康复后的仔猪有可能出现慢性关节炎等症状,严重影响猪后期的生长速度,延长猪的育肥周期,降低饲料转化率,影响企业的经济效益[2-3]。HPS对营养要求相对较高,临床中分离该菌相对较为困难。本研究对送检样品进行初步的流行病学分析,并针对性地采用含有NAD 因子和胎牛血清的TSA培养基进行HPS的分离,成功从送检病料中分离得到1 株HPS。与传统的细菌分离方法相比,该分离方法降低了因HPS 生长缓慢而容易被其他杂菌竞争性抑制而造成分离失败的风险,提高了HPS的分离效率。
HPS 具有多种血清型。传统的HPS 血清型鉴定方法需要实验室中储备各种血清型的标准样品,加大了临床中该菌的血清型鉴定难度,延长了鉴定时间[9-10]。本试验依据已报道的HPS PCR 鉴定方法[11],参考当前国内流行的HPS 血清型,采用HPS 通用鉴定引物,确定所分离的细菌为HPS;采用血清型特异的鉴定引物进行多重PCR,确定分离细菌的血清型。通过上述操作可快速鉴定所分离HPS的血清型,操作方法简单且不易受外界条件的干扰。
HPS 主要有15 种血清型,其中以4、5、13 型HPS 最为常见。HPS不同血清型之间细菌的毒力不尽相同,3、6、7、9和11型为无毒力菌株,感染猪群后不会导致猪群产生临床症状[12]。Ruiz等[13]研究发现,副猪嗜血杆菌毒力与膜蛋白有关。抗生素是预防和治疗HPS 感染以及各种细菌性疾病的常用手段,但因耐药性和药物残留等问题,选择适合的敏感药物替代抗生素将成为主要策略。
疫苗预防仍然是预防传染病最经济有效的手段,但目前主要研究的多为4型、5型、12型和13型灭活疫苗[14]。副猪嗜血杆菌血清型多且不同菌株毒力存在差异,尚无1种灭活菌苗同时可对所有的致病菌株产生交叉保护力。因此,研制具有交叉保护意义的HPS疫苗是预防和控制副猪嗜血杆菌病必然要求。
4 结论
本试验成功分离并鉴定了一株血清7 型HPS,进一步丰富了HPS的菌株资源,为研发具有交叉保护作用的HPS疫苗提供了素材。
