三株球孢白僵菌的分离鉴定与其对粘虫的室内毒力
2022-04-22郑吉阳
程 茵,郑吉阳,王 敦
(西北农林科技大学昆虫学研究所,杨凌 712100)
粘虫Mythimna separate(Walker)又名剃枝虫,属于鳞翅目,夜蛾科,因其迁飞性、暴食性、群聚性等特点[1],成为粮食作物的毁灭性害虫。粘虫在世界范围内分布广泛,除了我国以外,印度、孟加拉国、日本、澳大利亚和新西兰等国家也都经历过由粘虫危害导致的严重作物损失,早在 20世纪 50 年代粘虫就被列为我国农业发展中的重大害虫之一[2,3]。虫害发生严重时,会在短时间内吃光叶片,只剩下叶脉,造成玉米的严重减产甚至绝收[4,5],其可以取食的植物类型多达14个科,300多种,特别喜欢取食禾本科植物,例如玉米和水稻等作物[6,7]。在我国,除新疆外全国各地均有粘虫发生,间歇猖獗为害、且属于迁飞性害虫[8-10],历史上粘虫灾害曾多次暴发,其为害面积广,造成了严重的经济损失[11]。目前,粘虫主要依靠化学农药进行防治,在防治过程中,由于大量使用有机氯、有机磷类、拟除虫菊酯类杀虫剂,使粘虫产生了较严重的抗药性,化学防治难以实现预期的效果[12],另外,在化学防治过程中,滥用、过度使用农药,也造成严重的环境污染,危害了人畜健康。因此,探寻高效、环保的生物防治资源是生产上的迫切需求。
球孢白僵菌Beauveria bassiana是最早发现的虫生真菌,在自然界分布广,寄主多,对很多农林害虫致病力强,可侵染15目149科的700余种昆虫和6科的10多种蜱螨类害虫[13-15]。目前,白僵菌已成功应用于大面积防治农林业害虫,例如亚洲玉米螟Ostrinia furnacalis[16]、思茅松毛虫Dendrolimus kikuchii[17]等,不同学者筛选出了对多种害虫具有较高致病力的优良菌株,显示出该菌具有极好的生物防治潜力和应用价值[18]。尽管近些年利用微生物防治害虫已经成为一种重要的生物防治手段,但利用生防真菌防治粘虫的研究报道相对较少,特别是缺乏高毒力的菌株资源。如利用绿僵菌制剂对草坪禾草上的粘虫进行田间防治,具有一定的防治效果,但杀虫速度较慢[19]。也有学者从8株球孢白僵菌菌株中筛选出了一株对粘虫具有高毒力的菌株Bb314,其对粘虫3龄幼虫致死率最高才达69%[20]。因此,迫切需要寻找并筛选出防治粘虫的高效菌株。本研究报道了从土壤中分离得到的3株新的球孢白僵菌及其对3龄粘虫的室内毒力,旨在为粘虫的生物防治提供新的杀虫微生物资源。
1 材料与方法
1.1 材料
供试菌株:三株供试菌株M-G3,M-G4,Z-G2-5是从土壤中分离得到的。土壤具体采集点位置信息见表1,试验前,将菌株接种于1/4 SDAY平板培养基上,在(25±1)℃的恒温培养箱中培养14~15 d,获得分生孢子用于毒力测定试验[21]。
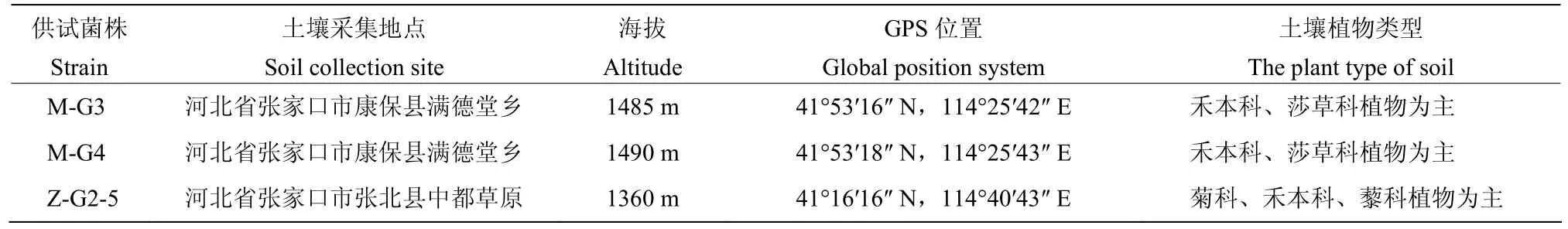
表1 供试菌株的土壤来源Table 1 The soil origin of tested strains
供试虫源:粘虫3龄幼虫,由西北农林科技大学植物保护学院害虫防治实验室提供。挑选刚蜕完皮、大小均匀的3龄幼虫用于生测。
培养基:半选择培养基(Semi-selective agar medium):10 g/L 蛋白胨,40 g/L 葡萄糖,10 g/L 酵母提取物,20 g/L 琼脂,0.6 g/L CTAB,0.3 g/L四环素,0.3 g/L卡那霉素;萨氏培养基(Sabouraud dextrose agar with yeast extract,SDAY):10 g/L 蛋白胨,40 g/L 葡萄糖,10 g/L 酵母提取物,20 g/L 琼脂,0.3 g/L四环素,0.3 g/L卡那霉素。
1.2 菌株的分离
土壤中真菌分离用的是黄粉虫虫饵法[22],将采集的新鲜土样,倒在干净的报纸上,摊成薄层,放于室内避免阳光直射的阴凉通风处自行风干,24 h后收回。每个土样大约取180 g装到250 mL灭菌玻璃组培瓶中,适当喷水。每个组培瓶中放10只6龄或7龄(1.2~1.8 cm)的健康黄粉虫幼虫使之与土壤充分接触,置于(25±2)℃,RH 70%±5%,光周期12L:12D的人工物候培养箱中。每天适当喷水保湿并上下倒置至少3次,试验期间不饲喂任何食物。每天观察黄粉虫情况,及时将土壤中被感染的僵虫取出置于无菌24孔塑料培养板内保湿培养。待僵虫体表形成分生孢子后,挑取虫体表面分生孢子和消毒后的虫体组织接种于半选择培养基,置于培养箱中培养,待真菌长出,将单个菌落上的分生孢子转入新的培养基平板,直至无杂菌,即可得到纯菌种。
1.3 菌株的形态学观察
在超净工作台中,用接种针将分离纯化得到的菌株点植到灭菌的1/4 SDAY培养基上,置于培养箱中培养,约14 d后取出观察菌落形态特征。此外配制分生孢子悬液,吸取10 μL至盖玻片上,待水分蒸发殆尽,在电子显微镜下观察分生孢子的形态大小。
1.4 菌株的分子生物学鉴定
将分离获得的昆虫病原真菌纯培养物在SDAY培养基上均匀涂布,置于培养箱(25±2)℃,RH 70%±5%,光周期12L:12D中培养14 d后,待菌丝长出。参照Abolfazl[23]的方法提取真菌DNA,以菌株基因组DNA为模板,采用不同的引物分别扩增菌株的ITS、β-tubulin和Bloc基因片段,其中引物区域和序列情况见表2[24-26]。PCR扩增产物经1%琼脂糖凝胶电泳检测后送生物公司进行测序。测序结果通过blast进行比对,得到与目的菌株具有同源性的多个菌株的相应序列,从中下载同源性较高的序列,使用MEGA 7.0软件,通过邻接法(Neighbor-Joining method,NJ),运行1000次bootstrap 验证,因3个菌株PCR扩增时所用引物和扩增基因不同,3个菌株分别进行系统发育树的构建和分析[27]。

表2 PCR扩增常用引物Table 2 The primers used to amplify different regions of rDNA inB. bassiana
1.5 孢子悬浮液配制
参照何学友[28]和吴志鹏[29]的操作方法,稍作改进,在1/4 SDY培养基上均匀涂布孢子菌液,置于(25±2)℃,RH 70%±5%,光周期12L:12D的培养箱中培养约14 d后,从菌株的菌落表面获得分生孢子,用0.03%吐温-80溶液配制孢子悬浮液,同时稀释5个浓度梯度,用于接种试验。以0.03%吐温-80的无菌水为空白对照组。
1.6 毒力测定
挑选虫态一致的健康的3龄粘虫幼虫单只放置于24孔昆虫饲养盒中,每饲养盒放置24头作为1个重复,每个浓度处理3个重复,即每个浓度处理72头幼虫。参照Vandenberg[30]喷雾法,将不同浓度的孢子悬浮液装入不同的喷瓶中,依次粘虫处理,确保每头粘虫身上沾上孢子悬浮液,等药液蒸发殆尽或虫体沾粉稳固后,将试虫一一放入养虫盒并置于室内自然室温下,对照组采用 0.03%吐温-80的无菌水溶液。养虫盒内使用无菌水润湿的滤纸保湿。每2 d更换1次新鲜的野小麦叶子,每天记录处理幼虫的存活与死亡情况,统计死亡率。
1.7 数据统计与分析
参照邓嘉茹等[31]方法,根据统计的死亡数,用SPSS软件计算各处理的死亡率、校正死亡率。死亡率=(处理总数-存活数)/ 处理总数×100%;累计校正死亡率=(处理组累计死亡率-对照组累计死亡率)/(1-对照组累计死亡率)×100% ;以孢子悬浮液浓度(孢子/mL)的对数值为X,死亡率的机率值Y,按机率值分析法计算毒力回归方程式及致死浓度LC50、LC90。根据各浓度下侵染天数和处理1 d开始的累计死亡率的机率值,计算回归方程和致死中时间LT50。使用Graphpad Prism 8.0软件制图。
2 结果与分析
2.1 菌株形态学特征及分子生物学鉴定结果
菌株M-G3、M-G4和Z-G2-5在1/4 SDAY培养基上培养14 d后形态如图1所示,菌落直径均在25~30 mm。其中M-G3和Z-G2-5菌落正面均为白色,绒毛状,菌落背面淡黄色,M-G4菌落正面为淡黄色,呈粉状,菌落背面为橙黄色。对分离纯化培养的菌株孢子形态在扫描电镜下进行观察,由图1(G、H、I)可以看到3株菌株的分生孢子透明、光滑,球形或近球形,直径在1.5~2.5 μm。
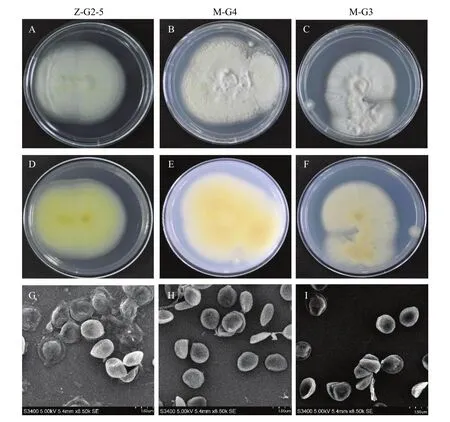
图1 三株菌株的形态特征Fig. 1 The morphological characteristics of three strains
使用PCR扩增菌株Z-G2-5的rDNA-Bloc序列片段,测序结果显示扩增片段为1450 bp;使用PCR扩增菌株M-G4的rDNA-β-tubulin序列片段,测序结果显示扩增片段为641 bp;使用PCR扩增菌株M-G3的rDNA-ITS序列片段,测序结果显示扩增片段为542 bp。使用以上序列在GenBank数据库中进行BLAST比对,发现3株菌株的序列与已报道的多个球孢白僵菌菌株对应序列的相似性均达到99%及以上。将得到的序列片段分别提交到GenBank中,获得登录号分别为MW193766、MW200160和MW192804。
选取相关序列,使用MEGA 7.0将其在NCBI数据库中比对得到的序列下载构建系统发育树,因3株菌株选用了不同的PCR引物进行扩增,扩增片段不同,故三株菌分别进行系统发育树的构建(图2~4)。由图2可知菌株Z-G2-5与B. bassianaRCEF1491(JQ867109.1)处于进化树最小分支,亲缘关系最近,同源性高达100%;由图3可知菌株M-G4与B. bassianaZJ(EF025912.1)处于进化树最小分支,亲缘关系最近,同源性最高;由图4可知菌株M-G3与B. bassianaBJZF-07(MG345084.1)等多个球孢白僵菌菌株处于同一分支,亲缘关系最近,同源性最高。再结合形态学特征确定以上3株菌均为球孢白僵菌,编号依次为Z-G2-5、M-G4、M-G3。
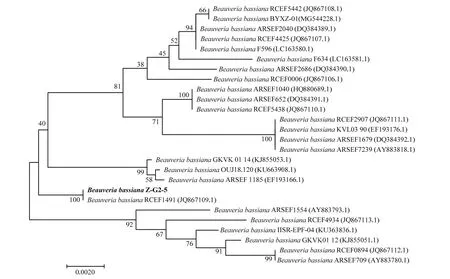
图2 基于Bloc基因序列构建目的菌株与其他球孢白僵菌的系统发育树(NJ法)Fig. 2 Construction of phylogenetic tree of the isolated strain and other relatedB. bassianastrains based on Bloc region sequence(Neighbour-Joining method)
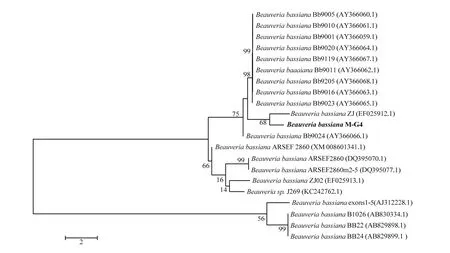
图3 基于β-tubulin序列构建目的菌株与其他球孢白僵菌的系统发育树(NJ法)Fig. 3 Construction of phylogenetic tree of the isolated strain and other relatedB. bassianastrains based onβ-tubulin region sequence(Neighbour-Joining method)

图4 基于ITS序列构建目的菌株与其他球孢白僵菌的系统发育树(NJ法)Fig. 4 Construction of phylogenetic tree of the isolated strain and other relatedB. bassianastrains based on ITS region sequence(Neighbour-Joining method)
2.2 三株球孢白僵菌侵染的粘虫幼虫症状
在感染初期,幼虫取食行为、虫体外部形态与健康幼虫无差别。接种2 d后,幼虫取食明显减少或停止取食,部分幼虫死亡。在侵染5~8 d后,被感染死亡的粘虫幼虫呈僵虫状,并长满白色菌丝。试验结果表明:供试的3株球孢白僵菌菌株皆能侵染粘虫幼虫,并随着菌液浓度的升高,杀虫效果显著提高,致死时间缩短。
2.3 不同球孢白僵菌菌株对粘虫幼虫的累计校正死亡率
不同孢子浓度下3株球孢白僵菌对3龄粘虫幼虫的致死率变化如图5所示。由图5A可知,在孢子浓度为 5×109个孢子/mL时,三株菌株在感染第 5~6 d,粘虫幼虫的累计校正死亡率达到最大值,均接近100%,之后死亡率不再变化。由图5B可知,在孢子浓度为5×108个孢子/mL时,菌株Z-G2-5对粘虫幼虫的致死率明显高于其他两株菌,在感染第6 d时对粘虫的致死率达到最大,累计校正死亡率为96.77%,而菌株M-G3、M-G4累计校正死亡率分别为66.67%、71.11%。在孢子浓度为5×107个孢子/mL时,明显能看出菌株Z-G2-5对粘虫的毒力作用明显高于其他两株菌,在第7 d时,对粘虫幼虫的致死率为78.57%(图5C)。在图5D、E中,3菌株对粘虫幼虫的致死率上升速率相比其他浓度较为缓慢,仍然是菌株Z-G2-5致病力更强。由此可以得出,菌株Z-G2-5相比其他两菌株对粘虫有更强的致病性。菌株Z-G2-5在不同浓度下感染粘虫幼虫的校正死亡率见图6。
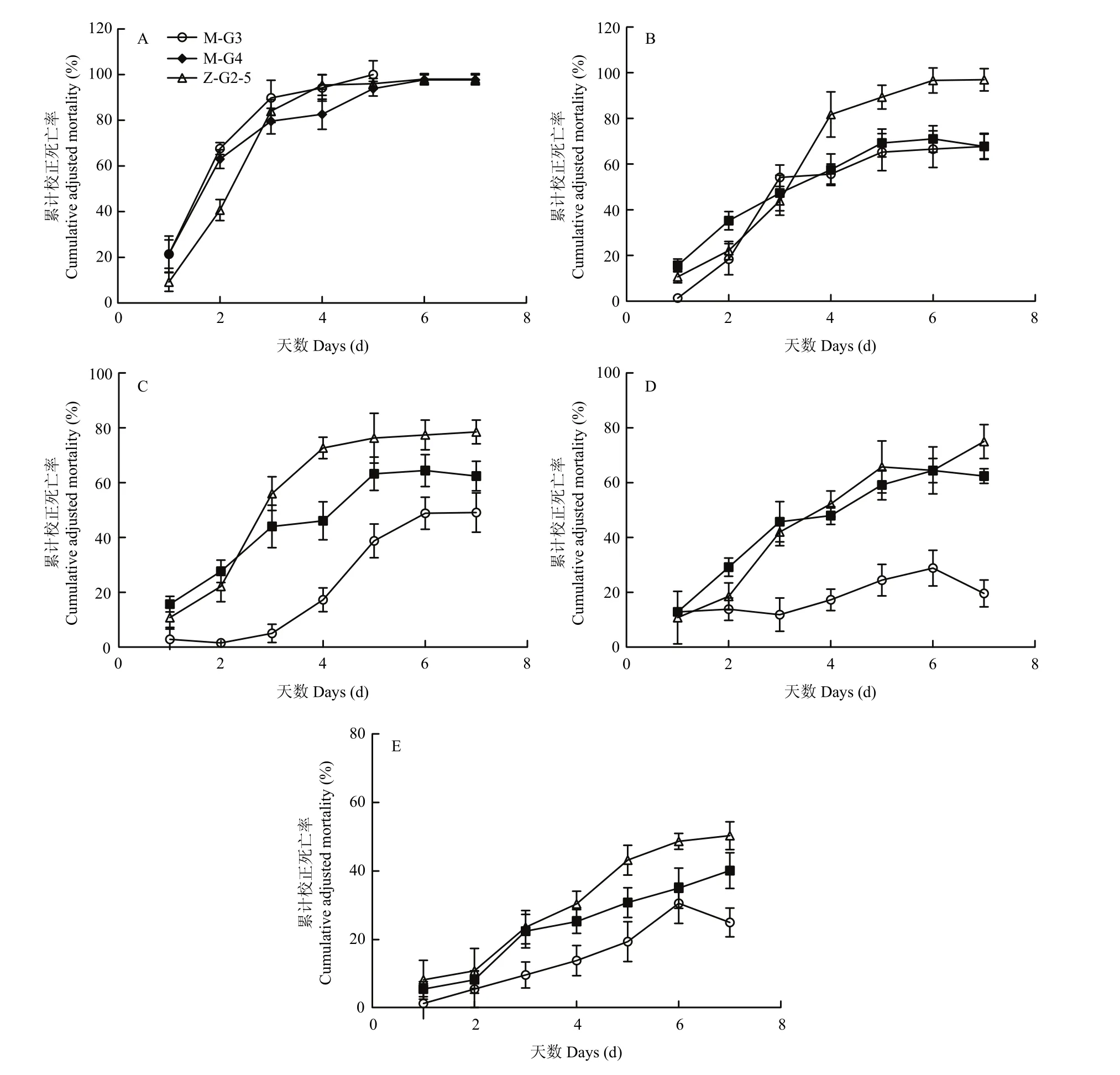
图5 不同浓度下3株球孢白僵菌感染粘虫幼虫的校正死亡率Fig. 5 The corrected mortality of larvaeM. separatainfected by three strains ofB. bassianain different concentrations
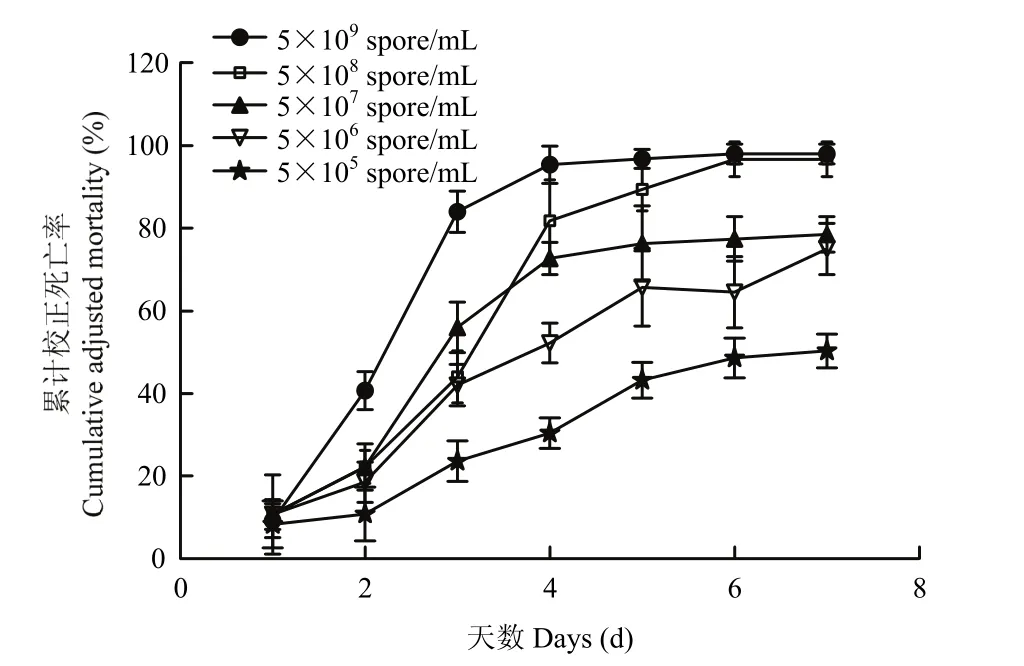
图6 菌株Z-G2-5在不同浓度下感染粘虫幼虫的校正死亡率Fig. 6 The corrected mortality of larvaeM. separatainfected by Z-G2-5 strains ofB. bassianain different concentrations
2.4 不同球孢白僵菌菌株对粘虫幼虫的剂量效应和时间效应
由表3、4得知,随着接种后时间的延长,3株球孢白僵菌对粘虫幼虫的LC50和LC90递减,在接种后3 d,菌株M-G3、M-G4、Z-G2-5对粘虫的LC50分别为8.46×108、1.33×108、5.65×107个孢子/mL;在接种6 d后,LC50分别为1.18×108、1.13×107、4.95×106个孢子/mL。结果表明,菌株Z-G2-5对3龄幼虫致死浓度最低,其次是菌株M-G4、M-G3。
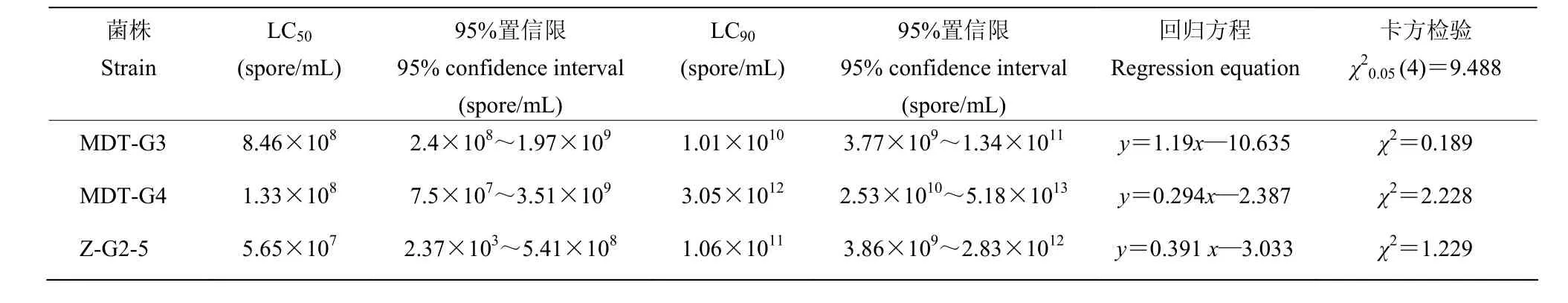
表3 球孢白僵菌对粘虫幼虫的剂量效应(3 d)Table 3 Toxicity ofB. bassianato larvae ofM. separata(3 d)
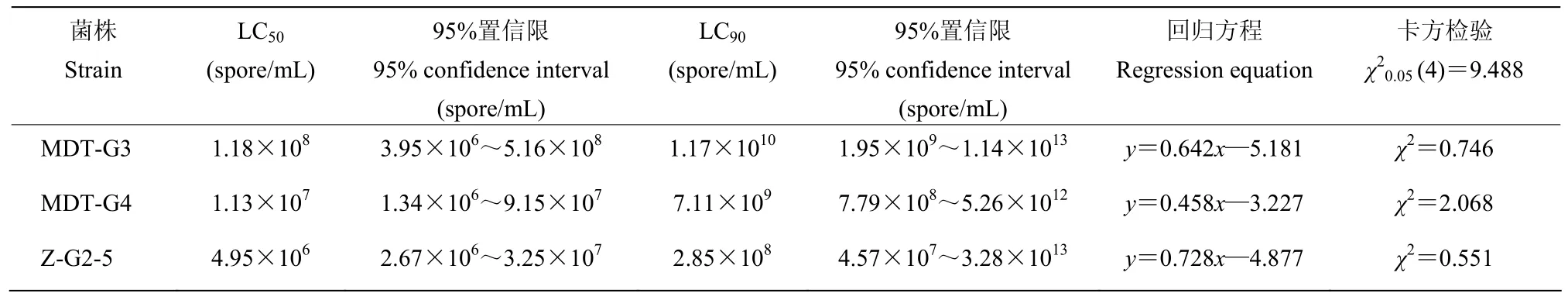
表4 球孢白僵菌对粘虫幼虫的剂量效应(6 d)Table 4 Toxicity ofB. bassianato larvae ofM. separata(6 d)
由表5得知,随着孢子浓度的增加,对粘虫幼虫的LT50递减,在5×105~5×109个孢子/mL浓度,菌株Z-G2-5对3龄幼虫的LT50由6.83 d降至2.23 d。菌株M-G4在5×106~5×109个孢子/mL浓度,LT50由4.56 d降至1.90 d,在5×105个孢子/mL浓度时,幼虫的死亡率在40%左右,低于50%。菌株M-G3在5×107~5×109个孢子/mL浓度,LT50由7.82 d降至1.77 d,在孢子浓度低于5×107个孢子/mL时,幼虫的死亡率不到30%,亦低于50%,因此无法计算LT50。综上所述,3株球孢白僵菌中以Z-G2-5对粘虫幼虫的毒力最强,M-G4和M-G3次之。

表5 球孢白僵菌对粘虫幼虫的时间效应Table 5 Lethal time ofB. bassianato larvae ofM. separata
3 讨论
我国土壤资源丰富,其中含有的真菌种类也多种多样,可以从中分离多种昆虫病原真菌,为害虫防治提供生防资源。本研究从河北采集的土样中分离出了3株昆虫病原真菌,根据该菌株培养形态特征及序列比对分析,3株菌均鉴定为球孢白僵菌,且对3龄粘虫幼虫均有防治效果。由统计数据可得,菌株Z-G2-5比菌株M-G3、M-G4对粘虫的致病力更强,致死速度更快。在5×106个孢子/mL的悬浮液浓度下,对粘虫的最大死亡率达到75%,LC50为4.95×106个孢子/mL,而张琛等[20]研究筛选出一株对粘虫3龄幼虫高毒力的球孢白僵菌菌株Bb314,在1×107个孢子/mL浓度下致死率最高为 69%;庄宝龙等[32]从感病致死的暗黑鳃金龟Holotrichia parallelaMotschulsky幼虫虫体中获得一株球孢白僵菌,并测定了其对粘虫 2龄和 5龄幼虫的致病力,结果在 2.5×109个孢子/mL浓度下,对 2龄、5龄幼虫的最高死亡率分别为42.35%和54.76%,由此可见本研究中的菌株Z-G2-5对粘虫的致死率更高。Mandira[33]研究发现棒束孢属的真菌对粘虫的毒力远高于白僵菌和绿僵菌,其中毒力最强的两株棒束孢属分离株,其 LC50分别为1.24×106和 1.71×106个孢子/mL,与菌株 Z-G2-5毒力相当。综上表明本研究中的菌株Z-G2-5对粘虫具有较强的致病力,有进一步研究的价值。
球孢白僵菌虽然作为目前应用最广泛的杀虫真菌,但在生产实际应用中仍存在一些问题,例如菌株防治效果不稳定,杀虫活性缓慢等,究其主要原因在于真菌孢子萌发需要特定的条件,如温度和湿度,其在农业害虫生物防治中的应用也主要是受到高温、低湿度等环境因素的制约。McClatchie等[34]研究表明,在适宜的温度范围内,白僵菌菌株的产孢量、孢子萌发率、生长速率等各项生长指标会随着温度的升高而增大,但温度过低或温度过高,球孢白僵菌的分生孢子萌发及生长会受到明显抑制。尽管已经证明有些菌株能够在更高的温度下生长,但活性会降低[35,36],Alali等[37]为了克服这些环境因素对球孢白僵菌的限制,并且考虑到全球在逐渐变暖的情况,在叙利亚温暖地区采集土壤样本和感染昆虫分离出耐热的球孢白僵菌分离株,为地中海和亚热带等高温地区农业害虫防治提供了有效的防治资源。Hegedus和 Khachatourians[38]研究表明在相对湿度为 95%~100%时,球孢白僵菌的各项生长指标最好,萌发率、萌发速度均与相对湿度呈正相关。因此在多雨季节、环境湿度大、温度适宜的时期,使用球孢白僵菌有很好的杀虫效果。
有研究证明球孢白僵菌菌株具有异核现象(指不同基因型的细胞核存在于同一细胞内或菌丝体内),且球孢白僵菌异核体在继代培养中极不稳定,在人工培养基上继代培养过程中易存在变异和退化的可能,具有遗传不稳定性[39],因此从菌株的分离到制成菌剂保持其毒力并在自然环境条件下进行大规模防治,仍然会面临诸多困难。本试验中球孢白僵菌菌株 Z-G2-5对粘虫幼虫虽然具有较强的致病力,但仅限于室内的毒力测定,其田间防治效果仍不确定,且本研究仅测定了菌株对3龄粘虫幼虫的毒力大小,对于其他虫态的致死效果还未知,后续我们将继续探讨菌株对其他龄期幼虫的毒力大小、球孢白僵菌液固双相发酵条件优化[40]、继代培养以及其田间防治效果等一系列问题,以尽快将新的菌株转化为微生物杀虫剂,应用于生产实践。
