贝莱斯芽胞杆菌次生抗生物质的研究进展
2022-04-22杜春梅
杨 冰,杜春梅*
(1. 黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150500;2. 黑龙江大学生命科学学院/黑龙江省普通高校微生物重点实验室,哈尔滨 150080)
贝莱斯芽胞杆菌Bacillus velezensis广泛分布于自然界,具有重要的研究价值,但自发现以来其“身份”一直饱受争议。2005年,Ruiz-García等[1]从贝莱斯河的环境样本中首次分离出两株新的芽胞杆菌(CR-502T和CR-14b)并命名为贝莱斯芽胞杆菌。2008年,根据gyrB基因相似性和DNA杂交值,将解淀粉芽胞杆菌B. amyloliquefaciens和贝莱斯芽胞杆菌认定为同物异名,贝莱斯芽胞杆菌因此失去命名地位[2]。2011年,解淀粉芽胞杆菌被划分为两个亚种,即解淀粉芽胞杆菌解淀粉亚种B. amyloliquefacienssubsp.amyloliquefaciens和解淀粉芽胞杆菌植物亚种B. amyloliquefacienssubsp.plantarum。2015年,基于全基因组分析认定甲基营养型芽胞杆菌B. methylotrophicus和解淀粉芽胞杆菌植物亚种的基因组相似度高达95%,差异微小,因此确定二者为同物异名,解淀粉芽胞杆菌植物亚种失去命名地位[3,4]。2016年,Dunlap等[5]通过全基因组比较法认定贝莱斯芽胞杆菌和解淀粉芽胞杆菌不是同一物种,把解淀粉芽胞杆菌植物亚种、甲基营养型芽胞杆菌重新归类为贝莱斯芽胞杆菌,贝莱斯芽胞杆菌重新获得命名地位。据此,B.amyloliquefacienssubsp.plantarumFZB42、B. amyloliquefaciensFR203A、B. amyloliquefaciensSQR9、B.amyloliquefaciensNJN-6、B. amyloliquefaciensSQRT3、B. methylotrophicusKACC 13105T、B. subtilisGB03等菌株在分类学上均为贝莱斯芽胞杆菌[6]。清楚地认知贝莱斯芽胞杆菌的分类地位为深入挖掘贝莱斯芽胞杆菌在农业和医学上的应用潜力奠定了基础。
目前,贝莱斯芽胞杆菌及其代谢产物主要被用作生物防控剂、植物生长促进剂、医疗杀菌剂和抗癌药剂。已发现许多贝莱斯芽胞杆菌菌株能够抑制病原体的生长和繁殖,对番茄青枯病[7]、水稻条纹病[8]、炭疽病[9]、火疫病[10]、菊花软腐病[11]等多种植物病害,鱼类疖病[12]等动物病害以及人类宫颈癌[13]和乳腺癌[14]等临床疾病呈现出巨大的应用潜力。然而,不同来源的贝莱斯芽胞杆菌菌株在不同的培养条件下产生的抗菌物质有很大的差异,对已发现的贝莱斯芽胞杆菌次生抗菌物质的化学结构、合成调控机制等进行总结,有助于深入研究其代谢调控通路并通过组合生物学等手段挖掘新的代谢产物。本文对贝莱斯芽胞杆菌的次生抗菌物质的结构、生物合成基因簇、合成调控机制、及其在农业和医学上的应用进行了总结和回顾,以期为今后利用贝莱斯芽胞杆菌及其代谢产物研发生防制剂或临床药物提供科学依据。
1 部分已知次生抗生物质的结构
已知的贝莱斯芽胞杆菌产生的抗真菌活性物质主要是环脂肽类化合物杆菌霉素 D(Bacillomycin-D)和丰原素(Fengycin),而其抗细菌活性物质类型较多,如环脂肽类化合物表面活性素(Surfactin),多烯类化合物杆菌烯(Bacillaene)、大环内酯类化合物大环内酰亚胺(Macrolactin)和艰难菌素(Difficidin),以及多肽类细菌素儿茶酚型杆菌巴汀(Bacillibactin)、二肽类环状结构化合物杆菌溶素(Bacilysin)、环状肽结构广谱细菌素淀粉环霉素(Amylocyclicin)和噁唑/噻唑型窄谱抗线虫细菌素车前唑霉素(Plantazolicin)[15]。一些已知次生抗生物质的结构见图1。
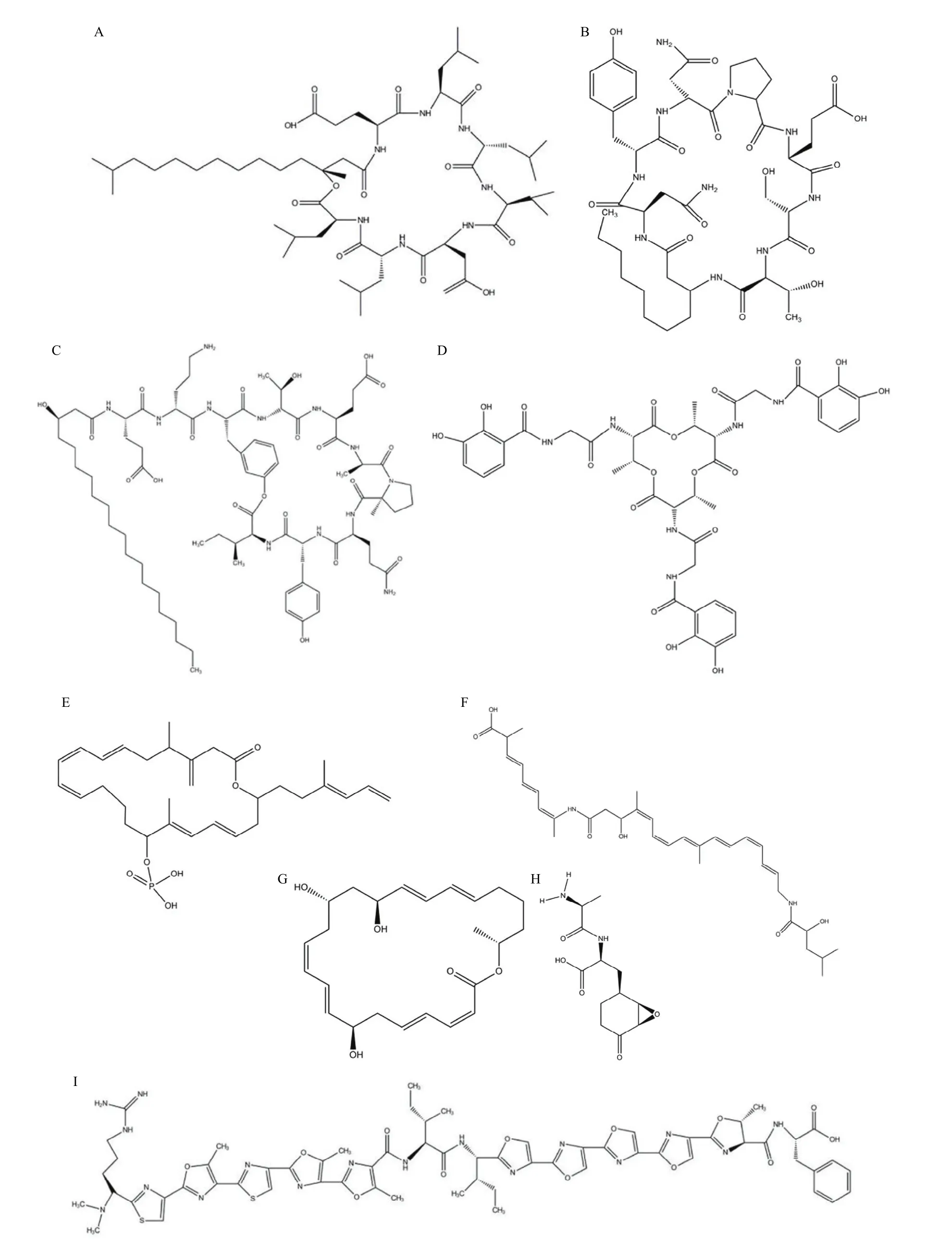
图1 部分贝莱斯芽胞杆菌次生抗生物质的结构图[6,18]Fig. 1 Structure diagram of part of secondary antibiotic substance procuced byBacillus velezensis[6,18]
2 次生抗生物质的生物合成基因簇
在贝莱斯芽胞杆菌的众多菌株中,生物合成基因簇研究最清楚的是B. velezensisFZB42,其基因组中存在9个巨大的抗生物质合成基因簇,分别是srf、bmy、fen、dhb、bac、mln、bae、dfn和nrs,约占整个基因组的10%,这些生物合成基因簇分别编码多种抗生物质的生物合成酶,包括表面活性素、杆菌霉素-D、丰原素、杆菌巴汀、杆菌溶素、大环内酰亚胺、杆菌烯、艰难菌素和一种未知功能的推定肽[16]。在九个基因簇中,有5个基因簇(srfABCD、bmyCBAD、fenABCDE、dhbABCDEF和nrsABCDEF)负责编码相应的非核糖体肽合成酶(Nonribosomal peptide synthetases,NRPSs),这些酶组成大型复合酶,负责三个主要的脂肽亚家族—Surfactins、Bacillomycin-D和Fengycins的合成[17];有3个基因簇编码聚酮化合物合酶(Polyketide synthases,PKSs),分别是指导Macrolactin合成的mlnABCDEFGHI、指导Bacillaene合成的baeBCDE,acpK,baeGHIJLMNRS和指导Difficidin合成的dfnAYXBCDEFGHIJKLM[18]。这3个基因簇覆盖近200 kb,是贝莱斯芽胞杆菌FZB42基因组中最大的基因簇[19]。PKSs和NRPSs既可以单独合成某些抗生物质,也可以协同作用,Bacillaene就是PKSs和 NRPSs协同作用的结果。PKSs和NRPSs分别负责结合丙二酰衍生物和氨基酸,且均以多酶复合物的形式发挥作用,从而通过不同的构件来合成各种具有治疗潜力的次生物质[20]。在贝莱斯芽胞杆菌中,3种脂肽和3种PKS型聚酮化合物都是通过4′-磷酸泛酰转移酶(Sfp)途径生物合成的[21],而Bacilysin的产生与该途径无关,而是由bac基因簇指导合成。另外,贝莱斯芽胞杆菌还通过核糖体途径产生细菌素,目前已被鉴定的两种细菌素为淀粉环霉素和车前唑霉素,二者对近缘的革兰氏阳性菌显示出高抗菌活性[22,23]。2011年,Rueckert 等[24]将 FZB42与非植物相关的解淀粉芽胞杆菌 DSM7T的基因组序列进行了比较,发现二者之间存在显著差异。值得注意的是,非核糖体合成抗菌聚酮化合物大环内酰亚胺和艰难菌素的能力是植物亚种即贝莱斯芽胞杆菌的独特特征,而合成脂肽的能力是与解淀粉芽胞杆菌解淀粉亚种共有的,而且这些特点与枯草芽胞杆菌物种复合体的其他成员不一致[25]。
3 抗生物质合成的调控
3.1 脂肽类抗生物质合成的调控
3.1.1 表面活性素 表面活性素是具有两亲性结构的生物表面活性分子,是由β-羟基脂肪酸链(C-13~C-16)和亲水性七肽环连接而成,肽环的氨基酸序列为Glu-Leu-Leu-Val-Asp-Leu-Leu[26]。贝莱斯芽胞杆菌能产生少量表面活性素(<其生物量的 10%),不仅具有抑制其他细菌生长的作用,而且可以在种间或种内相互作用中作为信号分子[27]。表面活性素是由srfA操纵子编码的非核糖体肽合成酶的复杂相互作用合成的。srfA操纵子由srfAA、srfAB、srfAC和srfAD四个开放阅读框(ORFs)组成。其中,srfAA、srfAB、SrfAC负责编码模块化酶,模块化酶负责将7个氨基酸整合到肽环中。srfAD是一种修复酶,负责编码硫酯酶/酰基转移酶结构域,调节表面活性素生物合成的起始[28]。
表面活性素的生物合成取决于细胞密度,群体感应(Quorum sensing,QS)阻止细菌细胞的持续生产进而限制表面活性素的总产量[29]。从图2可以看出,芽胞杆菌细胞在液体培养基中能持续分泌细胞外信号因子ComX信息素(10-氨基酸修饰的肽),当其浓度达到一定阈值时,组氨酸激酶受体ComP检测到ComX,随后自动磷酸化其同源受体调控因子ComA。ComA是ComQXPA信号级联系统(该系统在几种芽胞杆菌属中负责QS)的一部分。随后,磷酸化的ComA(ComA~P)通过与启动子结合触发srfA操纵子的转录,并启动表面活性素的生物合成[18]。表面活性素间接与传感器激酶 KinC相互作用,促进主反应调控因子Spo0A(芽胞杆菌产孢开始的主控元件,也是芽胞杆菌生物膜形成的正调控因子)的磷酸化。磷酸化的Spo0A诱导SinI(一种小肽,与SinR结合会使SinR蛋白活性受到抑制)的表达,SinI与阻遏物SinR(生物膜形成的负调控因子)会发生拮抗从而导致参与生物膜形成的相关基因的转录。除了依赖ComX调节之外,芽胞形成刺激因子(CSF)和天冬氨酸磷酸酶蛋白(Rap)也调节表面活性素的生物合成[30]。CSF是一种由芽胞杆菌分泌的物种特异性胞外肽,由寡肽渗透酶(Opp,也称为Spo0K)转运进入胞内,并与Rap蛋白结合,使ComA~P去磷酸化,失去激活srfA操纵子转录的功能。而抑制ComA~P的去磷酸化能保证srfA基因的转录和表面活性素的生物合成[31],如敲除ComA抑制了表面活性素的产生,过表达ComA会诱导表明活性素的生成[32]。

图2 贝莱斯芽胞杆菌和枯草芽胞杆菌的群体感应调控表面活性素的产生Fig. 2 Quorum sensing inB. velezensisandB. subtilisregulates the production of sufactin
3.1.2 丰原素 丰原素的结构是由β-羟基脂肪酸链(C12-C19)和环状十肽通过内酯键组成的,肽环的氨基酸序列为(Glu-Ora-Tyr-Thr-Glu-Ala(Val)-Pro-Gln-Tyr-Ile)[33]。由于在第六个位置存在Ala/Val二形态,因而有两种不同的丰原素Fengycin A和Fengycin B,且二者在结构上也有所不同。丰原素的操纵子由五个阅读框FenA-E组成[34]。FenC是起始模块,负责激活并组装第一个和第二个氨基酸。丰原素的启动子位于FenC转录起始位点上游86 bp处,其UP元件是包括A和T的一个17 bp的序列,在启动子-35区和RNA聚合酶结合位点的上游,对启动子活性至关重要,UP元件突变能使转录频率降低85%,大大抑制了丰原素的合成[35,36]。FenB负责组装最后一个氨基酸,位于肽合酶基因簇的C端,敲除FenB则合成的丰原素不能被释放[37]。内源性因素,如双组分调节因子(ComA/ComP)、Sigma A因子和信号蛋白(DegU,DegQ),也调节丰原素合成酶基因的表达,sigA上调可增加丰原素的产量[38]。在低磷条件下,PHR/PhoP通过控制丰原素合成酶基因的表达来调节丰原素的产生[39]。
3.1.3 杆菌霉素-D 杆菌霉素结构是由β-氨基脂肪酸链(C15-C18)和环状七肽两部分组成的,环七肽的氨基酸序列为Asn-Tyr-Asn-Pro-Glu-Ser-Thr。编码杆菌霉素-D肽部分生物合成的是bmyDABC基因簇,在贝莱斯芽胞杆菌FZB42基因组中与丰原素基因簇仅相差25 kb,与枯草芽胞杆菌RB14中iturin-A基因簇的位置完全相同[40]。三个多效性调节因子(DegU、DegQ和ComA)和两个σ因子(σB和σH)正向调节bmy启动子对杆菌霉素-D合成的转录。另一项研究证明编码DegU和ComA蛋白的基因失活会导致bmy操纵子的启动子功能受损,失活突变体的bmy操纵子的转录效率比野生型菌株低3~4倍。Wang等[41]研究表明AbrB通过与杆菌霉素合成酶操纵子PbacA的启动子结合来抑制杆菌霉素的生物合成,而Spo0A通过抑制AbrB的表达间接促进杆菌霉素的生物合成。
3.2 聚酮类抗生物质合成的调控
聚酮化合物属于次级抗生物质的一个大家族,包括许多具有抗菌、免疫抑制、抗肿瘤等相关生物活性的化合物。聚酮化合物是由短链的酰基单元逐步脱羧缩合反应合成的,然后经由PKSs修饰结构域催化进行修饰。在新的一轮链延伸之前,一组可变的修饰酶可以局部引入结构多样性,如β-还原、脱水或烯酰基还原反应等[42]。类似于肽的非核糖体合成,PKS多酶系统使用经翻译后修饰的酰基载体蛋白(ACPs)在延伸过程中引导增长的聚酮中间体[43]。在解淀粉芽胞杆菌FZB42中鉴定出3个反式酰基转移酶类型的巨大模块化PKS系统,其中pks1是模式菌株枯草芽胞杆菌168的pksX操纵子的直系同源物,FZB42的pks1具有枯草芽胞杆菌168的pksX所不具有的功能,而pks2和pks3簇是新的基因簇。根据质谱分析,pks1(bae)和pks3(dif)基因簇分别编码多烯类抗生素杆菌素和艰难菌素的生物合成酶。pks1是模块化组织的巨型合酶,每个模块通常包含一个β-酮酰基合酶(KS)、酰基转移酶(AT)和ACP酰基载体蛋白作为必需和基本的结构域,可以由一组可变的额外结构域来补充。模块的顺序决定了生物合成事件的顺序,并且通常观察到的 PKS结构和生物合成步骤之间的共线性被证明允许对I型PKSs进行组合操作以产生新化合物[44]。
当编码4′-磷酸泛酰转移酶的sfp基因突变时,枯草芽胞杆菌168的pksX系统也无法合成聚酮化合物,因为Sfp不仅磷酸化表面活性素和其他脂肽类的肽基载体蛋白,而且对其他载体蛋白,包括聚酮化合物合酶的酰基载体蛋白也显示出广泛的底物特异性[45]。
4 贝莱斯芽胞杆菌抗生物质的应用研究
4.1 防治植物病害
尽管已经对贝莱斯芽胞杆菌的抗生物质进行了大量的研究,然而在农业应用中,多数使用的还是活体菌剂,尤其是在动植物病害的防治方面。因此,人们推测抗生物质的产生是活体菌剂发挥效力的关键因素之一。
4.1.1 作用于病原体 表面活性素作用于细菌的细胞壁和细胞膜,导致病原菌细胞死亡。Surfactin对青枯菌Ralstonia solanacearum、丁香假单胞菌Pseudomonas syringae、苜蓿萎蔫菌Clavibacter michiganensis等多种病原微生物有抗菌活性。Xiong等[46]从健康番茄植株根际土壤中分离出一株解淀粉芽胞杆菌JK6,对番茄青枯病的温室生防效果达到52.9%以上,且JK6处理的根际土壤中的srfAB、fenD和yndJ的拷贝数明显高于对照,srfAB参与表面活性素的合成,fenD和yndJ参与丰原素的合成,表面活性素主要抗细菌活性,丰原素主要抗真菌活性,因此,推测表面活性素的产生可能在JK6保护植物免受病原体攻击的生物控制机制中起主要作用。Grady等[47]通过体外试验表明,贝莱斯芽胞杆菌9D-6产生的Surfactin B和Surfactin C能抑制苜蓿萎蔫菌的生长,但不能抑制丁香假单胞菌DC3000 的生长,但是其活体菌剂能显著降低DC3000的根定殖。
Fengycins主要是通过与真菌细胞膜相互作用改变细胞渗透性而导致目标微生物的细胞死亡,可被用来防治多种植物病害。Chen等[48]研究表明,贝莱斯芽胞杆菌FJAT-46737的粗脂肽对多种病原菌(包括青枯菌、大肠杆菌和尖孢镰刀菌)具有显著的拮抗活性,并检测出Fengycins是该粗脂肽的主要抗真菌成分,而有机氮源丰富促进Fengycin和Surfactin的产生。Adeniji等[49]研究表明贝莱斯芽胞杆菌NWUMFkBS10.5能产生Fengycin、Iturin和Surfactin,对两种玉米真菌病原体禾谷镰孢菌Fusarium graminearum和黄色镰孢菌F. culmorum具有生物防治潜力。
Bacillomycin-D属于伊枯草素家族脂肽[18]。Gu等[21]研究表明贝莱斯芽胞杆菌FZB42产生的Bacillomycin-D对禾谷镰孢菌F. graminearum具有显著的抗菌活性,能引起菌丝和分生孢子的质膜和细胞壁发生形态学变化,诱导活性氧的积累造成细胞死亡。Jin等[9]研究表明贝莱斯芽胞杆菌HN-2产生的杆菌霉素D对炭疽病菌Colletotrichum gloeosporioides的作用效果比咪鲜胺(Prochloraz)和代森锰锌(Mancozeb)更强,可损伤炭疽病菌菌丝和孢子的细胞壁和细胞膜,使细胞质和细胞器渗出,细胞呈现空洞。Xu等[41]研究表明,Bacillomycin-D可以作为信号分子通过促进铁的获得来促进生物膜的形成,并通过与其转录因子Btr结合来促进铁 ABC转运蛋白 FeuABC的转录,从而增加细胞内铁浓度,并激活生物膜基质成分 KinBSpo0A-SinI-SinR的合成。这些结果揭示了一种抗生素依赖的信号机制,并且此试验基于植物促生长菌荧光假单胞菌Pseudomonas fluorescensPF-5与贝莱斯芽胞杆菌SQR9的竞争模型系统,证明了Bacillomycin-D有助于SQR9与PF-5的竞争,此作用机制是将铁的获取与生物膜的形成和生态竞争联系起来。
Difficidin及其氧化形式Oxydifficidin由pks3(dif)基因簇编码的酶负责合成[43]。Seong等[7]的研究表明甲基营养芽胞杆菌DR-08对番茄青枯病病原菌有较强的抗菌活性,其发酵液提取物中含有Difficidin和Oxydifficidin两种抗菌物质,能完全抑制14种植物病原菌的生长,对青枯菌的最低抑菌浓度为12.62 μg/mL。Wu等[8]研究表明,贝莱斯芽胞杆菌FZB42能通过产生Difficidin和Bacilysin而显示出对水稻白叶枯病菌Xanthomonas oryzaepv.oryzae和水稻细菌性条斑病X. oryzaepv.oryzicola的生物控制活性。Difficidin 和Bacilysin可引起质壁分离、细胞裂解,进而细胞内成分流出。二者混合施用,能显著降低水稻植株的病斑长度和疾病严重程度,防效稳定在 58.82%~72.31%之间,并且使病原细胞分裂、蛋白质合成和细胞壁合成相关基因(rpfF、gumD、ftsZ、rrlA和glmS)的表达均呈现下调趋势,且rrlA和glmS的下调水平最显著。Bacilysin是一种二肽抗菌素,其抗菌活性取决于培养基的组成,其活性可以通过使用一些拮抗剂如N-乙酰氨基葡萄糖、几种二肽和氨基酸来逆转,这些物质可能会抑制Bacilysin向微生物细胞的转运。贝莱斯芽胞杆菌FZB42合成的Bacilysin对马铃薯环腐病菌具有拮抗活性。本实验室研究发现,贝莱斯芽胞杆菌HD01产生的脂肽、抗菌蛋白和聚酮类化合物对马铃薯疮痂病菌Streptomyces scabies均具有一定的抑菌效果,其中聚酮类化合物的抑制作用最强,能显著下调 Thaxtomin毒素的产毒基因(txtAB、tomA、nec1以及txtH)的表达。且该化合物对 pH、温度、紫外线、有机溶剂具有良好的稳定性,对马铃薯疮痂病的防治具有良好的应用潜力。今后将对该化合物进一步纯化并进行结构鉴定,并通过工程菌株的构建及单因素和响应面法发酵条件优化等方法提高抗菌代谢产物产量,为深入探讨其抗马铃薯疮痂病的机制和应用研究奠定基础。
贝莱斯芽胞杆菌FZB42和SQR9可以在铁限制条件下通过分泌Bacillibactin与有害微生物竞争铁元素来保护植物免受病原菌的侵害[50]。SQR9合成的Bacillibactin与脂肽(即杆菌霉素D、丰原素和表面活性素)一起作用时,能展现出对尖孢镰孢菌、茄病镰孢菌和寄生镰孢菌的拮抗作用,且脂肽类物质能促进Bacillibactin的产生,二者同时存在时显示出良好的抗菌效果。然而,同时缺乏脂肽和Bacillibactin的突变菌株受到真菌病原体的挑战时,突变菌株不能显示出明显的抗真菌效果,且在只有 Bacillibactin单独存在(缺乏已知的脂肽或聚酮化合物)的情况下,也没有试验证据证明纯化的 Bacillibactin具有抗菌活性,因此这些结果表明,Bacillibactin在抑制微生物病原体中可能是通过剥夺病原微生物所必需的铁离子来抑制其生长的,而不是直接拮抗病原菌[51]。
Macrolactin是细菌肽去甲酰化酶的抑制剂,已鉴定出约17种不同类型的Macrolactin。而在贝莱斯芽胞杆菌中发现了其中的4种,分别是Macrolactin-A、Macrolactin-D、7-O-malonyl-macrolactin-A和7-O-succinyl-macrolactin[52,53]。Chen等[11]研究发现Macrolactin-A是解淀粉芽胞杆菌D2WM抗菊花软腐病原菌的关键物质。Chen等[45]发现由贝莱斯芽胞杆菌 FZB42合成的 Bacillaene对火疫病病原菌欧文氏菌Erwinia amylovora和白蚁菌(Termitomyces)表现出一定的抑菌效果[10]。
4.1.2 作用于植物—诱导系统抗性 作为一种植物根际促生菌(Plant growth promoting rhizobacteria,PGPR),贝莱斯芽胞杆菌FZB42显示的生物防治效果可能依赖于几种生物活性次生物质的潜在抗菌活性。然而,除Surfactin外,在植物中测定的抗真菌脂肽的浓度相对较低。此外,到目前为止,在PGPR杆菌定居的植物根部附近没有检测到抗菌聚酮化合物和其他生物活性化合物,因此,研究人员推测,由Surfactin、微生物挥发性有机化合物以及可能的其他迄今未被发现的次生物质所引发的 ISR(Induced systemic resistance,ISR)是 PGPR抑制植物病原体的主要因素,植物通过这一过程保护自己免受有害微生物的反复攻击[25]。Chowdhury等[54]为了研究Surfactin和聚酮类化合物在调节植物对立枯丝核菌R. solani防御反应中的作用,用贝莱斯芽胞杆菌FZB42野生型和两个突变株CH1(不产Surfactin)和CH5(不产脂肽和聚酮化合物)接种莴苣幼苗,使幼苗细菌化,通过实时定量PCR反应分析表明,野生型FZB42-细菌化植株的植物防御素因子(Plant defensin factor, PDF)的表达上调,但在突变菌株细菌化的植株中未上调,表明脂肽类化合物和聚酮类化合物可增强植物的防御反应,具有诱导植物系统抗性的作用。
4.2 防治动物病害
一种从水产养殖系统中分离的贝莱斯芽胞杆菌V4菌株对沙门氏菌气单胞菌亚种Aeromonas salmonicidasubsp.salmonicida具有控制活性,可显著减少鱼的死亡率,且能促进鱼的生长,具备用作水产养殖益生菌和抗真菌剂的潜力,其产生的活性代谢物主要是伊枯草素、艰难菌素和大环内酰亚胺[55]。Hien等[12]用植物乳杆菌N11和贝莱斯芽胞杆菌H3.1的益生菌混合物作为饲料添加剂处理尼罗罗非鱼时,这些益生菌能够提高尼罗罗非鱼的黏膜免疫和血清免疫功能,增强抗病能力。但是,增强鱼类免疫的益生菌的活性代谢物成分及其与益生菌其他成分协同作用的机制尚不清楚。
4.3 在医学上的应用
Magally等[56]研究发现 7-O-malonyl-macrolactin-A对多种革兰氏阳性菌和多药耐药细菌病原体具有抑菌作用,特别是耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌和洋葱伯克霍尔德氏菌的小菌落变体。Bacillaene对多重耐药细菌分离株也具有抗菌活性,但其化学性质不稳定,一直没能商品化[57]。贝莱斯芽胞杆菌FZB42合成的Bacilysin对金黄色葡萄球菌具有拮抗活性[58]。另一项研究表明Bacilysin对铜绿假单胞菌表现出很强的抗细菌活性,然而,单个基因bacB的破坏或生物测定板中N-乙酰氨基葡萄糖的补充能消除Bacilysin的抑制作用。扫描电镜和透射电镜分析表明,Bacilysin是通过引发细胞壁结构的变化以及细胞内成分的流出来抑制病原微生物的[8],用15 mg/L的Bacilysin处理铜绿假单胞菌2 h,其细胞严重受损,细胞质浓缩,发生质壁分离现象[59]。Yoo等[60]从传统的韩国发酵食品中分离到的贝莱斯芽胞杆菌 K68可能具有预防由变异链球菌引起的龋齿的用途,该菌株通过产生一种糖代谢酶抑制剂脱氧野尻霉素(Deoxynojirimycin, DNJ)来抑制变异链球菌生物膜的形成、粘附和GTF基因的表达。
另外,Moghannem 等[61]和 Mahgoub等[62]分别报道贝莱斯芽胞杆菌 KY498625和贝莱斯芽胞杆菌MHM3能产生胞外多糖EPS,且EPS在非常低的浓度下具有极高的抗癌能力(MCF-7癌细胞),对健康宿主细胞没有明显的细胞毒性作用。Meena等[13]研究表明,从一种新的贝莱斯芽胞杆菌菌株KLP2016中提取的脂肽对人宫颈癌细胞Hep2-C显示出高于90%的细胞毒性。此外,Rehman等[14]从贝莱斯芽胞杆菌RA5401提取的五种化合物对乳腺癌细胞系有抗增殖活性,有两种通过抑制细胞内癌蛋白酶发挥作用,另外3种通过抑制癌细胞的G蛋白偶联受体发挥作用。
5 展望
化学合成农药的长期不合理使用导致了环境中残留化合物的积累,使致病微生物产生了耐药性。医药的持续过度和不当使用也使多重耐药性病原菌株引发疾病的治疗成为医学领域的难题。贝莱斯芽胞杆菌能够产生多种生物活性物质,其实用价值和应用前景引起了广泛的重视。一些菌株已经在生产中得到了一定的应用,其基因组和抗菌物质等相关信息也取得了较大的研究进展。但是,目前还存在一些亟待解决的问题:(1)很难从贝莱斯芽胞杆菌的发酵液中提取或纯化生物活性化合物,尤其是新物质。这一方面是由于菌株生长条件的次优化、提取溶剂的选择不当以及新化合物获取的难度所影响,而那些低浓度产物的可获得性更加低下。另一方面,是由于对贝莱斯芽胞杆菌的有益代谢产物的分析方法还存在局限,尽管目前采用的分析方法,如诱变、比较基因组学、转录组学、代谢组学、蛋白质组学等,对于表征菌株的生理生化特性和代谢通路起到了积极的作用,但对于如何产生和获得新的抗生物质还存在许多未解之谜。因此,迫切需要使用一些更行之有效的研究方法来解决上述问题,或许多组学联用将能进一步挖掘贝莱斯及其同类芽胞杆菌的应用价值,组合生物学的发展则为新物质的发现带来了希望,高产基因工程菌株的构建和下游提取工艺的提高是解决贝莱斯芽胞杆菌生物活性物质产量较低这一瓶颈问题的主要策略。(2)对贝莱斯芽胞杆菌的生物安全性研究较少,作为其广泛商业化和应用化的重要前提,翔实的安全评估数据必不可少。尽管已经获得了贝莱斯芽胞杆菌的全基因组序列,但目前还缺乏其产生的抗生物质对靶标生物的毒性、致病性以及对环境影响的研究。另外,与化学合成抗菌剂相比,许多微生物来源的有益抗菌剂在体外检测时明显不能优于在体内所发挥的作用。因此,对于贝莱斯芽胞杆菌及其抗生物质的抗菌效果和应用潜力的评估应当以体内效果为准。深入开展贝莱斯芽胞杆菌及其抗生物质的体内抗菌机理研究和应用效果研究有助于推进其商品化和产业化进程。
