芽胞杆菌工程菌株B9BD产表面活性素发酵培养基优化
2022-04-22乔俊卿刘永锋陈夕军刘邮洲
乔俊卿,孙 凯,刘永锋,陈夕军,刘邮洲*
(1.江苏省农业科学院植物保护研究所,南京 210014;2. 扬州大学园艺与植物保护学院,扬州 225009)
表面活性素(Surfactin)是芽胞杆菌产生的脂肽类物质中最主要的一类,是由非核糖体多肽合成酶系(NRPS)合成的、分子量约为1000 Da,其化学结构是含有7个α-氨基酸和具有13、14或15个碳原子的β-羟基脂肪酸构成的大环内脂型同系化合物[1],具有生物表面活性剂、抗菌、抗病毒、抗肿瘤、诱导植物抗病性和信号分子的作用,是芽胞杆菌发挥生防作用的重要因子[2-7]。当芽胞杆菌被开发为生物农药施用后,生防菌定殖于生境,通过产生抑菌物质而发挥作用。然而,受遗传、环境和营养等因素影响,芽胞杆菌合成分泌表面活性素的效率非常低,需要长时间的剂量积累才能发挥其抑菌、诱导抗病性等作用。因此,芽胞杆菌产生脂肽类物质的能力是影响微生物农药效价和货架期的重要因素,也是微生物农药的产业化应用限制因素。
为了提高Surfactin产量,国内外研究人员围绕高产Surfactin菌株的筛选、生物合成基因的调控、基因工程改造和高效发酵工艺等方面展开研究。菌株的生长需要多种营养物质,比如碳源、氮源、氨基酸和金属离子等。营养物质的种类和比例,都会影响菌株的生长和发酵产物的产量。通过优化培养基组成,在产生更多Surfactin同时,进一步降低生产成本,是工业发酵过程中普遍采用的方法。朱玲燕等[8]发现通过在培养基中添加4种氨基酸可以提高Surfactin的产量,当添加L-亮氨酸时,其产量增加最显著。黄翔峰等[9]发现当培养基中Fe2+的浓度达到5 mmol/L时,Surfactin的产量提高了9.5倍;Cooper等[10]发现较高浓度的Mn2+可以增加Surfactin的生物合成。
本研究室前期通过对枯草芽胞杆菌Bs916进行随机突变,筛选发现△degU突变菌株B9△degU的Surfactin产量明显提高,Fengycin不再产生,随后继续突变Bacilimycin L合成基因bmyA,构建了单产Surfactin的工程菌株B9BD。本研究将以工程菌株B9BD为出发菌株,单因素筛选影响Surfactin产生的关键培养基成分,并通过 Plackett-Burman试验、中心组合试验(CCD)和响应曲面法(RSM),对培养基组分进行优化,以期获得更高的Surfactin产量,为Surfactin的高效发酵和产业化应用提供理论基础和技术支撑。
1 材料与方法
1.1 供试菌株和培养基
枯草芽胞杆菌Bacillus subtilisBs916及其工程菌株B9BD由江苏省农业科学院植物保护研究所水稻病害及防控实验室保存。菌株Bs916和B9BD的活化和发酵种子液制备均采用LB培养基(胰蛋白胨10.0 g/L,酵母粉5.0 g/L,NaCl 10.0 g/L)。发酵主要使用基础发酵培养基Bas(葡萄糖20 g/L,蛋白胨10 g/L,牛肉浸膏3 g/L,NH4NO30.5 g/L,L-亮氨酸1 g/L,KH2PO41 g/L,NaCl 3 g/L,MgSO40.02 g/L,MnSO40.05 g/L)和Landy培养基[11](葡萄糖20 g/L,L-谷氨酸钠5 g/L,KH2PO41 g/L,KCl 0.5 g/L,MgSO40.5 g/L,MnSO45.0 mg/L,FeSO40.15 mg/L,CuSO40.16 mg/L,pH=7.0)。本研究所用试剂均购买自上海生物工程有限公司。
1.2 摇瓶发酵试验过程
从-70 ℃冰箱取出菌株Bs916和B9BD,在LB平板上活化,37 ℃静置培养,挑取单胞接种于含有20 mL LB液体培养基的50 mL三角瓶中,30 ℃、180 r/min振荡培养10~12 h,即为发酵种子液。调整种子液OD600=1.0,以1%的接种量将种子液接种到含有50 mL发酵培养基的250 mL三角瓶中,30 ℃、180 r/min振荡培养36 h。
1.3 Surfactin的高效液相色谱检测(HPLC)与含量计算
芽胞杆菌Bs916和工程菌株B9BD发酵后,取2 mL发酵液,12000 r/min离心5 min,上清液过0.22 μm滤膜,滤液进行高效液相色谱(HPLC)分析。从Sigma公司购买Surfactin标准样品,配制不同浓度的Surfactin甲醇标准溶液,用HPLC进行检测分析。根据峰面积与浓度的变化关系,制作Surfactin标准曲线,即Y(峰面积)=11.163X(浓度)+671.19,R2=0.9953,用于计算菌株Bs916和B9BD发酵液中Surfactin含量。
HPLC分析采用C18柱(Sephasil Peptide C18 5 µm ST 4.6/250);流动相A为乙腈(含0.1%三氟乙酸),流动相B为水(含0.1%三氟乙酸);采用梯度检测方法:0~25 min,60%乙腈(含0.1%三氟乙酸)和40%水(含0.1%三氟乙酸);25~35 min, 70% 乙腈(含0.1%三氟乙酸)和30%水(含0.1%三氟乙酸);35~60 min, 93% 乙腈(含0.1%三氟乙酸)和7%水(含0.1%三氟乙酸);流速为0.8 mL/min,进样量为10 μL,紫外检测波长为210 nm,柱温为30 ℃。
1.4 发酵培养基营养因子单因素筛选试验
1.4.1 碳源对菌株B9BD合成Surfactin的影响 在基础发酵培养基Bas其他成分不变,培养条件不变的情况下,以等量蔗糖替代葡萄糖,比较其对Surfactin产量的影响,试验重复3次。
1.4.2 氮源对菌株B9BD合成Surfactin的影响 在基础发酵培养基Bas其他成分不变,培养条件不变的情况下,比较不同氮源(有机氮和无机氮)对Surfactin产量的影响,试验重复3次。具体处理如下:(a)用等量硫酸铵(SN)替代硝酸铵(AN);(b)用等量硝酸铵(AN)替代蛋白胨(peptone)和牛肉浸膏(BE);(c)将蛋白胨(peptone)含量变为10.5 g/L,去掉硝酸铵(AN);(d)用等量酵母粉(YE)替代牛肉浸膏(BE);(e)去掉牛肉浸膏(BE),蛋白胨(peptone)含量变为13 g/L;(f)去掉蛋白胨(peptone),牛肉浸膏(BE)含量变为 13 g/L;(g)将蛋白胨(peptone)替换成等量的黄豆粉(SM)或黄豆饼粉(SCM)。
1.4.3 金属离子对菌株B9BD产生Surfactin的影响 在基础发酵培养基Bas其他成分不变,培养条件不变的情况下,向培养基中分别添加CuSO4(终浓度为0.001 g/L)、CaCl2(终浓度为0.001 g/L)和FeSO4(终浓度为0.05 g/L),比较其对Surfactin产量的影响,试验重复3次。
1.5 培养基组分关键因子筛选(Plackett-Burman)试验设计
根据1.4部分发酵培养基单因素筛选试验结果,采用Design-expert软件进行Plackett-Burman摇瓶发酵试验设计,从以下10个因素中筛选影响Surfactin产量的关键因子,试验中每因素取“1”(高水平,范围区间最大值)和“-1”(低水平,范围区间最小值)两水平,即葡萄糖10和20 g/L(A),黄豆粉10和20 g/L(B),牛肉浸膏1和3 g/L(C),NH4NO31和4 g/L(D),L-亮氨酸0.5和2 g/L(E),KH2PO41和3 g/L(F),NaCl 1和3 g/L(G),MgSO40和0.02 g/L(H),MnSO40和0.05 g/L(J),FeSO4 0.02和0.1 g/L(K)。试验重复3次。
1.6 最陡爬坡试验设计
根据Plackett-Burman(PB)试验结果,综合选出3个对Surfactin产量有显著影响的培养基关键因子:葡萄糖;黄豆粉;L-亮氨酸。采用最陡爬坡试验对3个关键因素的用量范围进行摸索,确定合适的步长,为后续的中心组合试验设计提供依据。
1.7 中心组合试验(central composite design)设计
根据PB试验和最陡爬坡试验结果,利用中心组合试验对葡萄糖、黄豆粉和L-亮氨酸进行3因素5水平试验,依据其设计原理,分别按照轴向点α值为1.68179,角点值为1,设计5水平试验(表1),共设20组,每组3个重复。
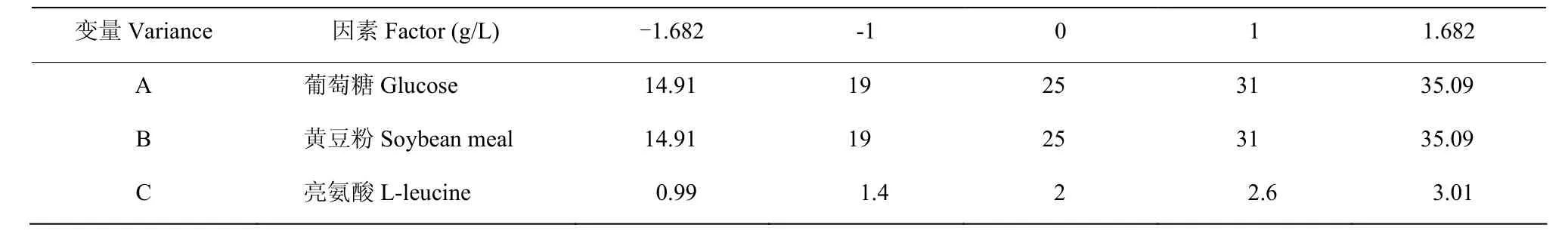
表1 关键培养基成分中心组合实验设计各因素水平Table 1 Central composite experimental design of key Media composition
1.8 摇瓶发酵验证
将菌株Bs916和工程菌株B9BD分别在LB培养基、Landy培养基、基础发酵培养基Bas和优化培养基opt进行发酵,比较Surfactin的产量,以验证优化培养基的效果,试验3次重复。
2 结果与分析
2.1 发酵培养基主要成分单因素筛选
2.1.1 碳源对工程菌株B9BD合成Surfactin的影响 有文献报道,葡萄糖或蔗糖是最适合作为枯草芽胞杆菌产Surfactin的碳源[12]。本试验结果表明,用蔗糖作为碳源,菌株B9BD产Surfactin的量下降,其产量为(247.49±18.88)mg/L,明显低于葡萄糖作为碳源处理(图1)。因此,后续将使用葡萄糖为发酵培养基碳源。

图1 不同碳源对菌株B9BD产生Surfactin的影响Fig. 1 Effect of different carbon sources on the production of Surfactin byB. subtilisB9BD
2.1.2 氮源对工程菌株 B9BD合成 Surfactin的影响 不同氮源(有机氮和无机氮)对菌株 B9BD产生Surfactin能力的影响结果表明,当培养基中只含有硝酸铵时,菌株B9BD不具有产生Surfactin的能力;当培养基中含有两种有机氮源组合时,更有利于Surfactin的合成;硝酸铵比硫酸铵更有利于Surfactin的合成;当把蛋白胨(Peptone)、牛肉浸膏(BE)、酵母粉(YE)、黄豆粉(SM)和黄豆饼粉(SCM)中的两种有机氮源与硝酸铵(AN)或硫酸铵(SN)其中一种无机氮源进行三元组合后,菌株B9BD在三元组合的培养基中Surfactin的产量较高。菌株B9BD在黄豆粉等量替换蛋白胨后的组合(SM+BE+AN)培养基中Surfactin产量为(396.33±14.77) mg/L,而基础培养基Bas(Peptone+BE+AN)的Surfactin产量为(414.96±23.09)mg/L;在5%水平,两种培养基的Surfactin产量无显著差异(图2)。基于成本因素,本研究后续以黄豆粉作为主要氮源,辅助添加牛肉浸膏和硝酸铵为菌株B9BD发酵Surfactin的氮源。

图2 不同氮源对菌株B9BD合成Surfactin的影响Fig. 2 Effects of different nitrogen sources on the production of Surfactin byB. subtilisB9BD
2.1.3 金属离子对工程菌株B9BD合成Surfactin的影响 有文献报道,金属离子能促进芽胞杆菌Surfactin的合成[13]。由图3所示,在培养基中添加 Fe2+能增加Surfactin的产量,达(461.10±16.47)mg/L,但在培养基中添加Cu2+和Ca2+后,Surfactin的产量反而下降。

图3 不同金属离子对菌株B9BD合成Surfactin的影响Fig. 3 Effect of different metal ions on the production of Surfactin byB. subtilisB9BD
2.2 Plackett-Burman试验结果
基于单因素试验和基础培养基,选取10个培养基组分开展10因素2水平的Plackett-Burman试验,共设计12组培养基,其发酵Surfactin的产量见表2。将试验结果利用Design-expert软件进行回归分析和方差统计分析结果表明,PB试验数据回归分析所得各因子的回归方程为Y=331.64+159.56A+53.58B+44.43C+19.42D+76.25E+16.93F+15.24G-34.10H-4.09J-14.23K,校正系数R2=0.9992,式中Y为Surfactin产量的预测值。由校正系数可知Y的变化中99.92%能被回归方程解释。Design-expert对回归模型的方差分析(表3)表明,回归模型是显著的(P=0.0472),葡萄糖(A)、黄豆粉(B)和L-亮氨酸(E)是对菌株B9BD产生Surfactin具有显著性影响(P<0.05)的主要因子。因此,在后续的中心组合试验设计中将以培养基成分(葡萄糖、黄豆粉和L-亮氨酸)作为研究对象进行进一步优化。

表2 培养基成分部分因子Plackett-Burman试验设计及试验结果Table 2 Experimental design and response of Plackett-Burman of media composition

表3 培养基成分部分因子Plackett-Burman试验设计的方差分析Table 3 Analysis of variance for Plackett-Burman design of media compositions
2.3 最陡爬坡试验
最陡爬坡试验的设计和响应值如表4所示,菌株B9BD在试验设计的5组培养基中的Surfactin产量各不相同,且互相之间都具有显著差异;其中第3组培养基组合的Surfactin产量最高,达831.21 mg/L,表明该组合的变量水平已接近最佳用量,可以作为中心组合试验的中心点进行试验。

表4 最陡爬坡试验设计及测定值Table 4 The experimental design and results of the path of steepest ascent experiments
2.4 中心组合试验及响应曲面分析
中心组合试验设定各因素水平及测定值如表5所示,将试验结果利用Design-expert软件进行回归分析和方差统计分析结果如表6所示。中心组合试验数据回归分析,获得主要因子回归方程为:Y=864.91-18.64A+34.95B+14.59C-3.91AB-4.69AC+9.78BC-98.20A2-48.46B2-40.48C2,校正系数R2=0.9312,式中Y为Surfactin产量的预测值。模型的P值小于0.0001,表明该模型正确可靠,该菌株发酵产生的Surfactin量实际测定值与方程预测值存在显著相关性。该模型变异系数CV为3.80%,小于10%,属于弱变异,这进一步表明试验数据的可靠性。缺失拟合项值为2.24,该回归方程的失拟不显著(P>0.05),说明所建立的回归方程拟合度较高,该模型可以用于预测Surfactin产量。

表5 中心组合试验设计Surfactin产量测定值Table 5 The Experimental design and responses of central composite design

表6 培养基关键因素中心组合试验回归方程的方差分析Table 6 Analysis of variance of central composite design
葡萄糖、黄豆粉和L-亮氨酸影响菌株B9BD发酵Surfactin产量的响应曲面三维图都有凸起的最高点,表明中心组合试验建立的模型可以预测3个因素的最佳中心点,即可以确定3个变量的最优值(图4)。根据中心组合试验回归方程求得3个因素的最优值,分别为葡萄糖24.27 g/L、黄豆粉29.05 g/L和L-亮氨酸2.36 g/L,Surfactin产量预测值为882.24 mg/L。由此,得到最优培养基配方为:葡萄糖24.27 g/L、黄豆粉29.05 g/L、牛肉浸膏3 g/L、NH4NO34 g/L、L-亮氨酸2.36 g/L、KH2PO43 g/L、NaCl 3 g/L和FeSO40.02 g/L。
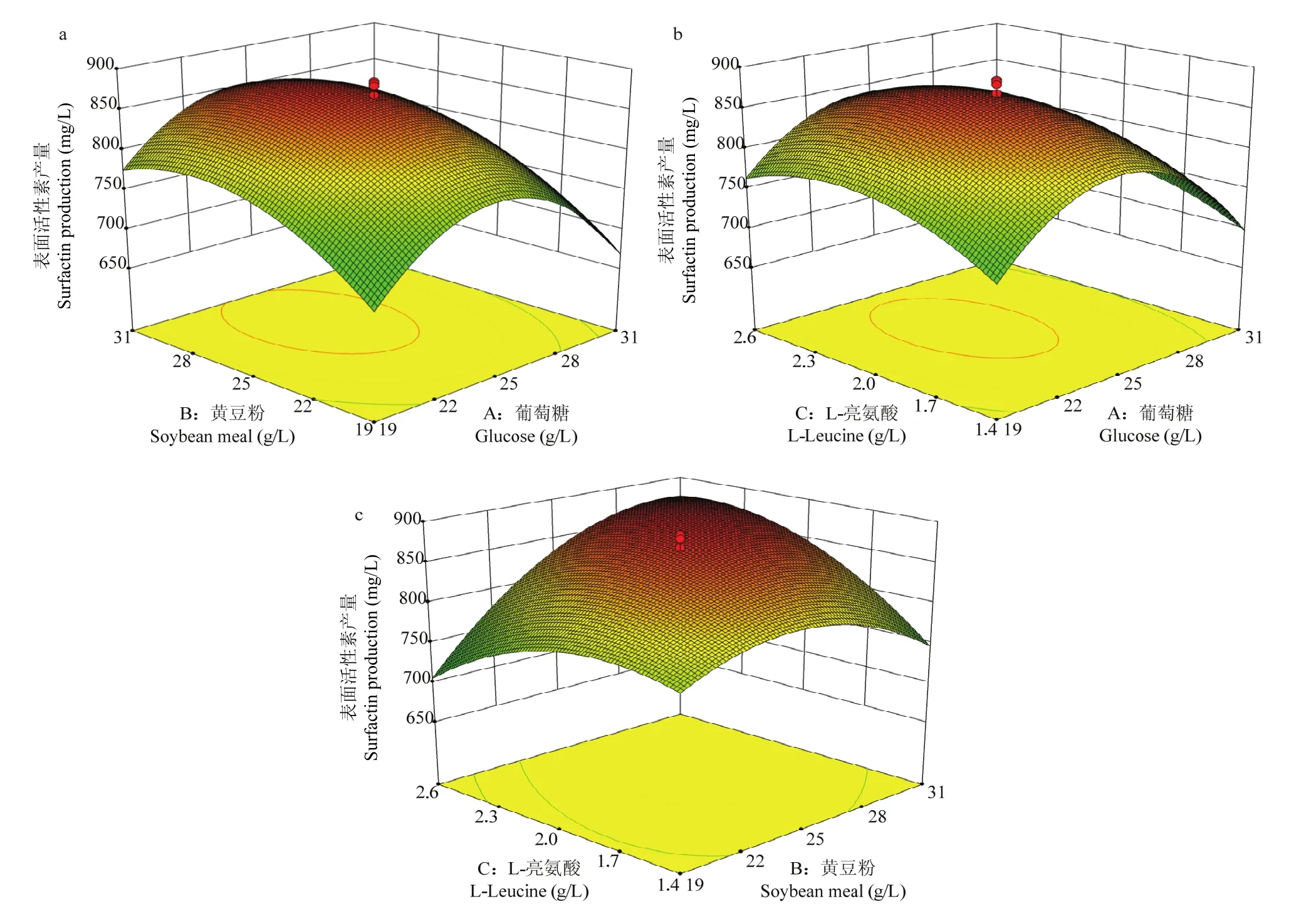
图4 葡萄糖和黄豆粉(a)、葡萄糖和L-亮氨酸(b)、黄豆粉和L-亮氨酸(c)的响应曲面分析Fig. 4 Response surface curves showing the interface of the glucose, soybean meal and L-leucine
2.5 摇瓶发酵验证
将菌株Bs916和B9BD在优化培养基Opt进行摇培发酵试验,并与Bas培养基、Landy培养基和LB培养基对比Surfactin产量结果表明,工程菌株B9BD在Opt培养基中Surfactin平均产量达(934.25±32.67)mg/L,是B9BD在Bas培养基中Surfactin产量的2.25倍,是B9BD在LB培养基和Landy培养基的5.6倍。野生菌株Bs916在Opt培养基中Surfactin产量为(334.37±19.25)mg/L,分别是Bas培养基、LB培养基和Landy培养基中Surfactin产量的2.0、4.7和4.8倍(图5)。以上结果同时也表明,Opt培养基对工程菌株B9BD和野生型菌株Bs916产Surfactin都有显著提升作用。

图5 优化培养基发酵Surfactin产量验证Fig. 5 Verification of the Surfactin yeild in optimized medium
3 讨论
Surfactin因其独特的理化性质,在农业、工业、医药和食品加工等领域具有广泛的应用前景[14-17]。目前,Surfactin不能进行有机合成,只能该通过微生物发酵生产,因此,发酵工艺的优化是提高Surfactin产量的重要环节。近年来,利用Design-expert软件设计PB试验和响应曲面法被广泛应用于微生物发酵工艺的筛选和优化[18,19],如乔俊卿等[20]利用PB试验和响应曲面分析法优化了枯草芽胞杆菌T-500菌株产脂肽类抗生素的发酵工艺。本研究通过比较不同碳源、氮源和金属离子对芽胞杆菌工程菌株B9ΔdegUΔbmyA(B9BD)产Surfactin能力的影响,初步确定了对菌株B9BD的Surfactin产量有重要影响的培养基成分,再通过PB试验、中心组合试验和响应曲面法,优化获得菌株B9BD产生Surfactin的高效发酵培养基配方,其摇培发酵产量可达934.25 mg/L。根据培养基各组分的价格,计算可知LB培养基每升的成本为6.37元,优化培养基每升的成本为2.70元;菌株B9BD在LB培养基中发酵生产1 g Surfactin的培养基成本为38.13元,而在优化培养基中的发酵培养基成本仅为2.88元,仅为LB培养基发酵成本的7.5%。
氮源在Surfactin生产过程中起着关键作用。为了提高Surfactin的产量,郅岩等[21]筛选的培养基中用到了蛋白胨和硝酸铵,王军强等[22]的培养基中把牛肉膏和硝酸铵作为氮源,而汤颖秀等[23]筛选的培养基中只有硝酸铵一种氮源。本试验中对多种氮源进行组合筛选发现,蛋白胨-牛肉浸膏-硝酸铵组合的效果是最好。其中蛋白胨是有机氮源,硝酸铵作为无机氮源,可以看作对有机氮源的补充,而少量添加牛肉浸膏,也使 Surfactin的产量进一步提高。此外,黄豆粉是工业生产上的一种廉价、易获得氮源,本研究用黄豆粉替代蛋白胨,也可以达到相当的效果,这降低了发酵培养基的成本,有助于在工业上的大规模发酵。
氨基酸是Surfactin生物合成的重要前体,增加氨基酸供应对Surfactin的产生具有积极影响。通过PB试验发现,L-亮氨酸是对Surfactin产量有显著影响的培养基关键成分。有研究指出,通过增强亮氨酸代谢途径,Surfactin的产量可以提高20.9倍[24]。王苗苗等[25]在THBS-2菌株摇瓶发酵过程中添加一定量的L-亮氨酸,Surfactin产量提高一倍左右。后期,我们将对氨基酸前体进行种类筛选和用量筛选,并作为补料进行中途补充,以验证其对Surfactin产量的影响。
本研究只是对B9BD菌株产生Surfactin的发酵培养基成分进行了优化,但发酵条件等还需要进一步研究,以期为工业上大规模生产提供理论依据。
