菌株CSR-2对玉米茎腐病的生防作用及其全基因组序列分析
2022-04-22赵美茜白忠义张祥辉刘金亮潘洪玉张艳华
赵美茜,白忠义,张祥辉,刘金亮,潘洪玉,张艳华
(吉林大学植物科学学院,长春 130062)
玉米ZeamaysL.是世界上最主要的粮食作物,在农业生产中起着重要的作用。玉米生产受到茎腐病的严重影响,茎腐病是最广泛和最具破坏性的土传病害之一[1]。茎腐病主要由几种镰孢菌引起,如禾谷镰孢Fusariumgraminearum、轮枝镰孢F.verticillioides和层出镰孢F.proliferatum等[2-4]。其中,禾谷镰孢是引起玉米茎腐病的主要病原体,而且它能产生多种真菌毒素,降低玉米品质[5-7]。在我国由玉米茎腐病造成的损失从5%到80%不等,因此,控制禾谷镰孢引起的茎腐病具有重要意义[8,9]。
目前,玉米茎腐病的防治主要依赖于抗性品种和化学杀菌剂。然而高抗茎腐病的品种资源不足,选育抗茎腐病的玉米品种耗时费力[10,11]。化学防治方法存在成本高、环境污染、农残残留以及食品安全等问题[12]。因此,生物防治方法作为可持续发展的新兴技术,研究日益深入。木霉和芽胞杆菌是目前用于防治玉米茎腐病最为广泛的菌株[13-16]。
本研究从玉米根际土壤中分离获得一株具有良好生防效果的细菌菌株CSR-2,该菌株对多种植物病原真菌均具有拮抗作用,影响禾谷镰孢菌丝生长、菌丝形态及孢子萌发。将该菌株与玉米膜下滴灌水肥药一体化技术进行联用,对茎腐病防治效果显著。通过第三代PacBio全基因组测序分析,并结合平均核苷酸一致性(Average Nucleotide Identity,ANI)对生防菌株CSR-2的分类地位进行鉴定,为深入挖掘其生防潜力及次级代谢产物基因簇用于农业生物防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 禾谷镰孢、稻瘟菌Magnaportheoryzae、灰葡萄孢菌Botrytiscinerea、核盘菌Sclerotinia sclerotiorum、玉米灰斑病菌Cercosporazeae-maydi、玉米小斑病菌Helminthosporiummaydis及立枯丝核菌Rhizoctoniasolani,均由本实验室保存。
1.1.2 生防菌菌株 取玉米根际土壤,利用平板对峙法进行生防菌株的初筛、复筛,获得对植物病原真菌具有拮抗作用的菌株CSR-2。
1.1.3 培养基 马铃薯葡萄糖培养基(PDA):马铃薯200 g/L,葡萄糖20 g/L,琼脂粉20 g/L;牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂粉20 g/L;绿豆培养基:绿豆40 g/L,琼脂粉20 g/L。以上培养基均121 ℃高温灭菌20 min。
1.2 试验方法
1.2.1 发酵液的制备 菌株CSR-2接种到LB液体培养基中,于37 ℃恒温振荡培养12 h后,用LB液体培养基将发酵液稀释到OD600=0.6。
1.2.2 病原菌分生孢子悬浮液制备 灰葡萄孢和玉米小斑病菌分别接种于PDA固体培养基,培养5~7 d,在平板中加入5 mL无菌水冲洗,用三层无菌纱布过滤,利用无菌水将各孢子悬浮液稀释至105CFU/mL,获得灰葡萄孢和玉米小斑病菌分生孢子悬浮液。禾谷镰孢接种于PDA固体培养基,培养3 d,用打孔器取边缘菌饼接种于50 mL绿豆培养基中,28 ℃振荡培养96 h,加无菌水稀释至105CFU/mL,获得禾谷镰孢分生孢子悬浮液。
1.2.3 对菌丝生长的抑制能力测定 采用对峙培养法测定CSR-2发酵液对多种植物病原真菌的抑制活性。在直径为9 cm的PDA平板中心接种直径为8 mm活化的病原真菌(禾谷镰孢、稻瘟菌、灰葡萄孢菌、核盘菌、玉米灰斑病菌、玉米小斑病菌及立枯丝核菌)菌饼。在距中心25 mm处放置面积为1 cm2无菌滤纸片,取10 μL菌株CSR-2发酵液接种于无菌滤纸片上,以仅接种病原真菌的PDA平板作为对照。通过计算抑菌率,评估菌株CSR-2发酵液的抑制活性,每个处理重复3次。抑菌率(%)=(对照菌落半径-处理菌落半径)/对照菌落半径×100。
1.2.4 对病原菌菌丝形态的影响 按照1.2.3的处理方法,将菌株CSR-2发酵液(OD600=0.6)与病原菌共培养在 PDA平板上,在菌丝边缘斜插入灭菌后的盖玻片,待菌丝生长至盖玻片上,在显微镜下观察处理组与对照组病原菌菌丝形态。
1.2.5 对病原菌分生孢子萌发的抑制能力测定 将菌株CSR-2接种到20 mL LB液体培养基中,37 ℃、200 r/min振荡培养12 h。利用LB液体培养基将发酵液稀释到OD600分别为0.15、0.3、0.6。取等体积的发酵液与禾谷镰孢分生孢子悬浮液混合置于凹面载玻片上,每个浓度重复2次。从接种开始每隔1 h于光学显微镜下观察(20×20),每个重复计数3个视野区域,每个视野区域观察约50个孢子,统计孢子萌发数量,计算各处理的孢子萌发率。孢子萌发率(%)=孢子萌发数量/视野内孢子数量×100。
1.2.6 菌株CSR-2对玉米茎腐病防治效果的田间试验 试验于2020年5月至10月在吉林省松原市乾安县赞字乡父子村水肥药一体化试验基地进行。试验设置无药剂处理的阴性对照(CK)、2%戊唑醇悬浮种衣剂包衣、生防菌CSR-2处理3个小区,每个小区50 m2,3个重复,共9个小区。将禾谷镰孢接种到灭菌带壳高梁培养基中,25 ℃培养3 d,至菌丝长满高梁粒表面。玉米田间播种时,同时播种3 g处理好的带菌高梁粒,播种深度为4~5 cm。生防菌施用是借助水肥药一体化装置采用玉米膜下滴灌的方式,分别在播种前期、3叶期、8~10叶期3次进行,生防菌浓度为1.5×108CFU/mL,按照1 L/m2剂量施用。玉米茎腐病的田间防效采取棋盘式取样,每个样点调查 10株,统计病情指数和防治效果。病情指数=Σ(病级数×该病级植株数)/(最大病级数×植株总株数)×100,防治效果(%)=(对照组病情指数-处理组病情指数)/对照病情指数×100。
1.3 全基因组序列测定和分析
1.3.1 DNA提取、基因组测序及组装 采用改进的 CTAB法从菌株 CSR-2中提取基因组 DNA,利用NanoDrop 2000分光光度计(Thermo Fisher Scientific,Waltham,MA,USA)、Qubit dsDNA HS检测试剂盒(Qubit 3.0荧光仪)和0.8%凝胶电泳检测DNA质量。使用G-tubes(Covaris)将合格的基因组DNA片段化并进行末端修复,制备SMRTbell DNA文库(片段大小为>10 kb,采用Blue Pippin系统)。利用Qubit分析文库质量,Agilent 2100 Bioanalyzer(Agilent,Santa Clara,CA,USA)估计片段平均大小。SMRT测序采用Pacific Biosciences Sequel II测序仪(Frasergen Bioinformatics Co.,Ltd,Wuhan,China)。利用Microassembly(smrtlink8)、HGAP4 及 Canu(v.1.6)重新组装 PacBio reads,使用 pbalign(BLASR, v0.4.1)分析基因组覆盖深度,利用Circos(v0.64)获得菌株CSR-2的基因组圈图[17-20]。
1.3.2 基因组的注释及菌株鉴定 菌株CSR-2的全基因组用Glimmer(v3.02)注释[21]。核糖体RNA基因用 RNAmmer(v1.2)鉴定,tRNA 基因用 tRNAscan-SE(v2.0)验证。对 NR、SwissProt、COG、KEGG及GO进行BLAST全基因组搜索(e值阈值为1e-5),选择得分最高的作为最后的注释[21-23]。利用OAT(0.90)计算菌株CSR-2与其他菌株全基因组序列的平均核苷酸同源性(ANI),通过BLASTx对NR与NT数据库进行比对鉴定菌株CSR-2。
2 结果与分析
2.1 菌株CSR-2抑菌活性
采用对峙培养法对从玉米根际土壤中分离到的菌株CSR-2进行抑菌活性分析结果显示,菌株CSR-2对禾谷镰孢、玉米小斑病菌、稻瘟菌、灰葡萄孢菌、核盘菌、玉米灰斑病菌以及立枯丝核菌均有明显的抑制效果,形成明显的抑菌带,抑制率为60.6%~66.8%(图1)。上述结果表明,生防菌CSR-2对多种植物病原真菌有较强的拮抗作用,显著抑制病原菌菌丝生长,并具有一定的广谱性。
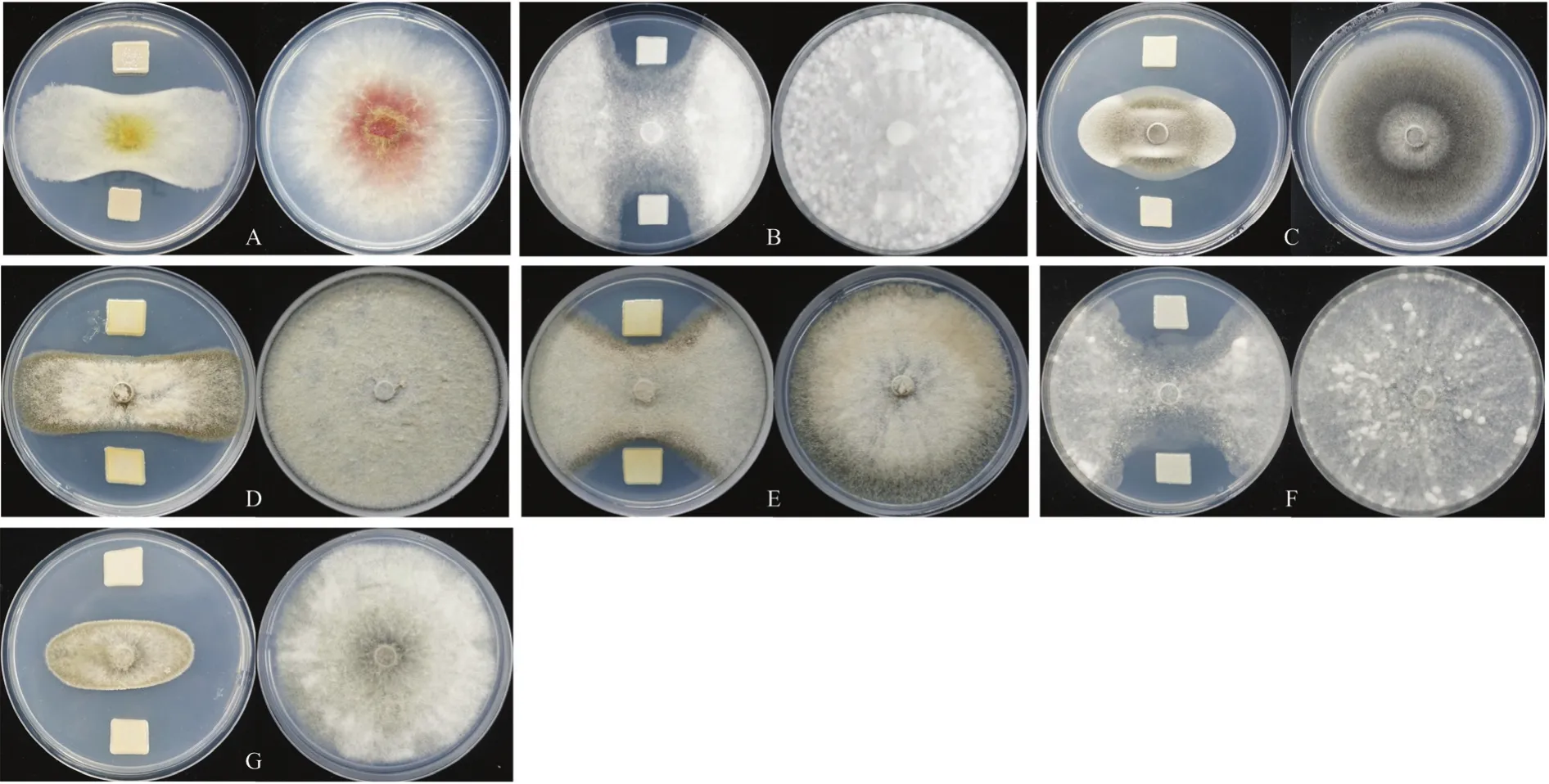
图1 菌株CSR-2对植物病原真菌的抑制作用Fig.1 Inhibitory effect of strain CSR-2 on plant pathogenic fungi
2.2 菌株CSR-2对病原真菌菌丝形态以及孢子萌发的影响
将菌株CSR-2发酵液分别与禾谷镰孢、立枯丝核菌、玉米灰斑病菌共培养在PDA平板上,在显微镜下观察病原菌的菌丝形态。结果表明,对照组3种病原菌的菌丝表面光滑,粗细一致,渗透性正常,内含物分布均匀。处理组禾谷镰孢菌丝表面褶皱,粗细不均;处理组立枯丝核菌与玉米灰斑病菌菌丝出现内含物分布不均匀且外溢的现象,表明菌株CSR-2能够破坏病原菌菌丝的结构,抑制菌丝的生长(图2)。
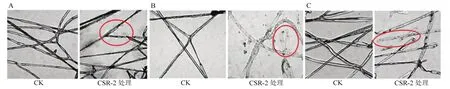
图2 菌株CSR-2对病原真菌菌丝形态的影响Fig.2 Effects of strain CSR-2 on mycelial morphology of plant pathogenic fungi
利用OD600=0.15、0.3与0.6的菌株CSR-2发酵液处理禾谷镰孢分生孢子悬浮液。结果显示,对照组分生孢子在培养3 h时开始萌发,从其一端或两端长出芽管,5 h后即可形成菌丝。而用菌株CSR-2发酵液(OD600=0.6)处理的分生孢子表面皱缩,渗透性异常,5 h后分生孢子不能萌发形成菌丝。用OD600=0.3发酵液处理3 h,分生孢子不能正常萌发,5 h后部分孢子开始形成芽管。发酵液浓度为OD600=0.15时对分生孢子形态影响较小,3 h时多数孢子可以正常萌发(图3)。
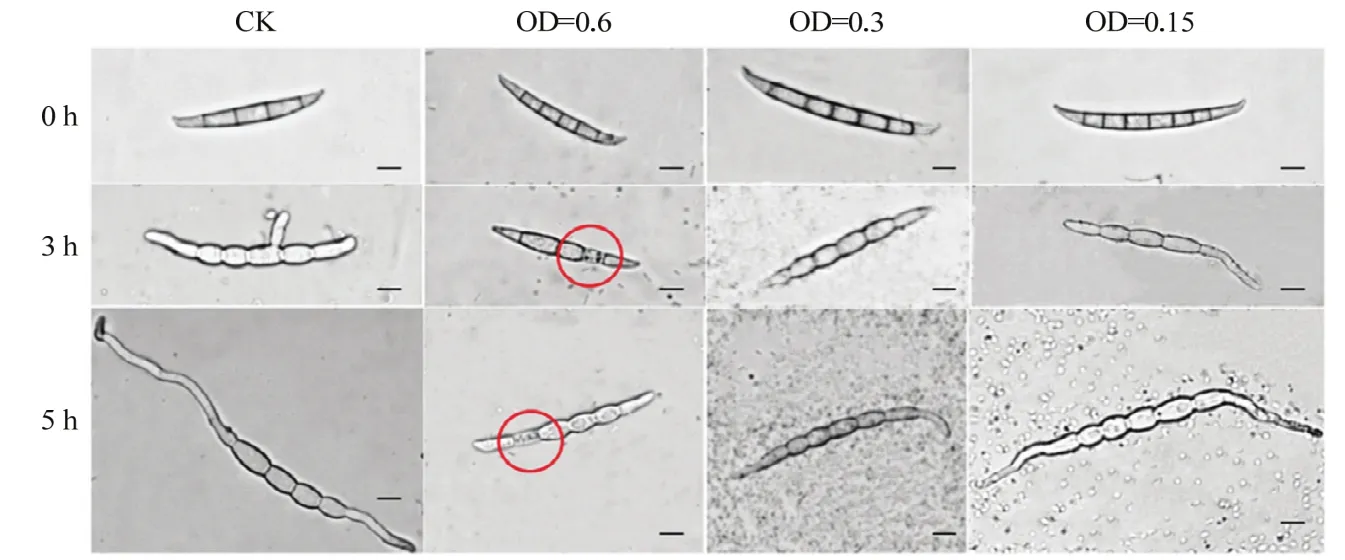
图3 菌株CSR-2对禾谷镰孢分生孢子萌发的影响(比例尺=10 μm)Fig.3 Effects of CSR-2 on conidial germination of F.graminearum(scale=10 μm)
菌株CSR-2发酵液对禾谷镰孢分生孢子的影响结果表明,菌株CSR-2发酵液与禾谷镰孢分生孢子处理4 h时,对照组分生孢子萌发率为84.31%,3个处理组(OD600=0.15、0.3和0.6)分生孢子的萌发率分别为59.22%、8.33%及7.14%。随着菌株CSR-2发酵液浓度增加,禾谷镰孢分生孢子萌发率逐渐降低,推测菌株CSR-2产生的次生代谢产物能破坏禾谷镰孢分生孢子的结构从而抑制孢子萌发(图4)。
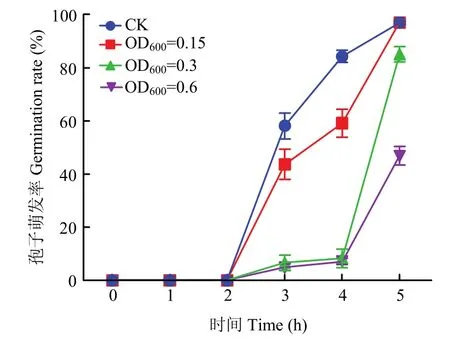
图4 不同浓度的CSR-2对禾谷镰孢分生孢子萌发的影响Fig.4 Effects of different concentrations CSR-2 on the conidia germination of F.graminearum
2.3 菌株CSR-2田间试验结果
在无药剂处理的阴性对照组,玉米茎腐病的病情指数为78.9;2%戊唑醇悬浮种衣剂进行种子包衣的病情指数为38.9,防治效果为50.7%;生防菌CSR-2处理组病情指数为37.1,病害防治效果为52.3%,表明CSR-2可显著降低玉米茎腐病的田间发病率(表1)。
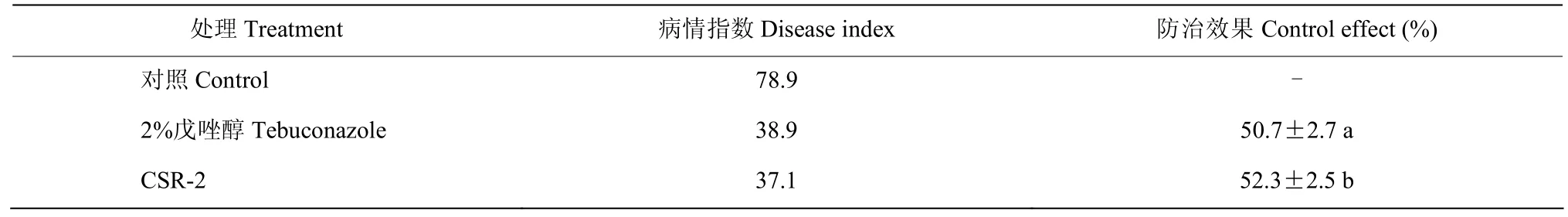
表1 菌株CSR-2对玉米茎腐病的田间防治效果Table 1 Biocontrol effect of strain CSR-2 against maize stalk rot in field trials
2.4 菌株CSR-2全基因组测序结果
2.4.1 基因组测序与组装 采用三代 PacBio测序技术进行CSR-2全基因组测序,共获得198692条高质量的长片段,基因组测序深度为395.83 X,N50大小为9082 bp。采用Microbial Assembly、HGAP4软件和Canu(v1.6)软件对数据进行组装结果表明,菌株CSR-2基因组由3202366 bp的单条环状染色体组成,GC含量为 59.11%。基于 GC含量、GC偏差、tRNA/rRNA、COG注释、碱基修饰和限制性修饰系统相关酶等信息构建基因组圈图,全基因组测序结果已登录到GenBank,收录号为CP081941(图5)。
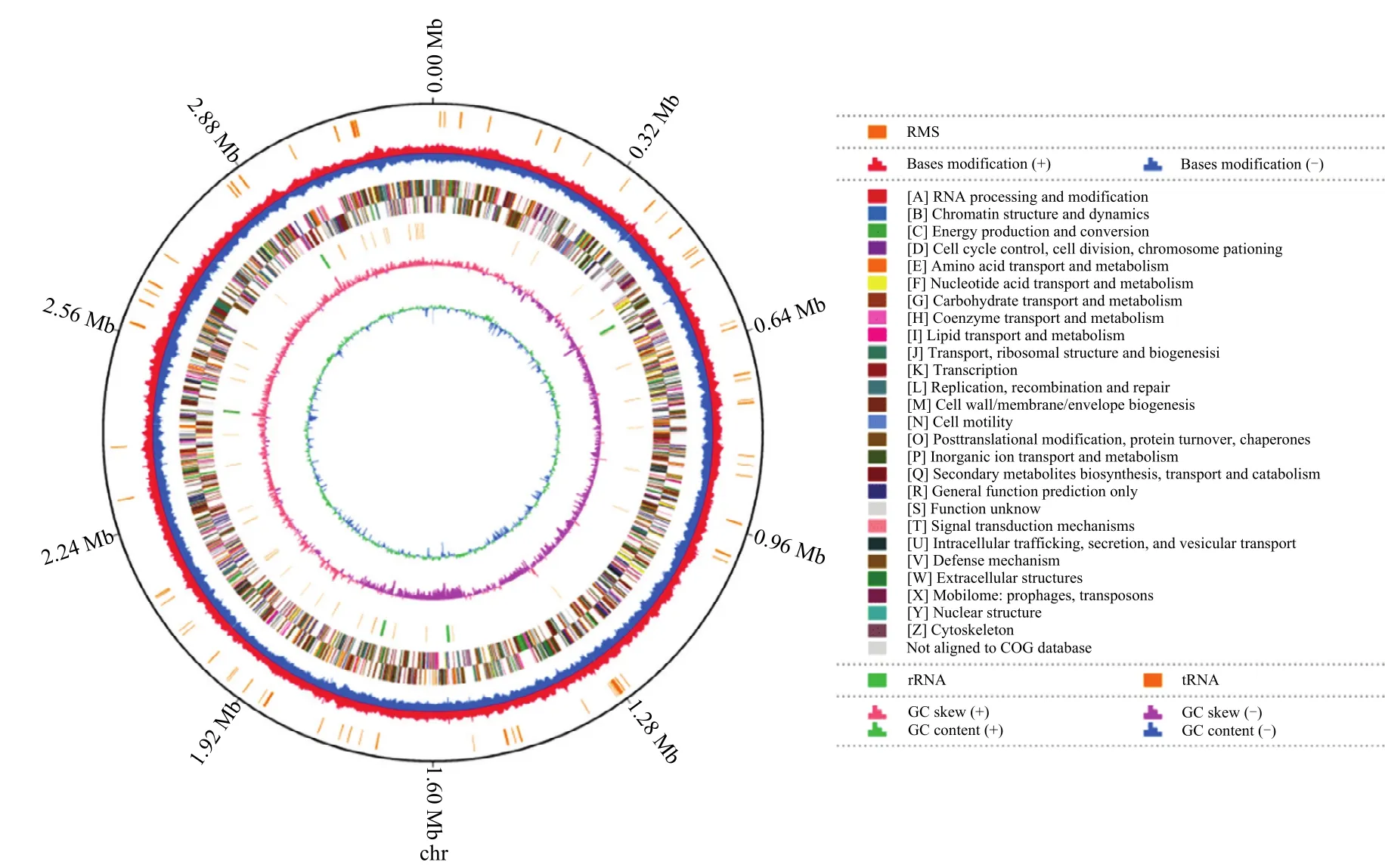
图5 菌株CSR-2基因组圈图Fig.5 Circular genome map of strain CSR-2
2.4.2 编码基因的注释及菌株鉴定 采用软件Glimmer(v3.02)在菌株CSR-2中鉴定出3007个编码基因,编码基因总长为2837892 bp,平均长度为943.76 bp,编码基因占全基因组序列的88.62%,其中含有62个tRNAs、15个rRNAs和14个其他RNA序列。使用trf409.legacylinux64软件鉴定出串联重复序列 97个,简单串联重复序列29个。
利用NR数据库进行蛋白质序列相似性搜索结果显示,共有2743个基因被注释到NR数据库中,占总数的91.22%。菌株CSR-2基因组的NR数据库注释排名前10的物种分布如图6所示,相似性最高的是朝井杆菌属,在菌株CSR-2的编码基因中共注释到810个编码基因,占总数的29.53%,总量最大;其次为茂物朝井杆菌Asaiabogorensis注释了739个基因,占比为26.94%。对5株朝井杆菌属细菌的全基因组序列的ANI分析表明,菌株CSR-2与茂物朝井杆菌NBRC 16594(GenBank收录号为AP014690.1)ANI值最高(80.09%),与朝井杆菌属的暹罗朝井杆菌A.siamensis、桔梗朝井杆菌A.platycodi、夏枯草朝井杆菌A.prunellae和落新妇朝井杆菌A.astilbis的ANI值在79.12%~77.39 %,表明CSR-2与茂物朝井杆菌基因组相似度最高。利用NT数据库对菌株CSR-2染色体序列进行比对结果表明,该菌株与茂物朝井杆菌NBRC 16594相似度最高。结合ANI分析及NR、NT数据库比对结果,菌株CSR-2被鉴定为茂物朝井杆菌。
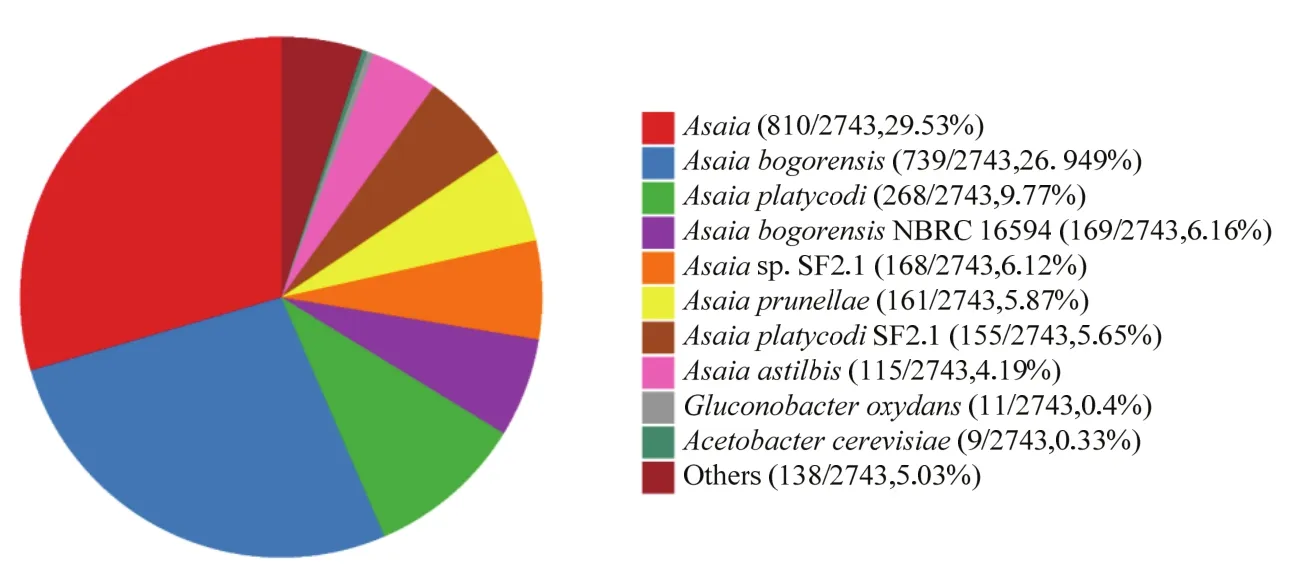
图6 菌株CSR-2基因组的NR数据库注释前十物种分布图Fig.6 Top-hit species distribution in the BLASTx analysis against the NR database of strain CSR-2 genome
3 讨论
本研究从玉米根际土壤中分离到对禾谷镰孢、稻瘟菌等7种植物病原真菌均有显著抑制效果的细菌菌株CSR-2,田间试验表明该菌株对禾谷镰孢引起的玉米茎腐病有显著的防治效果。为深入挖掘CSR-2生防潜力及次级代谢产物基因簇,本研究采用三代PacBio测序技术对菌株CSR-2进行全基因组测序和分析。第三代PacBio测序技术能够对单个DNA分子进行测序,并开发了用于三代测序的一些基因组装软件,读段更长,准确率更高,极度敏感且无GC偏向性。自antiSMASH在线工具发布以来,全基因组序列信息在挖掘次级代谢产物基因簇领域得到了广泛的应用[24]。通过全基因组测序、ANI值分析以及NR、NT数据库比对,菌株CSR-2被鉴定为茂物朝井杆菌。
醋酸菌(Acetic acid bacteria,AAB)是以氧气为终端电子受体,氧化糖类、糖醇类和醇类生成相应的糖醇、酮和有机酸的革兰氏阴性细菌的总称。已报道的醋酸菌共16个属,84个种。随着AAB种类的增加,AAB的功能也逐渐被发掘,如产生纤维素、色素、吲哚乙酸、抗坏血酸和固氮等[25]。朝井杆菌属是2000年被提出来的,以日本细菌学家Toshinobu Asai命名,该属的典型菌种为茂物朝井杆菌[26]。
茂物朝井杆菌是首次从常绿乔木羊蹄甲Bauhiniapurpurea中分离出来的一种革兰氏阴性细菌,好氧、杆状、具有鞭毛,属于醋酸杆菌科朝井杆菌属[26]。该菌常栖息于热带植物的花朵和果实中,能够合成类胡萝卜素和类异戊二烯醌等物质,促进其适应于不同的生长环境[27-29]。研究发现,该菌能产生许多胞外聚集物,具有粘附性,生物膜稳定性强,具有很强的适应能力,能在多种不同的环境中生长。Grogan等[30]搜索了茂物朝井杆菌SF2.1全基因组序列,寻找该菌株细胞内蛋白质定位信号序列,并将其与报告蛋白碱性磷酸酶相融合,其中有3个信号肽能够释放抗菌肽类物质。利用蚊子进一步测试表明,这3株茂物朝井杆菌菌株能够产生抑制由寄生虫引起的疟疾[31]。上述研究表明茂物朝井杆菌次生代谢产物丰富,适应性强,能够产生多种抗菌性物质,但有关该菌株的研究和报道很少,尤其是有关茂物朝井杆菌对植物病原菌抑制作用的研究报道。
本研究表明菌株CSR-2影响禾谷镰孢菌丝生长和菌丝形态,经过发酵液处理的禾谷镰孢分生孢子在4 h时萌发率降低了77.17%,推测菌株CSR-2产生的抑菌性物质分泌到细胞外,拮抗病原真菌菌丝生长和孢子萌发,有关菌株CSR-2次生代谢产物的分离鉴定试验还在进行中。将该菌株与玉米膜下滴灌水肥药一体化相结合的田间试验结果表明,菌株CSR-2对玉米茎腐病的防效显著,且略高于2%戊唑醇悬浮种衣剂,可能与种衣剂在玉米灌浆前期效果减弱有关。如果将生防菌与种衣剂联合施用,可能对玉米茎腐病的防治效果更好。本研究报道了茂物朝井杆菌CSR-2的生物防治作用,进行了全基因组序列测定和分析,并将生防菌与膜下滴灌水肥药一体化体系相结合,为进一步挖掘微生物资源及其代谢产物基因簇用于农业生物防治提供理论依据。关于该菌株的代谢产物分析,生物防治机理还有待于进一步研究。
