穴位埋线对去势骨质疏松大鼠BMD、BMSCs、ALP及TGF-β信号通路的影响
2022-04-21曾丽蓉龚海峰谢菊英
陈 菁,曾丽蓉,龚海峰,谢菊英
(1.湘南学院 康复学院,湖南 郴州423000;2.湘南学院附属康复医院,湖南 郴州 423000; 3.湘南学院第一附属医院,湖南 郴州423000)
绝经后骨质疏松症(Postmenopausal osteoporosis,PMO)是骨质疏松症的主要类型之一。其发病机制与妇女绝经后的卵巢功能减弱、雌激素水平降低有关,卵巢功能减弱可能引起骨的吸收生成,进而出现以骨量低下、骨组织的显微结构退行性变为特征的骨质疏松[1-2],该病是一种以骨量减少、骨微结构破坏、骨强度降低、骨脆性增加及易发生骨折为临床特征的全身代谢性骨骼疾病[3]。据国内相关文献报道PMO发病率约为20.7%,且随年龄增加发病率逐渐提高,已逐渐成为我国严重公共卫生问题[5]。因此,选取简便性、廉价性及安全性高的治疗靶点是治疗PMO的首选。
近年来,医学界大力提倡采用中西医结合的方法治疗骨质疏松,穴位埋线作为临床应用较广泛的方法之一,已得到国内外学者的认可[6]。穴位埋线的主要机制是在中医针灸学基础理论指导下,结合现代医学手段,将特质的可吸收蛋白线置入穴位内,刺激穴位产生持续的化学反应,从而达到治病的目的,但是对于穴位埋线的调控机制机理,目前尚缺乏系统性研究。本研究在中医“肾主骨”理论指导下,通过前期临床实践发现通过穴位埋线等方法刺激“肾”相关腧穴能够有效改善骨质疏松症。因此,本研究基于“肾主骨”理论,通过对SD大鼠PMO模型进行穴位埋线,观察穴位埋线对大鼠BMD、BMSCs、ALP蛋白及TGF-β信号通路的调控作用,以期为“肾主骨”的穴位埋线治疗PMO基础理论提供实验依据。
1 材料与仪器
1.1 实验动物
选用3月龄SD雌性大鼠,SPF级(Ⅱ级),体质量220 g左右(由烟台安蒙氏生物医药有限公司提供,购于湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘) 2013-0004,饲养温度 18~25℃,标准普通饲料喂养)。实验过程中对动物的处置符合国家科技部 2006 年颁布的《关于善待实验动物的指导性意见》。
1.2 实验器材及试剂
选用12号埋线针,装入1/0号羊肠线8 mm;α-MEM培养基、高糖DMEM培养基(美国Gibco公司);血清骨碱性磷酸酶(BALP)试剂盒(上海碧云天生物);Herocell C1型CO2恒温培养箱(上海润度生物);BCM-1000A-5702R型低速离心机;骨钙素(OC)和I型原胶 N-端前肤(PINB) 测定试剂盒(南京建成生物工程研究所)。
2 方法
2.1 实验动物分组及造模
将48只3月龄健康雌性SD大鼠,SPF级(Ⅱ级),随机分为正常组、模型组、穴位埋线组、非穴位埋线组,每组各12只。模型制备:选取48只3月龄健康雌性SD大鼠,SPF级(Ⅱ级),所有实验动物自由摄水和进食。造模前饲养大鼠7天以适应环境,腹腔注射20%乌拉坦(4 mL/kg)进行麻醉,所有大鼠均以背侧入路方式行完整双测卵巢摘除术。术后青霉素生理盐水(4万U/mL)肌注预防感染,每日注射1.5 mL,连续3 d。
2.2 干预手段
穴位埋线组干预方法:依据《动物针灸穴位图谱》(中国针灸学会实验针灸研究会制),选取肾俞、京门为主穴,肾俞位于第二腰椎下两旁,京门位于最后一肋游离端下缘。在模型造模成功即开始穴位埋线(医用可吸收蛋白线),每10日1次,3次为1个疗程,疗程间间隔3 d,共治疗3个月(3个疗程)[7]。
非穴位埋线组干预方法:非经非穴点选肾俞、京门各穴旁5 mm处;处理时间及疗程同穴位埋线组。
正常组和模型组干预方法:不进行任何治疗,正常饲养3个月。
2.3 标本采集与检测
2.3.1 骨密度(BMD) 治疗3个月后大鼠仰卧位置于QDR-4500A双能X线骨密度诊断仪上,测量分析股骨近端干骺端及第4腰椎、第5腰椎骨密度。
2.3.2 骨髓间充质干细胞(BMSCs) 采用脱臼法处死SD大鼠,无菌条件下取出大鼠股骨和胫骨,用完全培养液冲洗骨髓腔且收集冲洗液。高转速离心获得细胞沉淀液,采用DMEM/F12培养基重悬接种于细胞培养皿,置于CO2培养箱内。当细胞密度达到80%~90%时,进行传代,当进行第3-4代细胞传代时可得出BMSCs表达水平。用ELISA法检测骨钙素(OC)和I型原胶原N-端前肽(PINP)含量水平[8]。
2.3.3 碱性磷酸酶(ALP)蛋白活性测定 采用免疫组织化学(SABC) 染色法,光学显微镜下观察股骨组织ALP蛋白表达水平[9]。
2.3.4 转化生长因子-β(TGF-β)蛋白 通过RT-qPCR法检测TGF-β的mRNA蛋白表达水平[10]。
2.4 统计学处理
3 结果
3.1 穴位埋线对SD大鼠骨密度的影响
治疗3个月后,与正常组腰椎、股骨BMD水平比较,模型组明显低于正常组,差异有统计学意义(P<0.05);经埋线治疗后,与正常组和模型组相比,穴位埋线组和非穴位埋线组腰椎、股骨BMD均有明显提高(P<0.05),且穴位埋线组腰椎、股骨BMD水平比非穴位埋线组更高(P<0.05)。见表1。

表1 各组腰椎、股骨BMD对比
3.2 穴位埋线对SD大鼠BMSCs中IC增殖作用影响
治疗3个月后,与正常组BMSCs中OC和PINP对比,模型组明显降低正常组,差异具有统计学意义(P<0.05);经埋线治疗后,与正常组和模型组相比,穴位埋线组、非穴位埋线组BMSCs中OC和PINP水平均明显提高(P<0.05),且穴位埋线组BMSCs中OC和PINP水平高于非穴位埋线组(P<0.05)。见表2。
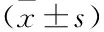
表2 各组BMSCs中OC和PINP含量对比
3.3 穴位埋线对SD大鼠ALP蛋白的影响
与正常组相比,模型组ALP表达水平明显降低,差异有统计学意义(P<0.05);经埋线治疗后,与正常组和模型组相比,穴位埋线组、非穴位埋线组ALP表达水平均明显增强(P<0.05),且穴位埋线组ALP表达水平优于非穴位埋线组(P<0.05)。见表3。

表3 各组ALP蛋白对比
3.4 穴位埋线对SD大鼠TGF-β蛋白水平的影响
经RT-qPCR检测发现,与正常组对比,模型组TGF-β mRNA表达水平明显降低,差异有统计学意义(P<0.05);经埋线治疗后,与正常组和模型组相比,穴位埋线组、非穴位埋线组TGF-β mRNA表达水平均明显增强(P<0.05),且穴位埋线组TGF-β mRNA表达水平优于非穴位埋线组(P<0.05)。见表4。

表4 各组TGF-β蛋白表达水平对比
4 结论
原发性骨质疏松(Osteoporosis,OP)是常见的中老年疾病之一,早期多无明显症状,后期多出现骨量减少、骨微结构破坏、骨脆性增加、骨强度降低及以易发生骨折为特征的全身性代谢性骨骼疾病[11],绝经后骨质疏松症患者约占所有骨质疏松患者的80%。目前,其发病机制多认为是由于卵巢功能衰退,雌激素水平下降,炎性因子表达水平增加,引起破骨细胞的生成增加、凋亡减少,导致骨吸收和重建代谢失衡所致[12]。
基于上述理论分析,目前雌激素补充剂作为主要治疗方案之一。主要通过雌激素补充促进成骨细胞增殖、抑制破骨细胞凋亡,从而发挥防治绝经后骨质疏松的作用[13]。但药物干预往往是终身性的,昂贵的治疗费用已成为家庭和社会的沉重负担。中医药治疗方法因其简便性、廉价性、安全性及有效性被广泛应用于临床,甚至作为替代疗法已逐渐取代普通药物干预。POM属祖国医学“骨痿”“骨痹”“腰痛”“骨枯”“骨极”等病证的范畴,发病之本在于肾虚。肾为“先天之本”,主骨生髓。肾藏精,精生髓,髓居骨中,骨赖髓以充养,肾气盛衰与骨的生长发育密切相关。骨质疏松正是病邪侵袭导致痰瘀困阻、气血不调而发病[14]。穴位埋线基于中医针灸学思想,结合现代科学手段,通过将可吸收的蛋白线置入穴位内,在穴位内产生相应的物理及化学反应,通过这种对腧穴的持续刺激以达到治疗疾病的目的[15]。本研究通过前期文献检索发现目前国内外鲜有文章报道穴位埋线对PMOP调控机制机理的系统性研究。因此,本研究小组通过总结多年临床经验,提出基于“肾主骨”理论,通过穴位埋线对调节去势SD大鼠BMD、BMSCs、 ALP蛋白及TGF-β蛋白水平的调控机制,以求揭示穴位埋线治疗PMOP的分子调控机制。
其中,BMSCs作为骨髓基质的重要组成成分,是人体内成骨分化和骨形成的重要细胞来源,在体外也具有分化为成骨细胞的潜能。同时其作为成骨细胞(osteoblast,OB)的前体细胞,在骨的生长和重建过程中发挥主导作用[16]。当 BMSCs 出现定向分化功能异常时,成骨细胞减少,脂肪细胞增多,成脂、成骨分化失衡,最后引发骨质疏松。此外,碱性磷酸酶(ALP)作为骨代谢和骨形成的标志物,对成骨细胞凋亡有重要的分子作用机制,其活性的高低是BMSCs成骨细胞分化的重要指标之一[17]。BMSCs的成骨分化是多条信号调控通路共同参与的复杂过程。TGF-β作为主要信号通路之一,能够促进成纤维细胞转化成肌成纤维细胞,对上皮间质转化起到关键作用,进而促进成骨细胞分化,抑制其向脂肪细胞分化,通过调控BMSCs维持骨代谢平衡,提高骨密度,从而达到防治绝经后骨质疏松症的目的[18]。
本研究结果显示,模型组SD大鼠BMD、BMSCs、ALP蛋白及TGF-β蛋白水平含量均明显低于其他3组。当采取穴位埋线干预后,BMD、BMSCs、ALP蛋白及TGF-β蛋白水平与模型组相比有明显提高,推测其可有效提高BMSCs成骨细胞生成,减少破骨细胞,提高BMD,从而在骨的生长和重建过程中发挥主导作用。此外,ALP、TGF-β蛋白可参与调控BMSCs作用,达到维持平衡的骨代谢水平,从而达到防治和延缓绝经后骨质疏松症的目的。另外,穴位组和非穴位组相比,穴位组分子调控更好,证明了基于“肾主骨”理论的正确性,通过京门和肾俞穴位的刺激,对PMOP分子调控更具有靶向性。不过由于人力、物力等资源有限,本研究实验过程引起的BMSCs定向成骨诱导分化、信号通路相互交错干扰及个体化应用等问题只能作为下一步的研究重点进行研究。
