补体抑制剂治疗吉兰-巴雷综合征的研究进展
2022-04-21汪燕张绪利高峰冯勋刚
汪燕 张绪利 高峰 冯勋刚
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是一种发生于感染后、以周围神经脱髓鞘和轴索损伤为主的自身免疫性疾病,临床表现主要为急性四肢弛缓性瘫痪,伴或不伴有四肢末梢感觉障碍,可累及脑神经、呼吸肌[1]。目前通常认为空肠弯曲菌等通过其携带的抗原经分子模拟机制诱导人体产生自身免疫性抗体,后者特异性攻击周围神经髓鞘或轴索是GBS发病机制,并且这一过程依赖于补体(complement,C)系统的激活[2]。在GBS动物实验中,补体抑制剂可阻止周围神经进一步损伤;并且临床研究证明,补体抑制剂有效地缩短了GBS患者的恢复期[3-4]。自静脉注射免疫球蛋白和血浆置换用于GBS治疗之后GBS的免疫治疗并无新的突破。近年来,随着补体与GBS发病机制研究的不断深入,补体抑制剂治疗GBS成为研究热点。本文分析了补体在GBS发病中的作用,总结了补体抑制剂治疗GBS的研究进展,旨在为今后补体抑制剂的临床研究及其应用于GBS治疗提供参考。
1 补体系统及其介导GBS免疫损伤的作用机制
补体是存在于人体内血清及组织液中,由肝细胞、巨噬细胞及上皮细胞等多种细胞产生的多糖蛋白,包括可溶性蛋白、膜结合性蛋白和补体受体,故称为补体系统。补体系统是人体天然免疫系统重要组成部分之一,抗原抗体免疫复合物及微生物通过不同途径使其活化发生级联反应,介导免疫应答和炎症反应,有助于对抗病原体的入侵和调节免疫系统稳态[5]。补体系统参与机体免疫反应主要有三大通路,包括经典途径、旁路途径和凝集素途径,每个通路的启动因素各不相同,但是终端产物均为膜攻击复合物(membrane attack complex,MAC)[6]。补体系统的激活主要通过提高抗原的呈现和抗体的产生,招募巨噬细胞等免疫细胞,调节和增强吞噬作用从而介导免疫损伤[7]。研究表明,补体系统激活、MAC形成和巨噬细胞聚集介导了周围神经脱髓鞘和轴索损伤[1]。
1.1 补体系统
1.1.1经典途径:抗原抗体反应形成的免疫复合物沉积主要激活经典途径。在抗原抗体复合物的形成过程中,抗体Fc片段的补体结合位点暴露,C1q特异性识别并结合此位点引起其构象改变,导致C1r、C1s的激活[8]。激活的C1s随后依次激活C4、C2,使C4、C2分别裂解成C4a、C4b、C2a与C2b,其中C4b与C2a结合形成C3转化酶(C4b2a)。C3转化酶进一步激活C3使其裂解成C3a与C3b,并与C3b结合形成C5转化酶(C4b2a3b);C5转化酶激活C5使其裂解成C5a和C5b,最终C5b与C6、C7、C8和C9共同形成MAC(C5bC6C7C8C9)[9]。具体如图1所示。
1.1.2旁路途径:旁路途径通常保持持续的低水平激活状态。正常情况下,血清中C3可以自发水解形成C3b,但血清中的H因子、I因子和补体受体1等抑制因子,可以阻止旁路途径在正常情况下发生级联反应,维持稳定状态[7]。外源性物质及微生物在B因子、D因子及P因子(备解素)的参与下可进一步激活旁路途径,B因子与C3b结合后裂解为Ba和Bb,在D因子作用下,C3b与Bb形成不稳定的C3转化酶(C3bBb),C3bBb在P因子作用下形成可维持稳定状态的C5转换酶(C3bBbP),激活C5使其裂解形成C5a和C5b,C5b与C6、C7、C8和C9形成MAC[10]。具体如图1所示。
1.1.3凝集素途径:当细菌、病毒及真菌等病原体入侵人体时,血浆中甘露糖结合凝集素或纤维胶凝蛋白识别并结合病原体中特定的位点,可进一步激活甘露糖结合凝集素相关丝氨酸蛋白酶,引起C2和C4的活化及裂解,逐步形成C3转化酶(C4b2a)及C5转化酶(C4b2a3b),后者激活C5发生裂解生成C5b,C5b与C6、C7、C8和C9形成MAC[11]。具体如图1所示。
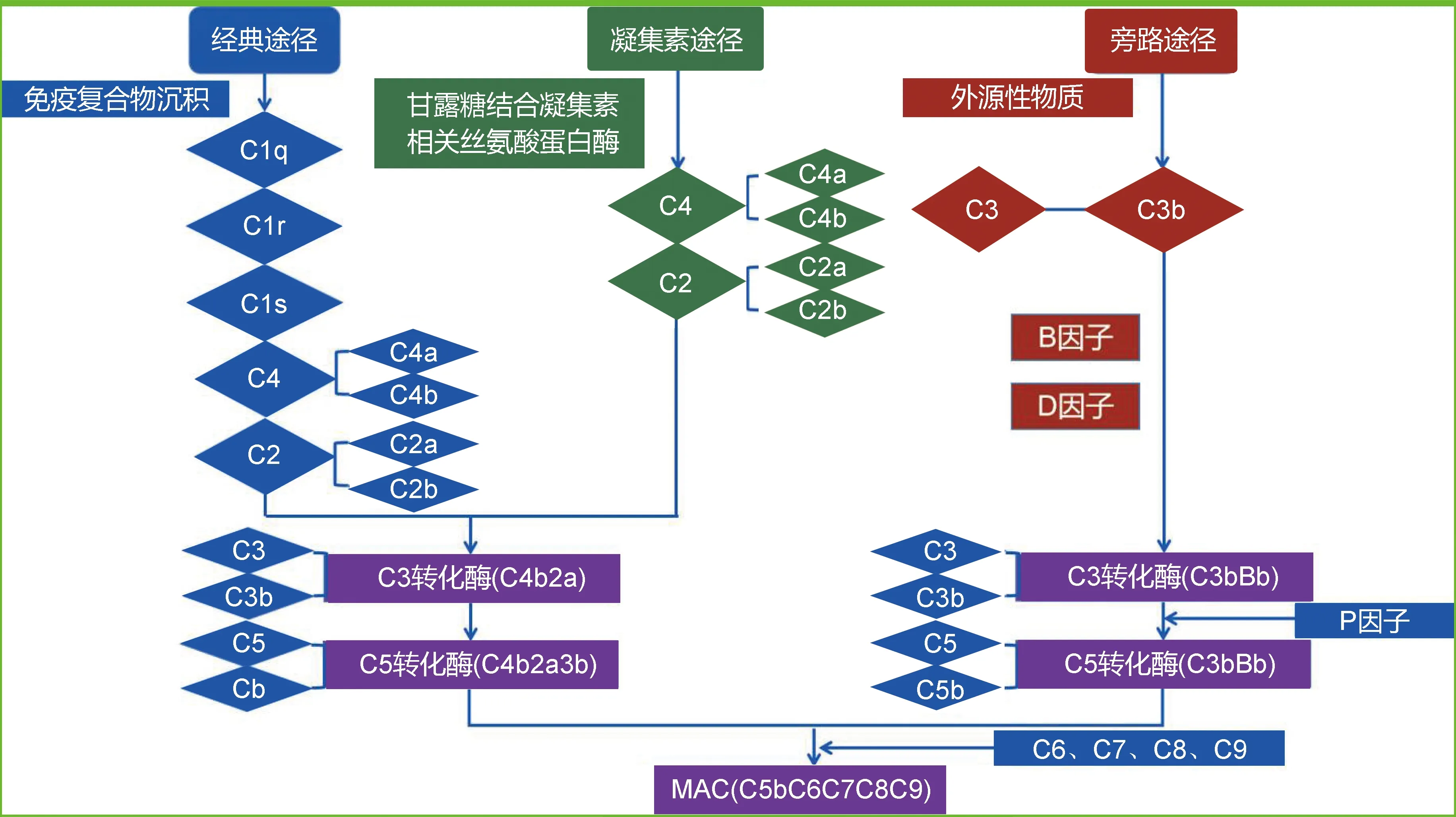
注:C:补体 图 1 补体系统的三条途径(经典途径、旁路途径和凝集素途径)示意图
1.2 补体系统介导GBS的免疫损伤基于病理机制,GBS主要分为脱髓鞘型和轴索型。脱髓鞘型主要包括急性炎性脱髓鞘性多发神经根神经病(acute inflammatory demyelinating polyneuropathy,AIDP),既往认为其发病机制主要与细胞免疫有关,然而随着AIDP相关的自身抗体不断被发现,认为体液免疫也参与其发生,因此周围神经脱髓鞘可能是在T细胞、补体、抗神经髓鞘抗体、炎症细胞及MAC等共同作用下发生的[12]。轴索型GBS主要包括急性运动轴索性神经病(acute motor axonal neuropathy,AMAN)和急性运动感觉轴索性神经病(acute motor sensory axonal neuropathy,AMSAN),目前认为其发病机制主要与体液免疫有关,人体感染空肠弯曲菌等病原体后,通过分子模拟机制诱导自身免疫性抗体产生,自身免疫性抗体特异性攻击周围神经轴索膜上的神经节苷脂,引起相应的轴索损伤[13]。Zhang等[14]在体外诱导神经元免疫损伤的实验中发现,体外抗神经节苷脂抗体介导的神经损伤依赖于补体系统的激活;Susuki等[15]发现,通过皮下注射含有GM1的牛脑神经节苷脂混合剂建立的AMAN家兔模型,其周围神经上的郎飞节区、结旁区、近结旁区及结间区均可有补体C3、IgG的沉积和MAC形成。临床尸检研究也发现,在GBS患者受损的轴索膜和施旺细胞膜上均有补体C3沉积和MAC形成;部分GBS患者血清和脑脊液中检测到补体激活产物水平升高,也证明了体内补体系统的激活参与了GBS发病的过程[13,16]。研究表明,补体系统在GBS中的作用主要包括以下几点:(1)在轴索型GBS中,自身抗体与郎飞节处的GM1、GD1a结合后可激活补体系统的经典途径,引起MAC形成而导致结旁区施旺细胞膜孔洞性破坏,使结旁区髓鞘部分脱失,巨噬细胞聚集并从髓鞘的受损处进入轴索周围间隙进而攻击轴索[17-18];(2)大部分GBS都有前驱感染史,细菌和病毒的入侵可能直接或间接激活补体系统的旁路途径和凝集素途径,导致免疫细胞的聚集和MAC的形成[19-20];(3)补体沉积可以引起周围神经的钠通道、施万细胞微绒毛、结旁区轴-胶连接和细胞骨架蛋白的破坏,影响神经冲动的发生、传导与维持[15]。因此,补体系统的激活是GBS发病的关键因素,抑制补体系统的激活有望成为新的GBS治疗方案,有利于改善GBS的预后。
2 补体抑制剂
补体抑制剂主要通过抑制补体级联反应,阻断MAC形成,进而减轻免疫损伤,改善自身免疫性疾病患者的预后[21]。补体抑制剂作为一种新的治疗方案,目前临床主要应用于阵发性睡眠性血红蛋白尿和重症肌无力等疾病治疗[22]。近年来,补体抑制剂不断用于GBS的治疗研究,从动物实验研究逐渐应用于临床试验,结果显示其对GBS治疗具有一定疗效。
2.1 依库丽单抗依库丽单抗是一种与补体C5具有高度亲和力的人源化单克隆抗体,可以阻止C5裂解为C5a和C5b,阻断生成MAC的级联反应。该药目前主要应用于阵发性睡眠性血红蛋白尿、非典型溶血性尿毒症综合征等疾病的治疗,也用于GBS患者临床试验性治疗。2008年,Halstead等[3]通过建立Miller-Fisher综合征小鼠模型并予依库丽单抗治疗,治疗后小鼠周围神经上未观察到有MAC沉积,并且小鼠运动神经末梢损伤减轻,呼吸肌麻痹发生率减少,表明依库丽单抗可减轻GBS部分免疫损伤。2017年,在一项随机、双盲、安慰剂对照的小样本量临床试验中,首次将依库丽单抗与IVIg联合治疗GBS患者,从临床研究上初步证明了依库丽单抗治疗GBS的安全性[23]。2018年一项日本临床研究发现,依库丽单抗治疗可以一定程度上加快重型GBS患者肌力恢复,当与静脉注射免疫球蛋白联合治疗时可能会增强免疫球蛋白疗效,并且对于不同亚型GBS,依库丽单抗疗效并无明显差异[4]。另有研究表明,依库丽单抗用于治疗GBS时有以下几点局限:(1)与仅接受传统免疫治疗的GBS患者相对比,接受依库丽单抗治疗的部分患者发生了过敏反应和脑脓肿[24];(2)依库丽单抗仅抑制了补体终端反应和MAC的形成,并不能消除早期补体激活产物的产生,这些产物会诱导免疫细胞聚集,可引起周围神经轴索免疫损伤或延迟恢复[24];(3)Yamaguchi等[25]发现约3%的日本人有C5突变,他们对依库丽单抗治疗具有耐药性。目前关于依库丽单抗治疗GBS相关临床研究的样本量较小,无法评估其具体疗效,因此今后尚需大样本量研究进一步证实。
2.2 甲磺酸萘莫司他甲磺酸萘莫司他是一种合成的丝氨酸蛋白酶抑制剂,其不仅对补体系统经典途径的C1r、C1s、C3转化酶和C5转化酶有选择性抑制作用,而且能有效抑制激活旁路途径的B因子和D因子。甲磺酸萘莫司他已经被批准用于临床治疗急性胰腺炎,由于其有抑制血小板聚集的功能,在日本也用于治疗弥散性血管内凝血,用于治疗GBS目前仅局限于动物实验,尚未有其治疗GBS患者的临床研究[21]。在AMAN兔模型中,与对照组比较,接受甲磺酸萘莫司他治疗的家兔脊神经前根上发生补体沉积和钠通道损伤的概率明显降低,因此推测该药主要通过抑制补体沉积,防止钠通道损伤以达到治疗GBS的作用;该研究还发现,在接受甲磺酸萘莫司他治疗的部分家兔肺部发现肉芽肿[26],然而在使用该药治疗的人类及其他动物身上尚未发现有肺部肉芽肿,因此认为这一药物不良反应可能与种属密切相关。
2.3 可溶性补体受体1(soluble complement receptor type 1,sCR1)sCR1是一种免疫清除分子,主要通过结合C3b和C4b抑制补体系统的经典途径和旁路途径,并间接促进这些因子的降解[27]。正常情况下,sCR1主要分布于红细胞、B淋巴细胞、巨噬细胞、小胶质细胞和施旺细胞等细胞膜表面。Vedeler等[28]发现 GBS患者血清及脑脊液中sCR1水平与对照组无明显差异,这表明在GBS发病过程中,炎症细胞没有或很少释放sCRl,或者释放的sCR1在补体介导的脱髓鞘和轴索变性过程中被消耗,因此认为外源性补充sCRl可用于治疗GBS。另有研究表明,sCR1可以减轻GBS大鼠模型脱髓鞘和轴索损伤的程度[29]。然而,由于缺乏相关临床试验研究,因此sCRl的临床疗效仍需进一步评估。
2.4 其他补体抑制剂C1抑制物属于天然的丝氨酸蛋白酶抑制剂,可抑制补体系统的所有通路,主要通过抑制经典途径的蛋白酶C1s、C1r和凝集素途径的甘露糖结合凝集素相关丝氨酸蛋白酶的活性,以及影响旁路途径调节因子的结合,导致通路无法进一步激活[30]。C1抑制物主要抑制补体系统激活的第一步反应,因此其不仅可以抑制MAC形成,而且可以阻止早期免疫细胞的聚集。目前C1抑制物主要用于遗传性血管神经性水肿、系统性红斑狼疮等疾病治疗[31-32],尚未在GBS动物模型及人体上进行实验,因此仍需大量研究证实。
APT070和rEV576是人工合成的一种新型蛋白多肽,对补体系统的经典途径和旁路途径均有抑制作用。APT070主要与补体成分C3相结合以抑制C3转化酶形成并加速其降解,从而发挥免疫治疗作用,在MFS小鼠模型中发现APT070可以阻止MAC形成,对神经末梢起到了保护作用[33-34]。加拿大一项药物研究发现,健康志愿者在规律使用APT070一段时间后仍对其耐受性良好[29]。rEV576可与补体成分C5结合并抑制C5的裂解,从而有效地阻断MAC形成[35]。研究表明,在MFS小鼠模型中rEV576可以抑制MAC形成,完全阻断抗体介导的运动神经末梢的损伤[36]。目前尚未有APT070和rEV576可用于GBS患者的治疗的报道,因此仍需要大量临床研究来探讨其对GBS患者的治疗作用。
综上所述,GBS是一种感染后自身免疫介导的周围神经病,目前认为补体系统激活可能是GBS发病的关键因素。近年来,补体抑制剂成为GBS免疫治疗研究的热点,在动物实验及临床研究上均证明了补体抑制剂可在一定程度上阻止周围神经损伤,改善GBS患者预后,有望成为GBS新的免疫治疗方案,但尚缺乏大样本量的临床研究,补体抑制剂的具体疗效及长期疗效仍需进一步证实。
