解毒消癥饮通过VEGF-C/VEGFR-3信号途径抑制肝癌淋巴管生成的机制研究
2022-04-21杨寓宁林明和曹治云
杨寓宁,鲁 琴,林明和,杜 建,曹治云*
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建省中西医结合老年性疾病重点实验室,福建 福州 350122)
肿瘤转移是肿瘤致死的重要原因,肿瘤初期的生长主要通过诱导血管新生来提供其所需要的营养,而肿瘤转移的主要途径是通过诱导的新生淋巴管进行[1]。血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达和分泌可作为刺激因子,启动血管内皮细胞和淋巴管内皮细胞相关信号通路,进而达到促血管新生和淋巴管生成的目的[2-4]。基质金属蛋白酶(matrix metalloproteinases,MMPs)通过降解细胞周围细胞外基质进而促进淋巴管细胞侵袭和迁移。由此可知血管内皮生长因子C(VEGF-C)/血管内皮生长因子受体3(VEGFR-3)通路及其下游MMPs在调节淋巴管的新生、重构和稳态中具有重要作用。解毒消癥饮(JXY)是清热解毒的中药验方,主要由白花蛇舌草、夏枯草、山慈姑、苦参4味中药组成。前期研究结果表明,JXY能够抑制移植瘤小鼠VEGF的表达[5];还可通过抑制肝癌细胞核内p300和CBP的表达,进而抑制其与低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)结合形成低氧诱导复合物,从而抑制VEGF的表达,最终下调肿瘤新生血管的生成[6]。基于JXY抗血管新生的作用及下调肝癌细胞表达VEGF-C的水平,本研究以VEGF-C/VEGFR-3为核心,进一步探讨JXY抗肝癌淋巴管新生的作用机制,为JXY的进一步临床应用提供理论依据。
1 实验材料
1.1 实验细胞 人淋巴管内皮细胞HLEC购自广州吉尼欧生物技术有限公司,人肝癌细胞株HepG2购自中国科学院上海生命科学研究院。
1.2 实验药物 JXY药物组成:白花蛇舌草、夏枯草、山慈菇、苦参,购自福建中医药大学国医堂。JXY经95%乙醇后,乙酸乙酯提取,水浴干燥后备用。JXY经DMSO溶解后制备成200 mg/mL的母液,超声助溶,采用常温PBS稀释成实验浓度。实验中所需要的外源性VEGF-C,按照说明书指示将其溶解于双蒸水,稀释后使浓度达到5 ng/mL,超声助溶后备用。
1.3 实验试剂 ECM培养基(美国ScienCell公司);高糖DMEM培养基(GIBCO公司);胎牛血清(FBS)、0.25%胰蛋白酶、磷酸盐缓冲液(PBS)(美国life technologies公司);青霉素-链霉素混合液(美国Thermo Fisher Scientific公司);MTT粉末(M8180)(江苏凯基生物技术股份有限公司);管腔形成试剂盒(德国Merck Millipore公司);VEGF-C、VEGFR-3、MMP-2、MMP-9抗体(美国CST公司);迁移小室(美国Corning公司);Hoechst 33258染色试剂盒(北京索莱宝科技有限公司)。
2 实验方法
2.1 细胞培养 将HLEC细胞株和HepG2细胞株分别置于ECM完全培养基和DMEM完全培养基中,放置于恒温箱内进行培养。当细胞汇合度达到70%~80%时,加入2 mL的胰蛋白酶消化2~3 min,随后加入4 mL完全培养基终止消化,1 000 r/min离心3min后,吸弃上清并收集沉淀细胞用于后续实验。
2.2 不同JXY浓度对细胞活力的影响 取对数生长期的细胞,以1×105/mL的密度接种于96孔板(100μL/孔),置于恒温箱中培养过夜,当汇合度达到50%~60%时,将细胞分为0、0.05、0.1、0.2 mg/mL组,每组设置6个复孔,分别予相应浓度JXY干预培养24 h。培养后于显微镜下观察不同药物浓度下细胞的生长状态和密度是否发生变化。拍照后吸弃培养液,加入100μL/孔的MTT,置于恒温箱内4 h,弃旧液加入100μL/孔DMSO。最后在酶标仪内570 nm波长的设置下检测OD值。

2.3 细胞分组 将细胞分为对照组、VEGF-C组、JXY低剂量组(简称低剂量组)、JXY中剂量组(简称中剂量组)、JXY高剂量组(简称高剂量组)。对照组每孔加入100μL ECM完全培养基,VEGF-C组予外源性因子VEGF-C(5 ng/mL)干预,低、中、高剂量组分别予VEGF-C(5 ng/mL)联合不同浓度JXY(0.05、0.1、0.2 mg/mL)进行干预,每组均干预24 h。
2.4 细胞形态观察 取对数生长期的HLEC细胞,按照1×105/mL的密度接种于6孔板中,当细胞平铺于板底60%左右时,按“2.3”项进行分组干预。24 h后分别放置于倒置显微镜下观察细胞生长状态及形态并拍照。
2.5 MTT检测细胞活力 取对数生长期的细胞,以1×105/mL的密度接种于96孔板,置于恒温箱中培养过夜,当汇合度达到50%~60%时,按“2.3”项进行分组干预,每组设置6个复孔。24 h后于显微镜下观察在不同药物浓度下细胞的生长状态和密度是否发生变化。拍照后吸弃培养液后加入100μL/孔的MTT,置于恒温箱内4 h,弃旧液加入100μL/孔DMSO。最后在酶标仪内570 nm波长的设置下检测吸光度值。
2.6 细胞凋亡实验 采用Hoechst 33258染色法观察细胞凋亡情况。取对数生长期的HLEC,按照1×105/mL的密度接种于6孔板,当细胞平铺于板底60%左右时,按“2.3”项进行分组干预,干预后吸弃并使用1×PBS清洗,使用10%福尔马林固定15 min,使用Hoechst 33258染色10 min(避光操作),随后用荧光显微镜拍摄。
2.7 细胞迁移实验 采用Transwell法检测细胞迁移能力。取对数生长期的HLEC,按照1×105/mL的密度接种于6孔板,当细胞平铺于板底60%左右时,按“2.3”项进行分组干预。干预后消化,空白ECM培养基重悬计数,将细胞稀释为2.5×105/mL,并于Transwell上室、下室分别添加200μL基础培养基和700μL ECM完全培养基,随后置于恒温培养箱孵育12 h。孵育后吸弃原培养基,使用10%福尔马林固定和结晶紫染色各15 min,双蒸水反复洗涤3次,用无尘纸擦拭干净上室的贴壁细胞,晾置干燥后,放置于倒置显微镜镜下拍照。
2.8 细胞划痕实验 应用划痕实验检测细胞迁移能力。取对数生长期的HLEC,按照2.5×105/mL的密度接入6孔板进行培养,汇合度达到80%左右时,用无菌枪头在6孔板底部划一痕迹,用PBS清洗3次,拍照。按“2.3”项进行分组干预,分别于6、12、24 h不同时间点进行拍照并测量。
2.9 细胞管腔形成实验 应用Tube Formation检测体外淋巴管生成情况。取对数生长期的HLEC细胞,按照1×105/mL的密度接入6孔板,当细胞平铺于板底60%左右时,按“2.3”项进行分组干预。干预后按照试剂盒说明书操作指示,于冷冻盒上配置基质胶150μL/孔平铺于48孔板内,置于恒温箱凝胶1 h。在此期间处理细胞,将细胞稀释为2×105/mL,按200μL/孔加入已放有基质胶的48孔板中,再放入恒温箱内孵育3 h,随后在显微镜下镜检观察并拍照。
2.10 Western blot法检测VEGFR-3、MMP-9、MMP-2蛋白表达 取对数生长期的HLEC和HepG2细胞,分别按照1×105/mL的密度接种于6 cm小皿中,当细胞平铺于板底60%左右时,将HepG2细胞分为0 mg/mL组和0.1 mg/mL组,0.1 mg/mL组予0.1 mg/mL JXY干预24 h,检测2组VEGF-C蛋白表达;HLEC细胞按“2.3”项进行分组干预,检测5组VEGFR-3、MMP-9、MMP-2蛋白表达。
2.11 统计学方法 采用SPSS 24.0软件包进行数据分析。计量资料符合正态分布的以(±s)表示;组间比较采用单因素方差分析。不符合正态分布以中位数和四分位数描述,组间比较采用非参数检验。
3 结果
3.1 不同浓度JXY对HepG2细胞活力和VEGF-C蛋白的影响 MMT法检测细胞活力结果显示,与对照组比较,JXY干预后各组细胞活力均有不同程度的下降,说明JXY对HepG2细胞活力有抑制作用,且呈现浓度依赖性(P<0.01,图1A)。Western Blot检测JXY(0 mg/mL、0.1 mg/mL)干预24 h后的HepG2细胞VEGF-C蛋白的表达,结果如图1B所示,同0 mg/mL组比较,0.1 mg/mL组的VEGF-C显著下调(P<0.01)。不同浓度JXY(0 mg/mL、0.05 mg/mL、0.1 mg/mL、0.2 mg/mL)干预后发现细胞数量随着JXY药物浓度的增加呈梯度减少,结果如图1C所示。
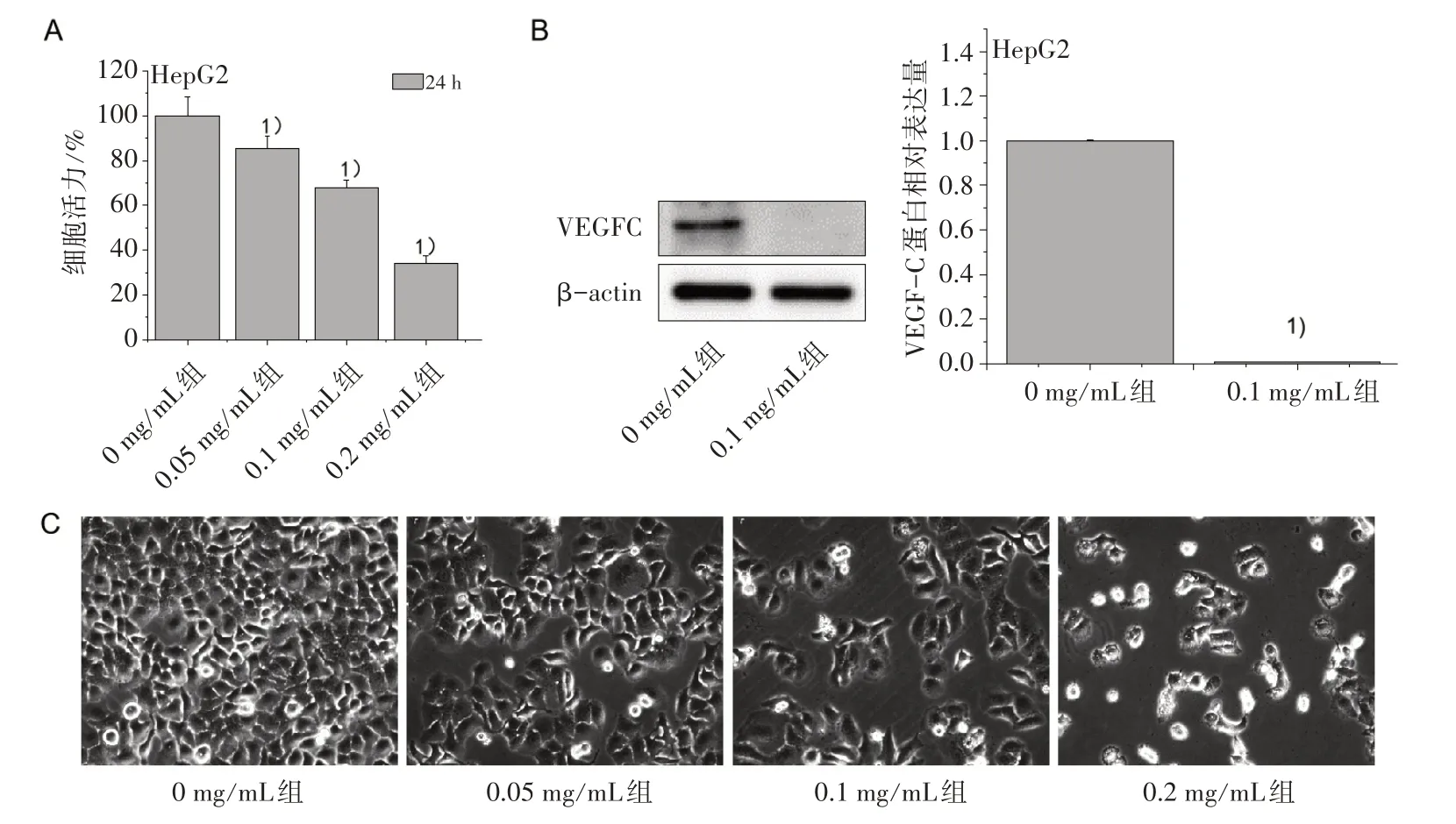
图1 不同浓度JXY对Hep G2细胞活力及VEGF-C蛋白表达的影响(×200)
3.2 5组HLEC细胞形态及活力情况比较 如图2所示,VEGF-C组与对照组比较,HLEC细胞生长形态正常,细胞密度显著增大,细胞活力增高。各剂量组细胞形态出现固缩,细胞数量随着JXY药物浓度的增加呈梯度减少,细胞活力呈剂量依赖性的降低。

图2 5组HLEC细胞形态及活力情况比较(×200)
3.3 5组HLEC细胞凋亡情况比较 如图3所示,对照组细胞呈现弱蓝色,有少许强荧光;VEGF-C组不仅细胞数量增加,还呈现出强荧光点减少,凋亡率与对照组比较明显降低(P<0.01);各剂量组细胞数量减少,染色强荧光增加,且呈现出浓度依赖性,凋亡率与VEGF-C组比较明显提高(P<0.01)。

图3 5组HLEC细胞凋亡情况比较(×200)
3.4 5组HLEC细胞迁移能力比较 如图4所示,VEGF-C组细胞迁移数目较对照组显著增加(P<0.01)。与模型组比较,各剂量组迁移率逐渐下降(P<0.01)。
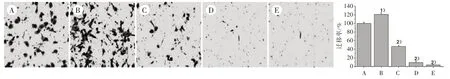
图4 5组HLEC细胞迁移能力比较(×200)
3.5 5组HLEC细胞损伤修复能力比较 如图5所示,JXY具有抑制HLEC损伤修复能力的作用。划痕24 h后,对照组HLEC细胞呈现出较好的迁移和自我损伤修复能力;VEGF-C组细胞的自我损伤修复能力较正常组有所提高。各剂量组细胞的迁移和损伤修复能力有所下降,且呈现浓度依赖性。
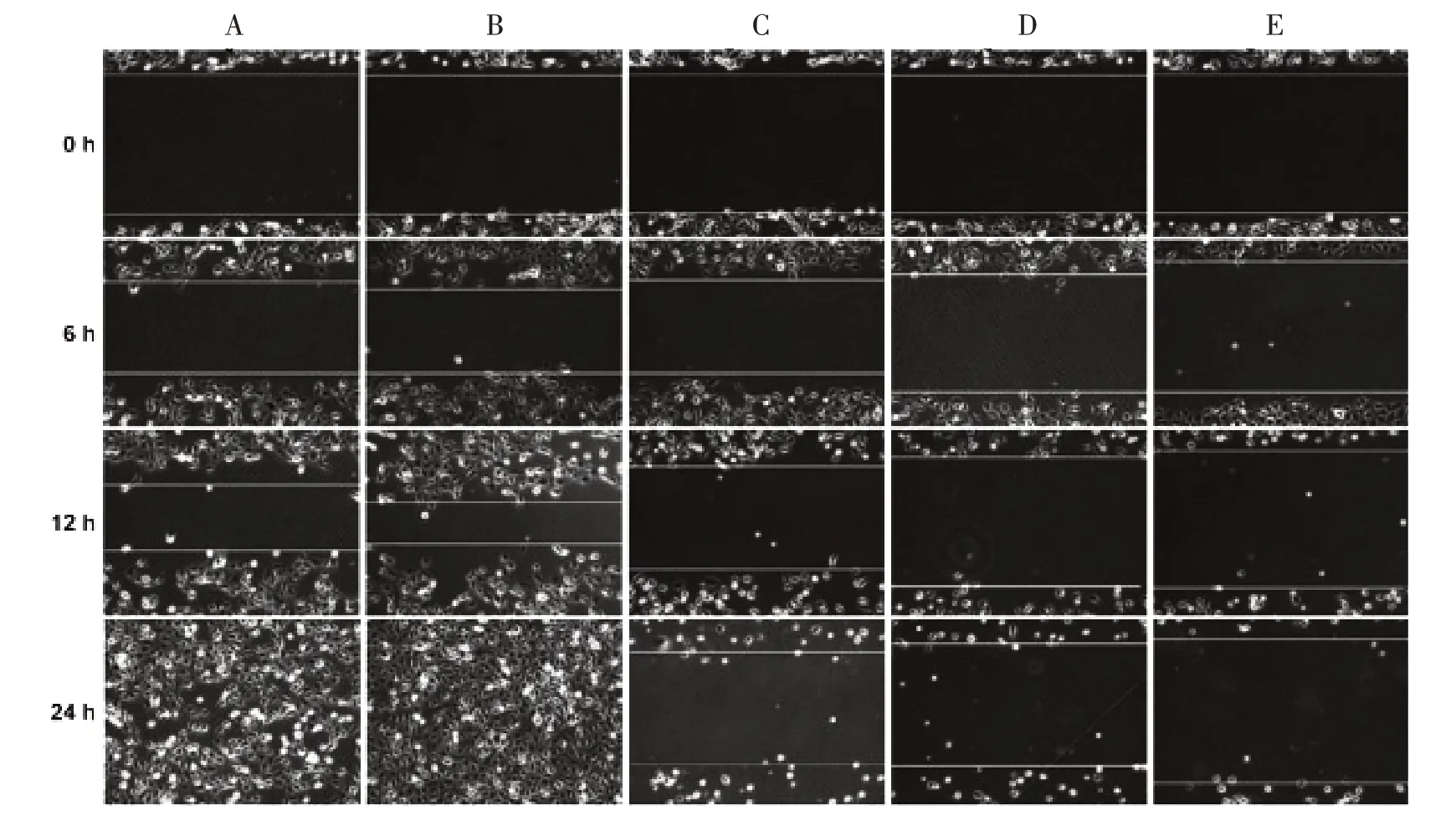
图5 5组HLEC细胞损伤修复能力比较(×100)
3.6 5组细胞淋巴管生成情况比较 与对照组比较,VEGF-C组淋巴管生成管腔结构更加完整,数目显著增加(P<0.01);各剂量组几乎不能形成管腔,与VEGF-C组比较,管腔形成数量差异具有统计学意义(P<0.01),见图6。

图6 5组细胞淋巴管生成情况比较(×100)
3.7 5组VEGFR-3、MMP-9、MMP-2蛋白表达比较 如图7所示,与对照组比较,VEGF-C组VEGFR-3、MMP-9、MMP-2蛋白表达水平明显升高(P<0.01);与VEGF-C组比较,各剂量组VEGFR-3、MMP-9、MMP-2蛋白表达明显下降(P<0.01),且呈现剂量依赖性。
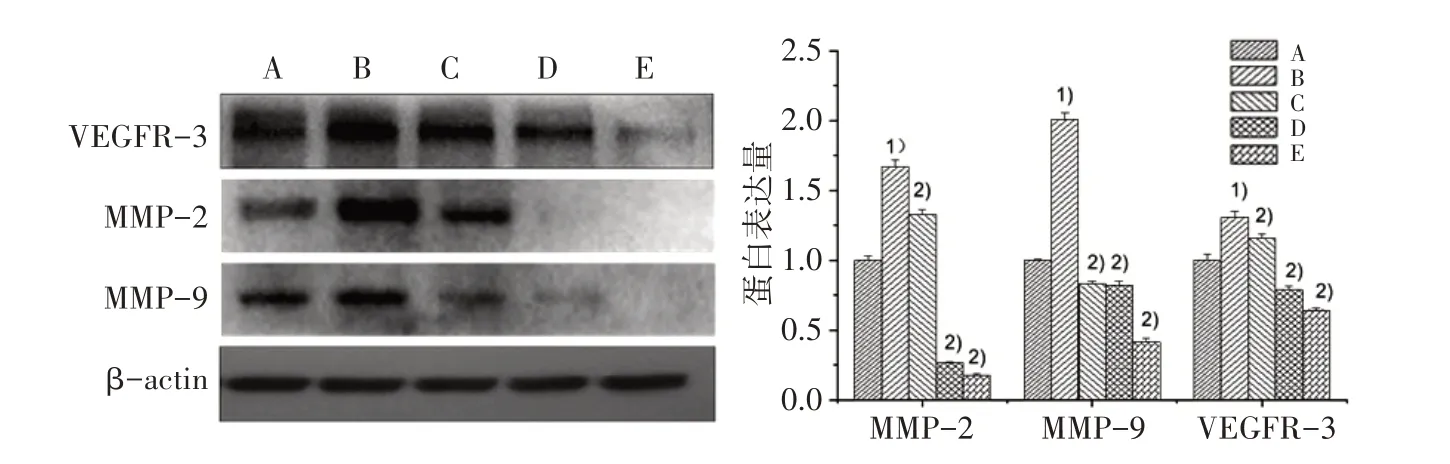
图7 5组VEGFR-3、MMP-9、MMP-2蛋白表达比较
4 讨论
淋巴管新生和重塑是肿瘤发生淋巴转移的主要方式之一,其为肿瘤细胞提供了进入区域淋巴结的主要通道。而肿瘤细胞通过新生淋巴管转移至淋巴结被视为肿瘤转移的预后指标,抑制肿瘤的淋巴管新生被认为是抑制肿瘤转移的有效方式,亦是肿瘤治疗的重要靶点[7]。VEGFs家族是肿瘤血管新生与淋巴管新生的重要调控因子,肿瘤细胞分泌的VEGF-C与HLEC细胞表面的特异性受体VEGFR-3结合后,激活丝氨酸/苏氨酸激酶AKT和ERK并使之入核,上调MMP-2、MMP-9的表达,以调控HLEC细胞的增殖和迁移,进而引起肿瘤转移[2]。MMP-2和MMP-9同时可诱导VEGF-A的表达,VEGF-A是目前最强的促肿瘤血管新生的细胞因子,其与血管内皮细胞特异性受体VEGFR-2结合后可增强血管通透性、促使细胞外基质变性、增强血管内皮细胞迁移、增殖和血管形成等,进而促进肿瘤的发展及转移[4,8-10]。前期研究已表明JXY具有通过调控VEGF-A及VEGFR-2的表达,从而抑制体内外肝癌血管新生的作用[11]。鉴于VEGF家族及其受体在肿瘤生长及转移中的核心调控作用,本研究进一步进行了JXY对肝癌淋巴管新生的影响研究,为模拟肿瘤微环境,以VEGF-C刺激的HLEC细胞为模型,经JXY干预后结果表明,JXY显著抑制了体外HLEC的淋巴管生成,同时显著下调了VEGFR-3和MMP-2、MMP-9的表达。
据报道,MMP-2和MMP-9能够通过激活特定的细胞受体和生长因子将靶细胞从细胞外基质中释放出来,从而调节细胞的增殖、凋亡和迁移[8]。同时,MMP-2和MMP-9可增强肿瘤细胞抵抗微环境中淋巴细胞对其诱导的凋亡。应用MMP-2和MMP-9的抑制剂与细胞因子TNF-α及TNF受体样凋亡诱导配体具有协同促凋亡作用,可增强化疗药物的细胞毒性[12-13]。
本研究表明JXY不仅抑制HLEC模型细胞MMP-2、MMP-9的表达,同时促进了HLEC细胞的凋亡,抑制了HLEC细胞的迁移,这可能与前期报道的JXY增强5-FU化疗效果有直接相关性。结合前期研究结果,JXY具有显著抑制VEGFs及其受体的作用,而VEGF家族在调控肿瘤血管新生及淋巴管新生中均起着核心作用,通过抑制其特异性受体的表达及对MMPs蛋白的调控,抑制了细胞外基质的变性及血管内皮细胞、HLEC细胞的增殖及迁移,诱导了凋亡,从而达到抑制肿瘤转移的目的。针对JXY抑制肿瘤转移的具体信号通路有待进一步阐明。
