苁蓉舒痉颗粒对帕金森病模型大鼠中脑线粒体氧化应激及自噬相关SIRT1/FoxO通路的影响
2022-04-21李茜羽姚淑红陈小倩陈诗雅袁明洲
李茜羽,姚淑红,陈小倩,陈诗雅,王 林,袁明洲,蔡 晶*
(1.福建中医药大学附属第三人民医院,福建 福州 350108;2.福建中医药大学中西医结合学院,福建 福州 350122)
帕金森病(Parkinson's disease,PD)是一种与衰老相关的神经系统退行性疾病[1]。PD发病机制复杂,涉及α-突触核蛋白积聚、神经炎症、氧化应激、线粒体功能障碍等多方面[1]。研究显示,线粒体结构与功能障碍是PD各致病因素分子机制的交汇点,过度氧化应激导致受损线粒体蓄积,而线粒体自噬异常无法将其清除,导致线粒体稳态破坏,神经元细胞受损,为近年研究热点[2]。沉默信息调节因子1(silent information regulator 1,SIRT1)为NAD+依赖性去乙酰化酶,通过调节叉头蛋白O(forkhead box protein O,FoxO)调节氧化应激及自噬等病理、生理过程,在包括PD在内的神经退行性疾病中起到神经保护作用[3-5]。课题组前期研究证实,苁蓉舒痉颗粒对PD大鼠具有神经保护作用[6-7],但其保护机制是否与改善氧化应激、调节线粒体自噬相关,尚待研究。本实验拟观察苁蓉舒痉颗粒对PD模型大鼠中脑线粒体氧化应激与自噬相关SIRT1/FoxO通路及相关指标的影响,为苁蓉舒痉颗粒进一步研究提供实验依据。
1 实验材料
1.1 实验动物 27只SPF级健康雄性SD大鼠,7~8周龄,体质量(200±20)g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(浙)2019-0002,实验动物使用许可证:SYXK(闽)2019-0007。饲养于福建中医药大学实验动物中心,温度20~26℃(日温差<3℃),相对湿度40%~70%,光照/黑暗周期为12 h,饮水摄食自由。
1.2 实验药物 苁蓉舒痉颗粒药物组成:肉苁蓉、制黄精、丹参、赤芍、牡丹皮,由福建中医药大学附属第三人民医院提供。蒸馏水溶化后滤过,制备溶液,4℃保存备用。
1.3 实验试剂 鱼藤酮、葵花油乳化液(美国Sigma公司,批号:R8875、S5007);水合氯醛(天津市大茂化学试剂厂,批号:3710);免疫组化试剂盒、DAB显色试剂盒(福建迈新技术有限公司,批号:KIT-5220、KIT-9720);ECL化学发光检测试剂盒、BCA试剂盒、GAPDH抗体、HRP标记的山羊抗兔IgG(武汉塞维尔生物科技有限公司,批号:G2014、G2026、G12002、GB23303);SIRT1抗体(美国Affinity公司,批号:DF6033);FoxO1抗体、FoxO3a抗体(美国Immunoway公司,批号:YT1758、YT1763);微管相关蛋白轻链3-Ⅰ(LC3-Ⅰ)、LC3-Ⅱ抗体(美国Proteintech公司,批号:18722-1-AP、18725-1-AP);βactin抗体、TH抗体(武汉三鹰生物技术有限公司,批号:10230-1-AP、25859-1-AP)。
1.4 实验仪器 TS100倒置显微镜(日本尼康公司);MDL光学显微镜、RM2235石蜡切片机(德国Leica公司);BT-2电泳仪(武汉塞维尔生物科技有限公司);PowerPac Basic转膜仪(美国Bio-Rad公司);6300化学发光仪(CLINX公司);RT-6100酶标仪(雷杜生命科学股份有限公司);CytoFLEX流式细胞仪(美国Beckman Coulter公司)。
2 实验方法
2.1 分组与造模 采用SPSS 24.0软件随机数字法将27只健康SD大鼠分为正常组9只、造模组18只。造模组大鼠按1.5 mg/(kg·d)予鱼藤酮葵花油乳化液进行颈背部皮下注射,连续注射14 d建立PD模型;正常组大鼠未予干预。参照文献[8]中行为学评分标准,得分2~8分即为造模成功。将造模成功SD大鼠随机分为模型组和治疗组,每组各9只。
2.2 干预与取材 苁蓉舒痉颗粒中剂量人用量为13.07 g/(60 kg·d),按人-大鼠体质量换算[9],治疗组按1.36 g/(kg·d)予苁蓉舒痉颗粒溶液灌胃,正常组、模型组予等量生理盐水灌胃,连续干预14 d。灌胃14 d后,每组各取3只大鼠进行灌注取脑;剩余大鼠全麻后快速断头,于冰面上迅速取出脑组织并分离中脑,保存于-80℃冰箱中备用。
2.3 观察指标及方法
2.3.1 行为学检测 分别于灌胃第1、7、14天对各组大鼠进行爬杆实验:手持鼠尾,令其倒立于50 cm长的木杆顶端,木杆外缠有医用胶布以增强摩擦,对小鼠下滑行为进行评分。具体评分标准:四肢并用,一次顺利从杆上爬下计0分;一步一步螺旋向下爬,兼后肢滑行计0.5分;上杆后间歇停顿数次后爬下,但可抱紧金属杆计1分;滑行后掉落计1.5分;不能抓杆,直接掉落计2分[10]。测3次取平均值,每次间隔5 min。若大鼠中途停止或反向爬行此次实验无效,重新进行。
2.3.2 免疫组化法检测大鼠中脑TH阳性细胞数
灌胃14 d后,各组取3只大鼠,用10%水合氯醛以3 mL/kg进行腹腔注射麻醉,麻醉后打开胸腔,灌注针插入左心室,剪开右心耳,灌注生理盐水(4℃)冲洗血液,以肝脏变白为灌注成功,至右心房流出的液体变清亮时,再灌注4%多聚甲醛溶液,灌注完成后仔细分离取出中脑组织,置于4%多聚甲醛溶液中固定24 h,流水冲洗2 h,依次进行70%、80%、90%、95%、100%乙醇梯度脱水、二甲苯透明、浸蜡、包埋切片。按试剂盒说明书对石蜡切片进行免疫组化染色,高倍镜下观察,以棕黄色或淡黄色颗粒染色为阳性表达,读取TH阳性反应细胞数。
2.3.3 ELISA法检测大鼠中脑SIRT1、FoxO1、FoxO3a水平 称取保存于-80℃冰箱中各组大鼠中脑组织50 mg,按1∶9比例加入9倍体积生理盐水,冰水浴条件下,机器匀浆,制备成10%匀浆液,2 500~3 000 r/min离心10 min,分别按照按SIRT1、FoxO1、FoxO3a试剂盒说明书进行操作。
2.3.4 Western blot法检测大鼠中脑SIRT1、FoxO1、FoxO3a、LC3-Ⅰ、LC3-Ⅱ蛋白表达 取-80℃冰箱中各组大鼠中脑组织50 mg,BCA法测定蛋白水平。SDS-PAGE凝胶电泳,PVDF转膜,脱脂奶粉室温封闭,加入GAPDH(1∶1 000)、SIRT1(1∶500)、FoxO1(1∶500)、FoxO3a(1∶500)、β-actin(1∶1 000)、LC3-Ⅰ(1∶500)、LC3-Ⅱ(1∶500)一抗,4℃孵育过夜。经PBS清洗后置于相应二抗(1∶3 000)室温孵育1 h,ECL试剂盒显影并成像,用Alpha软件处理系统分析蛋白条带灰度值,内参为GAPDH、β-actin,相对表达水平为目标蛋白条带灰度值/GAPDH或β-actin。
2.3.5 中脑活性氧(ROS)水平检测 取-80℃冰箱中各组大鼠中脑组织50 mg,PBS清洗后储存于预冷PBS(95%PBS+5%FBS)中。在培养皿中将中脑组织切成若干小块,用载玻片轻轻按压组织,PBS反复冲洗;将培养皿中的组织液用70目筛网过滤,收集过滤液离心(1 000 r/min),后用5 mL PBS清洗,再离心(1 000 r/min),将所得沉淀重悬,制备中脑黑质纹状体单细胞悬液。将所得单细胞悬液分为阳性对照管、阴性对照管和样品管。阳性对照管加1 mL DCFH-DA混合液+1μL活性氧供氢体;阴性对照管加1 mL PBS;样品管加1 mL DCFH-DA混合液,37℃避光孵育1 h,孵育完毕,离心(1 000 r/min)后弃上清,加400μL PBS重悬后,上机检测。所得结果用flowjo-V10流式分析软件进行ROS数据分析。
2.4 统计学方法 采用SPSS 24.0软件进行分析。对各组数据进行正态检验,用(±s)表示符合正态分布的计量资料,多组间比较进行单因素方差分析,行为学数据采用多变量方差分析;组间两两比较,方差齐采用LSD法,方差不齐则采用Game's Howell法。检验水准α=0.05。
3 结果
3.1 3组大鼠爬杆实验评分比较 与正常组比较,模型组大鼠灌胃第1、7、14天爬杆实验评分显著升高(P<0.01);与模型组比较,治疗组大鼠灌胃第14天爬杆实验评分显著降低(P<0.01)。见表1。
表1 3组大鼠爬杆实验评分比较(±s) 分

表1 3组大鼠爬杆实验评分比较(±s) 分
注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.01。
组别正常组模型组治疗组n999灌胃第1天0.00±0.00 1.33±0.261)1.17±0.451)灌胃第7天0.00±0.00 1.72±0.431)1.22±0.691)灌胃第14天0.00±0.00 2.00±0.001)0.61±0.562)
3.2 3组大鼠中脑TH阳性细胞数比较 显微镜下观察,模型组TH阳性细胞数较正常组减少,治疗组TH阳性细胞数较模型组增多,见图1。与正常组比较,模型组中脑TH阳性细胞数显著降低(P<0.01);与模型组比较,治疗组中脑TH阳性细胞数明显增多(P<0.05),见表2。
表2 3组大鼠中脑TH阳性细胞数比较(±s) 个

表2 3组大鼠中脑TH阳性细胞数比较(±s) 个
注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.05。
组别正常组模型组治疗组n333 TH阳性细胞数60.00±11.12 22.67±3.061)45.00±8.542)
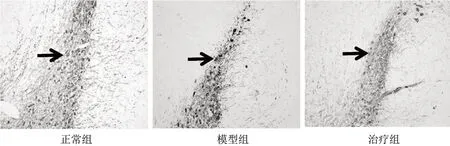
图1 3组大鼠中脑TH免疫组化图(×400)
3.3 3组大鼠中脑SIRT1、FoxO1、FoxO3a表达比较 ELISA及W estern blot检测结果显示,与正常组比较,模型组中脑SIRT1、FoxO1、FoxO3a含量显著降低(P<0.01)。与模型组比较,治疗组中脑SIRT1、FoxO3a、FoxO1表达升高(P<0.05,P<0.01)。见表3~4及图2。
表3 ELISA法检测3组大鼠中脑SIRT1、FoxO1、FoxO3a表达比较(n=3,±s)

表3 ELISA法检测3组大鼠中脑SIRT1、FoxO1、FoxO3a表达比较(n=3,±s)
注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.01,3)P<0.05。
组别正常组模型组治疗组SIRT1 0.69±0.04 0.43±0.041)0.56±0.053)FoxO1 0.75±0.02 0.36±0.031)0.53±0.042)FoxO3a 0.90±0.07 0.41±0.021)0.64±0.103)
表4 W estern blot法检测3组大鼠中脑SIRT1、FoxO1、FoxO3a蛋白表达比较(±s)

表4 W estern blot法检测3组大鼠中脑SIRT1、FoxO1、FoxO3a蛋白表达比较(±s)
注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.01,3)P<0.05。
组别正常组模型组治疗组SIRT1 1.23±0.12 0.61±0.071)0.92±0.143)FoxO1 1.16±0.07 0.23±0.031)0.82±0.082)FoxO3a 1.73±0.13 0.45±0.031)0.75±0.043)

图2 3组大鼠中脑SIRT1、FoxO1、FoxO3a蛋白电泳图
3.4 3组大鼠中脑LC3-Ⅰ、LC3-Ⅱ蛋白表达比较 与正常组比较,模型组中脑LC3-Ⅰ、LC3-Ⅱ蛋白表达均减少(P<0.05,P<0.01);与模型组比较,治疗组中脑LC3-Ⅱ蛋白表达均升高(P<0.05),见图3及表5。

图3 3组大鼠中脑LC3-Ⅰ、LC3-Ⅱ蛋白电泳图
表5 3组大鼠中脑LC3-Ⅰ、LC3-Ⅱ蛋白表达比较(±s)

表5 3组大鼠中脑LC3-Ⅰ、LC3-Ⅱ蛋白表达比较(±s)
注:与正常组比较,1)P<0.01,2)P<0.05;与模型组比较,3)P<0.05。
组别正常组模型组治疗组LC3-Ⅰ0.79±0.08 0.58±0.012)0.70±0.10 LC3-Ⅱ0.82±0.01 0.53±0.071)0.67±0.033)LC3-Ⅱ/LC3-Ⅰ1.04±0.13 0.91±0.10 0.97±0.12
3.5 3组大鼠中脑ROS水平比较 与正常组比较,模型组的细胞ROS水平显著增加(P<0.01);与模型组比较,治疗组的细胞ROS水平显著降低(P<0.01)。结果表明,苁蓉舒痉颗粒可降低PD大鼠氧化应激水平,见表6及图4。

图4 3组大鼠中脑ROS流式细胞图
表6 3组大鼠中脑ROS水平比较(±s)

表6 3组大鼠中脑ROS水平比较(±s)
注:与正常组比较,1)P<0.01;与模型组比较,2)P<0.01。
组别正常组模型组治疗组n333 ROS 75 935.33±1 367.74 195 866.33±7 381.451)170 912.67±3 036.592)
4 讨论
氧化应激致使胞内高水平活性氧产生,直接损害线粒体DNA(mitoc-hondrial DNA,mtDNA),导致线粒体受损及功能障碍。线粒体自噬障碍导致损伤的线粒体堆积,线粒体质量下降、线粒体稳态失衡,亦可导致ROS增加,发生恶性循环,与PD发病相关[11-15]。
中药可以通过促进线粒体自噬、改善氧化应激水平起到神经保护作用,在预防PD方面有较好的应用前景[16-17]。中医理论认为,PD发病属本虚标实,肝肾亏损为本,风、火、痰、瘀为标。肾精亏虚,不能上充于脑,脑髓失养;肝肾不足,虚风内动;PD病久,瘀血阻络。故而,肾虚血瘀是PD最根本的病理基础,应以补肾活血为其治疗法则[18-20]。本研究干预手段为补肾活血中药苁蓉舒痉颗粒,方中君药肉苁蓉,具有补肾阳、益精血的作用;臣药制黄精滋阴补肾,与肉苁蓉配伍具阴阳双补之功;丹参、赤芍、牡丹皮清热凉血、活血散瘀。诸药配伍共奏补肾填精、益髓健脑、活血凉肝之功效。结果显示其改善PD大鼠行为学障碍、提高中脑TH阳性细胞数量,提示出苁蓉舒痉颗粒对中脑神经元细胞具有一定的保护作用。
ROS累积与氧化应激损伤相关[21];LC3是自噬中重要标记蛋白,LC3-Ⅱ是由LC3-Ⅰ通过泛素样反应后与磷脂酰乙醇胺耦联而生成,其表达的高低与自噬水平正相关[22]。本研究实验结果显示,在PD大鼠模型中存在ROS水平升高,LC3-Ⅱ及LC3-Ⅰ表达降低,经干预后ROS水平降低、LC3-Ⅱ表达升高,证实氧化应激、线粒体自噬障碍参与了PD的发病,苁蓉舒痉颗粒可通过改善PD大鼠氧化应激、增加线粒体自噬起到神经元保护作用。
SIRT1/FoxO1、SIRT1/FoxO3a通路在PD氧化应激及自噬调节中具有重要作用[4]。中国的一个横断面研究显示,PD患者血清SIRT1水平降低[23]。基础研究发现,SIRT1激活剂显著降低线粒体氧化应激和mtDNA损伤,其通过去乙酰化激活FoxO1、FoxO3a参与线粒体氧化应激和mtDNA损伤修复,同时SIRT1过表达纠正了自噬缺陷[4-5],减少α-突触核蛋白的形成,在帕金森病中起到神经保护作用[24]。本研究中,模型组SIRT1、FoxO1、FoxO3a水平降低,治疗组模型组SIRT1、FoxO1、FoxO3a水平升高,说明苁蓉舒痉颗粒改善PD大鼠氧化应激、增加线粒体自噬的作用可能与SIRT1/FoxO通路相关。
综上,苁蓉舒痉颗粒神经保护作用可能是通过促进SIRT1/FoxO1、SIRT1/FoxO3a、LC3-Ⅱ、LC3-Ⅰ表达,降低ROS水平,抑制氧化应激与激活自噬来实现的。本研究缺乏不同剂量苁蓉舒痉颗粒的选择验证,未将治疗效果与剂量关系展现出来。今后将进一步探讨苁蓉舒痉颗粒调控线粒体氧化应激与自噬的具体机制,以期为苁蓉舒痉颗粒的临床应用提供更多实验参考。
