鸡Tgfβ1干扰表达载体的构建及在MDCC-MSB1细胞中的干扰表达
2022-04-20门凯凯刘佳隆郭亚格余祖华
门凯凯, 刘佳隆, 郭亚格, 张 瑾, 余祖华
(河南科技大学 动物疫病与公共卫生重点实验室,河南 洛阳 471023)
0 引言
近年来,鸡肿瘤性疾病的发病率越来越高,鸡肿瘤性疾病的多变性、高发性已经给养禽业造成巨大的威胁[1-2]。鸡马立克病(Marek’s disease, MD)是由隶属于强致病性α疱疹病毒的马立克病毒(Marek’s disease virus, MDV)感染鸡后引起的,可在鸡体内迅速诱发恶性T细胞淋巴瘤,给养禽业带来了巨大损失,因此,研究其发病机制是必要的。转化生长因子β(transforming growth factor-β,Tgfβ)是一种多功能细胞因子,通过细胞表面受体信号转导参与许多疾病的病理生理过程,其表达量变化与肿瘤疾病有着密切联系[3-5]。Tgfβ1作为Tgfβ的一个亚型,在调节免疫细胞分化、维持免疫细胞功能和免疫稳态中起着重要作用,是肿瘤细胞中最常见的上调因子[6-9],在肿瘤发生发展中发挥重要的致癌或抑癌功能[10],且Tgfβ1信号通路分子对肿瘤的调控作用是目前学术界研究热点之一,但关于鸡Tgfβ1在鸡MD肿瘤发生发展中的作用及其机制有待深入研究。据此,本研究构建了鸡Tgfβ1的干扰表达载体,将其转染MDV转化的肿瘤细胞系MDCC-MSB1并鉴定抑制表达效果,为后续研究鸡Tgfβ1在MD肿瘤发生发展中的作用及调控机制提供基础材料。
1 材料与方法
1.1 材料
MDV转化的肿瘤细胞系MDCC-MSB1、pG1.2载体、DH5α感受态均由河南科技大学动物疫病与公共卫生实验室保存;质粒提取试剂盒购于北京天根生化有限公司;限制性内切酶BsaI(RO535V)、SacI(ER1135)分别购于NEB和Thermo Scientific公司;反转录试剂盒(RR047A)、SYBR Green Master Mix(RR420)购于Taraka公司;Lipofectamine2000试剂、Opti-MEM培养基购于美国Invitrogen公司;Trizol试剂购于GenStar公司;RIPI裂解液、Bradford蛋白浓度测定试剂盒购于Servicebio公司;兔抗鸡TGFβ1抗体(aa260-373)购自美国LifeSpan公司,HRP-羊抗兔二抗(ab6721)、小鼠抗β-actin(ab8226)购自美国Abcam公司;HRP-羊抗鼠二抗(SA00001-1)购自Proteintech公司。
1.2 方法
1.2.1 鸡Tgfβ1基因靶向短发夹核糖核酸序列的设计与合成
根据GenBank检索的鸡Tgfβ1基因全序列(NM-001318456.1)以及短发夹核糖核酸(short hairpin ribonucleic acid, shRNA)的设计原则,确定目标基因,设计出3条shRNA寡核苷酸序列。确定目标基因序列分别为Gallus-Tgfβ1-1:GCATCTTCTTCGTGTTCAA(位于Tgfβ1mRNA 110~168);Gallus-Tgfβ1-2:GCATCTCCATCGAAGGCTT(位于Tgfβ1mRNA 109~167);Gallus-Tgfβ1-3:CCACGAACCCAAAGGTTAT(位于Tgfβ1mRNA 106~163)。再按序列结构:BsaI+Sense+Loop+Antisense+终止信号+SacI+BsaI设计鸡Tgfβ1的shRNA链(见表1),送往生工生物工程(上海)股份有限公司合成。

表1 Tgfβ1 shRNA基因片段序列及靶点
1.2.2 实时荧光定量聚合酶链式反应引物的设计与合成
根据GenBank检索的Tgfβ1mRNA基因全序列(NM-001318456.1)和鸡GAPDH全序列(NC-052532.1),分别设计鸡Tgfβ1和鸡GAPDH荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qRT-PCR)引物序列(见表2),由生工生物工程(上海)股份有限公司合成。
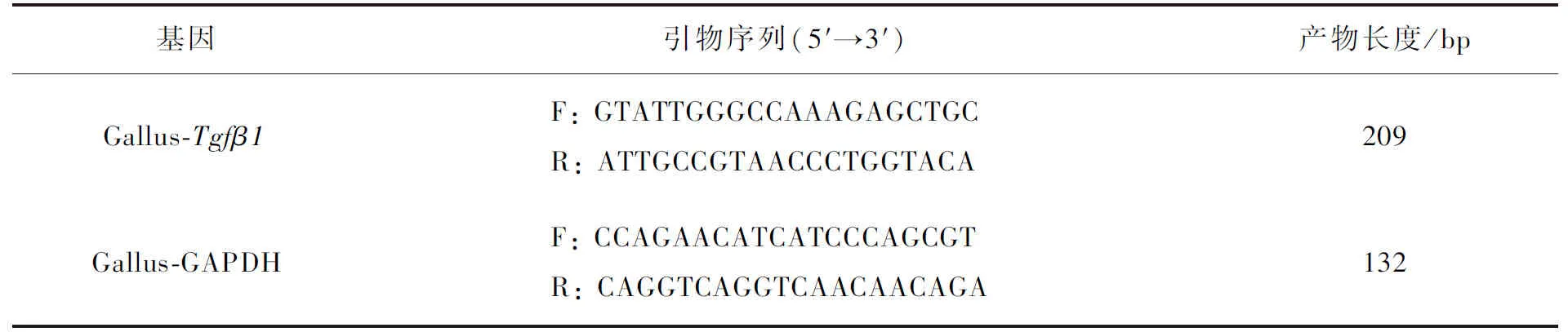
表2 荧光定量PCR引物
1.2.3Tgfβ1干扰表达载体的构建与鉴定
每个单链基因片段用30 μL annealing buffer溶解,得到上游2 μL +下游2 μL + 16 μL annealing buffer,94 ℃退火,室温冷却,100倍稀释退火产物。BsaI酶切pG-1.2质粒,酶切体系:pG1.2质粒2 μg,BsaI 2 μL,CutSmart 4 μL,补ddH2O至40 μL,37 ℃酶切过夜。回收1%(质量分数)琼脂糖凝胶电泳大片段与退火片段连接。稀释的退火片段1 μL,质粒载体线性化大片段1 μL,5×Ligase Buffer 2 μL,T4 DNA Ligase 1 μL,ddH2O补至10 μL,22 ℃反应过夜。各取10 μL连接产物转化至感受态细胞DH5α,分别涂布于含卡那霉素抗性(50 μg/mL) LB平板上,37 ℃恒温培养过夜。从耐卡那霉素(50 μg/mL) LB平板中挑选单克隆菌落,接种于5 mL耐卡那霉素LB培养基中,37 ℃恒温(180 r/min)过夜。试剂盒提取质粒,经SacI酶切鉴定正确的质粒送测序。
1.2.4 MDCC-MSB1培养与Tgfβ1干扰表达载体的转染
MDCC-MSB1细胞在10%(体积分数)胎牛血清RIPM1640培养基中,于37 ℃、5% CO2培养箱培养。以每孔1×106个在对数生长期状态好的MDCC-MSB1细胞接种于6孔板。转染共分成3组,每组分别为重组质粒及相应的pG1.2空载,即pG1.2-Tgfβ1shRNA-1和干扰NC-1组、pG1.2-Tgfβ1shRNA-2和干扰NC-2组、pG1.2-Tgfβ1shRNA-3和干扰NC-3组,每组3个复孔。转染前2 h,细胞培养液换成无血清1640培养基。质粒在100 μL opti-MEM培养基稀释;以质粒∶Lipofectamine2 000转染试剂=1 μg∶2 μL比例配制opti-MEM培养基-脂质体复合物100 μL,室温静置5 min。将两液混合均匀静置20 min后加入6孔板MDCC-MSB1细胞内轻轻混匀。
1.2.5 实时荧光定量PCR检测Tgfβ1mRNA表达
Trizol法提取转染48 h各组细胞总RNA,逆转录试剂盒将RNA反转录成互补脱氧核糖核酸(complementary deoxyribonucleic acid, cDNA),用cDNA做SYBR Green Master Mix qRT-PCR的体系:TB GreenPremix DimerEraser 10 μL、PCR Forward Primer 0.4 μL、PCR Reverse Primer 0.4 μL、Template 2 μL、ddH2O补至20 μL。反应条件:95 ℃预变性30 s,95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,共40循环。GAPDH为内参,2-ΔΔCt法计算各组Tgfβ1mRNA相对表达量,根据相对表达量筛选出抑制率最高的干扰表达载体。
1.2.6 Western blot法检测TGFβ1蛋白表达
用抑制率最高的干扰表达载体pG1.2-Tgfβ1shRNA-1转染MDCC-MSB1细胞,Bradford蛋白浓度测定试剂盒测定提取的48 h各组细胞蛋白浓度,加样量为每样50 μg,加5×SDS上样缓冲液,沸水煮10 min。经5%(质量分数)浓缩胶和10%(质量分数)分离胶SDS-PAGE电泳,将蛋白转移至0.22 μm 聚偏氟乙烯膜,用含4%(质量分数)牛血清白蛋白(bovine serum albumin, BSA)的TBST液4 ℃封闭2 h,用4% BSA的TBST液稀释兔抗鸡TGFβ1(1∶500)或小鼠单抗β-actin(1∶1 000),4 ℃孵育过夜,第2天加入相应的HRP标记二抗4 ℃孵育3 h,超敏增强化学发光(enhanced chemiluminescence, ECL)法显色。
1.2.7 统计学方法
SPSS20.0统计学软件单因素方差分析或t-test分析数据,P<0.05为差异显著,用*表示;P<0.01为差异极显著,用**表示。
2 结果
2.1 鸡Tgfβ1 干扰表达载体的酶切和测序鉴定
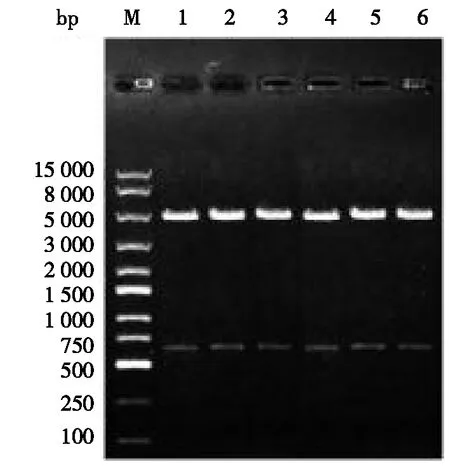
M.marker;1,2.PG1.2-Tgfβ1 shRNA-1;3,4.PG1.2-Tgfβ1 shRNA-2;5,6.PG1.2-Tgfβ1 shRNA-3。 图1 PG1.2-Tgfβ1 shRNA酶切鉴定
pG1.2载体带有一个SacⅠ酶切位点,再根据pG1.2载体序列,引入SacⅠ位点设计鸡Tgfβ1的干扰表达片段。提取阳性质粒被SacⅠ酶切出一条约600 bp条带,即表明退火片段连接到pG1.2载体。PG1.2-Tgfβ1shRNA酶切鉴定见图1。由图1可知:SacⅠ酶切阳性重组质粒后,电泳结果显示各质粒均有一条大小约600 bp的条带。测序结果比对显示,测序结果与原设定序列完全一致,结果表明设计合成的各shRNA片段均成功插入pG1.2载体,成功构建了鸡Tgfβ1的干扰表达质粒,分别为PG1.2-Tgfβ1shRNA-1、PG1.2-Tgfβ1shRNA-2和PG1.2-Tgfβ1shRNA-3。
2.2 靶向鸡Tgfβ1的干扰片段筛选
按照转染试剂Lipofectamine2000和Tgfβ1干扰载体2 μL∶1 μg的比例,将构建的PG1.2-Tgfβ1shRNA-1、PG1.2-Tgfβ1shRNA-2、PG1.2-Tgfβ1shRNA-3质粒和各自空载PG1.2载体分别转染MDCC-MSB1细胞,48 h后提取各组细胞总RNA,qRT-PCR检测Tgfβ1相对表达量,分析比较其抑制效果。Tgfβ1干扰载体mRNA水平抑制效果见图2。由图2可知:构建的针对鸡Tgfβ1mRNA不同靶位点的3个干扰载体均有显著的抑制效果,其抑制率分别为74.43%、66.97%和73.44%。
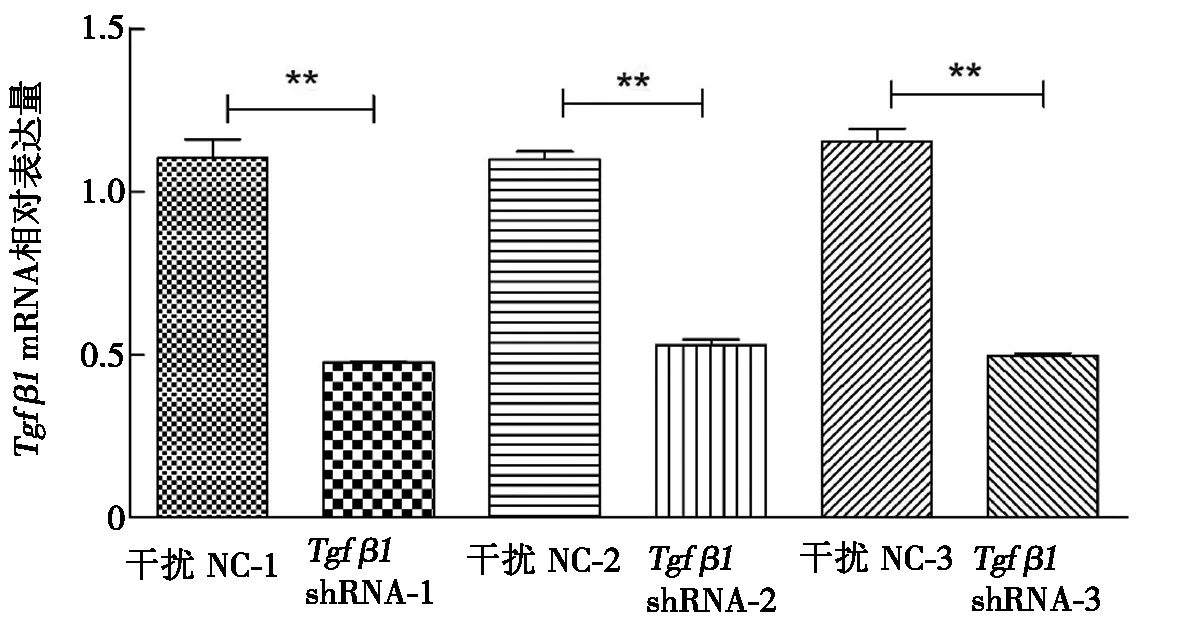
图2 Tgfβ1 干扰载体mRNA水平抑制效果
2.3 干扰表达载体对MDCC-MSB1细胞内鸡TGFβ1蛋白表达的干扰效果
用抑制率最高的干扰载体PG1.2-Tgfβ1shRNA-1转染MDCC-MSB1细胞,转染48 h后荧光显微镜下观察PG1.2-Tgfβ1shRNA-1组和PG1.2干扰NC组MDCC-MSB1均有荧光(见图3a和图3b),空白对照组无荧光(见图3c)。48 h提取细胞总蛋白,Western blot检测TGFβ1蛋白表达量(见图4a)并进行蛋白条带的灰度值分析(见图4b)。图4b中,纵坐标为目的蛋白TGFβ1灰度值与内参β-actin灰度值的比值。与空白组相比,PG1.2-Tgfβ1shRNA-1组细胞内TGFβ1蛋白表达量显著下降(P<0.05),PG1.2干扰NC组细胞内TGFβ1蛋白表达量无显著差异(P>0.05)。

(a) PG1.2-Tgfβ1 shRNA转染的MSB1细胞 (b) PG1.2干扰NC转染的MSB1细胞 (c) 阴性对照(无转染的MSB1细胞)
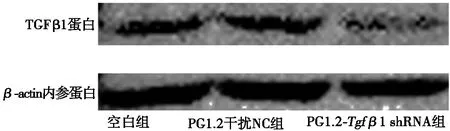
(a) TGFβ1蛋白、β-actin内参蛋白Western blot
3 讨论
近年来,随着对肿瘤发病机制的不断深入了解和研究,人们越来越清楚地认识到肿瘤疾病的发生涉及各方面的因素,并且在发展中牵涉更多步骤的病理过程[11-12]。肿瘤疾病的发病机制之所以是复杂的,是因为其在发生发展过程中涉及Tgfβ1/Smad等多条信号传导通路及多种细胞因子,这些信号通路和细胞因子共同构成复杂的调控网络[13-14]。Tgfβ1作为众多信号分子中的一员,调节着多细胞生物生理发育的各个方面,由于其在动物界的高度保守性,使其在众多信号分子中脱颖而出,与其相关的信号通路被深入研究。Tgfβ1信号通路在许多类型的肿瘤中发挥作用,其通路发挥作用的机制被越来越多的学者研究,并取得了一定的研究成果,文献[15]提出miR-130a-3p靶向GCNT4并激活Tgfβ1/Smad3信号通路,可促进胃癌细胞生长。文献[16]证明参皂苷Rg2通过调节Tgfβ1/Smad信号通路减轻心肌纤维化,从而改善心功能损害。Tgfβ1信号通路在肿瘤的发生发展中起到重要作用,Tgfβ1主要是通过跨膜丝氨酸-苏氨酸激酶受体TgfβR1参与肿瘤调控,在肿瘤的发生过程中Tgfβ1主要通过组织微环境Smad和非Smad通路促进或抑制肿瘤发生[17]。在肿瘤的发生、发展过程中,Tgfβ1表现出不同的作用,Tgfβ1信号通路在肿瘤早期抑制肿瘤细胞的增殖,并将细胞阻止于G1期[18-19]。随着肿瘤的发展,肿瘤细胞逃避发生突变的Tgfβ1信号通路介导的生长抑制效应,肿瘤细胞大量增殖[20]。Tgfβ1既是一种抑制因子又是一种启动子,这种双重作用的机制尚不清楚,但在Tgfβ1/Smad信号通路中任何一部分的中断或缺失,都会导致该通路的抑瘤作用减弱,进而促进了肿瘤的发展。文献[21]阐明调控Tgfβ1/Smad4通路可对宫颈癌SiHa细胞自噬关键基因Lc3产生影响,从而调控宫颈癌SiHa细胞的生物学特性。Tgfβ1/Smad信号通路的改变对其下游基因表达的影响,是其调控各种疾病更为关键的步骤,这种通路机制成为学术界研究的热点,研究Tgfβ1及其信号通路在肿瘤发生中的作用及机制对肿瘤的有效防控具有十分重要的意义[22]。Tgfβ1信号通路在其他肿瘤疾病被深入研究,但在鸡肿瘤疾病的作用及机制还有待深入研究,本研究基于Tgfβ1在肿瘤细胞的这种重要作用,通过构建鸡Tgfβ1干扰表达载体,初步探索构建的干扰表达重组质粒对MDCC-MSB1细胞中Tgfβ1表达量的影响,为进一步研究Tgfβ1在MD肿瘤发生中的作用及机制奠定基础。
RNA干扰技术介导细胞内特异靶基因表达沉默,使相应的功能表型出现缺失现象[23],文献[24]在胰腺癌中观察到通过微小核糖核酸对ANLN基因的下调,抑制了细胞的侵袭性。以Tgfβ1为靶目标,RNA干扰技术为研究Tgfβ1功能及其在肿瘤性疾病中的调控机制提供了新维度。本研究根据鸡Tgfβ1基因序列和shRNA设计原则设计了3个shRNA序列,通过基因重组技术将shRNA克隆入载体,构建pG1.2-Tgfβ1shRNA重组表达质粒。酶切和测序证实3种重组质粒插入序列与设计靶基因片段一致。用构建成功的3种重组质粒转染MDCC-MSB1细胞,48 h后提取各组细胞总RNA,进行qRT-qPCR检测Tgfβ1的表达量变化,结果显示构建的3种干扰表达质粒转染细胞后,对细胞内Tgfβ1 mRNA的表达量均有不同程度的抑制,其抑制率最高可达70%以上。筛选抑制效率最高的干扰表达重组质粒pG1.2-Tgfβ1shRNA-1转染MDCC-MSB1细胞,于转染后48 h提取细胞总蛋白,Western blot法检测结果显示转染干扰表达重组质粒pG1.2-Tgfβ1shRNA-1后,TGFβ1蛋白表达量显著降低。因此,本研究成功构建了pG1.2-Tgfβ1shRNA干扰表达载体,且其可以干扰MDCC-MSB1细胞中Tgfβ1的表达,为后续进一步探索Tgfβ1及其调控的关键分子在MD肿瘤发生中的作用奠定基础。
