外源铁对水稻累积土壤镉的影响
2022-04-20孙星星陶润萍熊慧欣徐轶群
孙星星, 朱 靖, 陶润萍, 熊慧欣, 徐轶群
(扬州大学环境科学与工程学院, 江苏 扬州 225100)
化肥农药施用、废水灌溉、电镀、采矿和冶炼等生产活动容易使农田受到镉污染[1].镉在土壤和植物中表现出较高的迁移性[2],易在部分植物中累积.如镉易被水稻吸收,并在稻米中累积,进而通过食物链进入人体,对人类健康造成潜在威胁[3].因此,降低水稻中镉的累积量对于减少人体镉暴露具有重要意义.
降低稻米中镉含量的措施主要包括客土法、深翻法、采用钝化改良剂以及植物修复等.以上方法存在修复时间长或处理费用高等问题,难以经济有效地解决镉污染土壤中稻米镉超标的问题.近年来, 农艺调控措施因处理费用低、二次污染小等特点而受到关注.如研究发现持续淹水可降低污染土壤中水稻的镉累积含量[4-5].此外, 铁肥被广泛施用以提高水稻发育不良地区的粮食产量[6],但外源铁的添加可能有效降低或提高水稻籽粒中镉的累积量[7-8], 铁肥的施用对水稻中镉含量的影响尚不明确,特别是在持续淹水条件下铁肥的施用对水稻镉累积的影响缺乏相关研究.同时,水分对镉的迁移转化也具有重要影响[9], 而以往的研究没有考虑水稻生长的水分管理条件.因此,本研究拟采用盆栽实验,选取硫酸亚铁和氯化亚铁作为外源铁,探究持续淹水条件下外源铁对水稻中镉累积量的影响,以期为镉污染土壤中水稻种植以及稻米镉含量的控制提供科学依据.
1 材料与方法
1.1 实验土壤
实验水稻品种为南粳9108.实验土壤取自扬州市广陵区某稻田耕作层深度为0~20 cm的表层土壤, 去除大块杂质,于自然风干后研磨, 过2 000 μm尼龙筛后用于盆栽实验, 另一部分土壤过150 μm筛后用于理化性质分析.供试土壤pH值为7.68,有机质含量为23.0 g·kg-1, 有效磷含量为30.5 mg·kg-1, 速效钾含量为179 mg·kg-1, 碱解氮含量为174 mg·kg-1, 总镉含量为0.270 mg·kg-1, 总铁含量为3 326 mg·kg-1.
根据《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB15618—2018), pH为6.5~7.5的中性土壤所含Cd的风险管制值为3.0 mg·kg-1.本研究称取适量土壤, 添加CdCl2溶液, 使土壤Cd含量达到5.0 mg·kg-1的重污染水平, 室温下混匀并老化60 d后备用.
1.2 实验设计
盆栽实验采用高24 cm、内径22 cm的聚乙烯塑料盆,每盆装镉污染土壤5 kg, 并施加基肥(1.0 g CO(NH2)2、0.815 g KH2PO4和0.275 g KCl[10])和不同的外源铁.FeCl2·4H2O添加量分别为60, 120, 240 mg·kg-1(添加量以Fe含量计), 记为L1,L2,L3组; FeSO4·7H2O添加量分别为60, 120, 240 mg·kg-1, 记为S1,S2,S3组; 另设不添加外源铁的对照组.每组设3个平行实验组.以上各组土壤陈化30 d后,于2019年6月移栽水稻秧苗,每盆3穴,每穴3株 穴间距约8 cm.水稻生长过程中保持淹水层高于土壤表面3~5 cm, 每周随机更换盆栽位置,并做好病虫鸟害防治工作,于2019年10月收获水稻.
1.3 样品测定
分别于水稻分蘖期(移栽后30 d)、抽穗扬花期(移栽后75 d)、完熟期(移栽后121 d)采集根际土壤约2 g,自然风干后研磨并过850 μm筛, 用于有效态镉的测定.有效态镉为以离子形式吸附在土壤胶体表面、可被植物吸收利用的镉,本文通过二乙基三胺五乙酸(DTPA)提取后测定其含量, 记为DTPA-Cd.水稻收获后取部分新鲜根系用于根表铁膜的测定,剩余根系连同水稻植株洗净后置于105 ℃的烘箱中杀青2 h, 然后在60 ℃下烘干至恒重, 随后用万能粉碎机粉碎, 过150 μm筛后用于Cd含量的测定.
土壤pH、Eh使用雷磁PHS-3C型精密pH计及ORP计(上海仪电科学仪器公司)原位测定; DTPA-Cd的含量根据GB/T 23739—2009经DTPA浸提后采用SOLAAR MKⅡ-M6型火焰原子吸收分光光度计(Thermo Scientific公司, 美国)测定; 水稻根表铁膜成分经连二亚硫酸盐-柠檬酸盐-碳酸氢盐法(DCB)浸提后使用ELAN DRC-e型电感耦合等离子质谱仪(ICP-MS, PerkinElmer公司, 美国)测定; 水稻根、茎叶及籽粒中Cd、Fe含量根据国标GB5009.15—2014和GB5009.90—2016采用干法灰化消解完全后用1% HNO3溶液定容、过滤, 通过ICP-MS测定.采用标准土壤样品GBW07431、标准植物样品 GBW10020(GSB-11)、标准大米样品 GBW10043(GSB-21)作为质控样本.数据采用SPSS 18.0进行单因素ANOVA分析和Duncan多重比较(差异水平P=0.05).
2 结果与讨论
2.1 土壤pH和Eh值
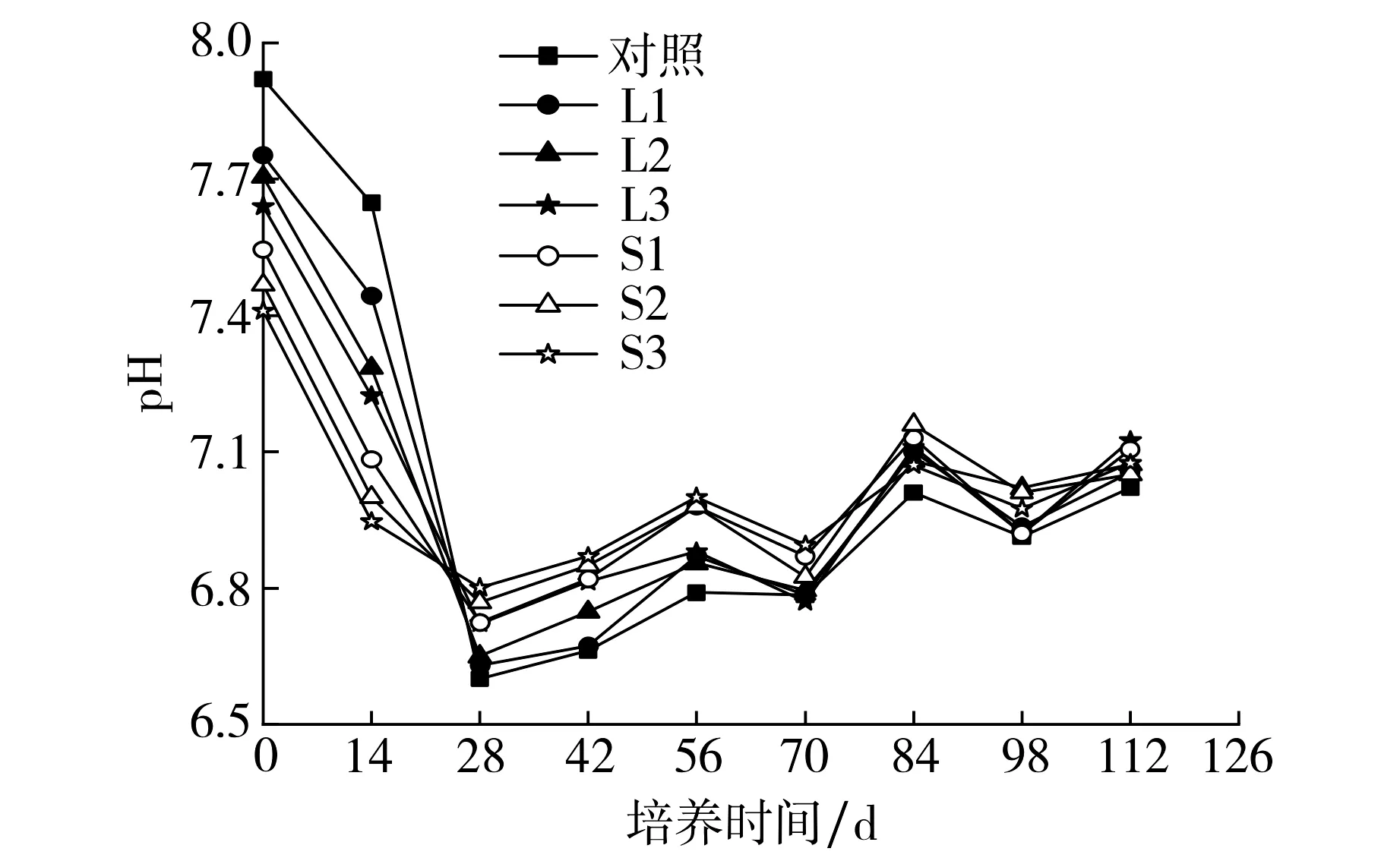
图1 土壤pH值随培养时间的变化
图2为各组土壤的Eh值随培养时间的变化趋势.如图2所示,各组土壤Eh值均随培养时间呈下降趋势; 添加外源铁的各组土壤Eh值远低于对照组; 对于同种外源铁,添加量越高, Eh值越低.这是因为土壤淹水后与氧气隔绝, Eh值迅速降低, 且Fe(II)具有还原性, 故实验组中的土壤Eh值进一步降低[13].由图2还可知, 硫酸亚铁比氯化亚铁对降低土壤Eh值的影响更为明显.
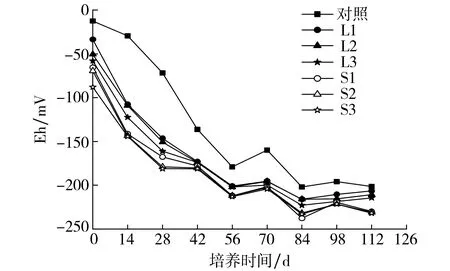
图2 土壤Eh值随培养时间的变化
2.2 土壤DTPA-Cd含量
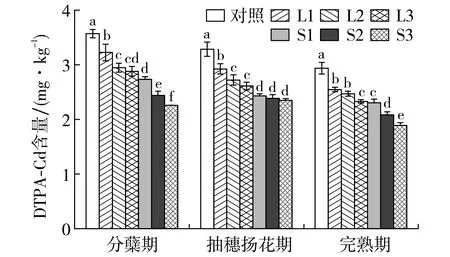
图3 水稻各生育期土壤DTPA-Cd含量
2.3 水稻根表铁膜及其吸附的Cd含量
淹水环境中, 水稻的根际释放氧气,形成根茎微氧区.积水土壤中的Fe(Ⅱ)在水稻根系周围可氧化为Fe(Ⅲ), 然后沉积在根表形成沉淀, 称为根表铁膜[15].图4显示了两种外源铁对水稻根表铁膜中Fe含量的影响.如图4所示,与对照组相比,外源铁的施加显著增加了水稻根表铁膜的Fe含量.同种外源铁的施加量越大,根表铁膜Fe含量越多, 这与Liu等[15]的研究成果相一致.氯化亚铁和硫酸亚铁组水稻根膜Fe含量较对照组分别升高了25.0%~37.2%和35.3%~59.7%,相同添加量下,硫酸亚铁组的Fe含量升高幅度大于氯化亚铁组,这可能与硫元素能促进水稻根际铁锰胶膜的形成[16-17]有关.
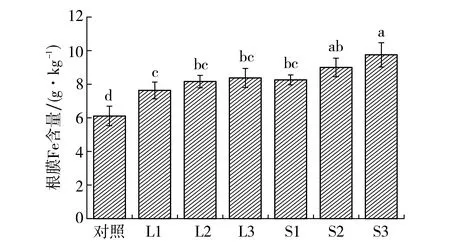
图4 水稻根表铁膜Fe含量
图5为两种外源铁对水稻根表铁膜吸附Cd含量的影响.如图5所示,氯化亚铁和硫酸亚铁组水稻根膜富集的Cd含量较对照组分别升高了14.0%~60.1%和44.2%~116%,这可能与根表铁膜厚度有关.根表铁膜主要由氧化铁和氢氧化物组成,具有极大的比表面积,大量研究表明,根表铁膜能对Cd产生富集作用,铁膜厚度增加,根膜富集的Cd含量越多[15,18].图5还显示,相同添加量下, 硫酸亚铁组根膜富集的Cd含量均大于氯化亚铁组.
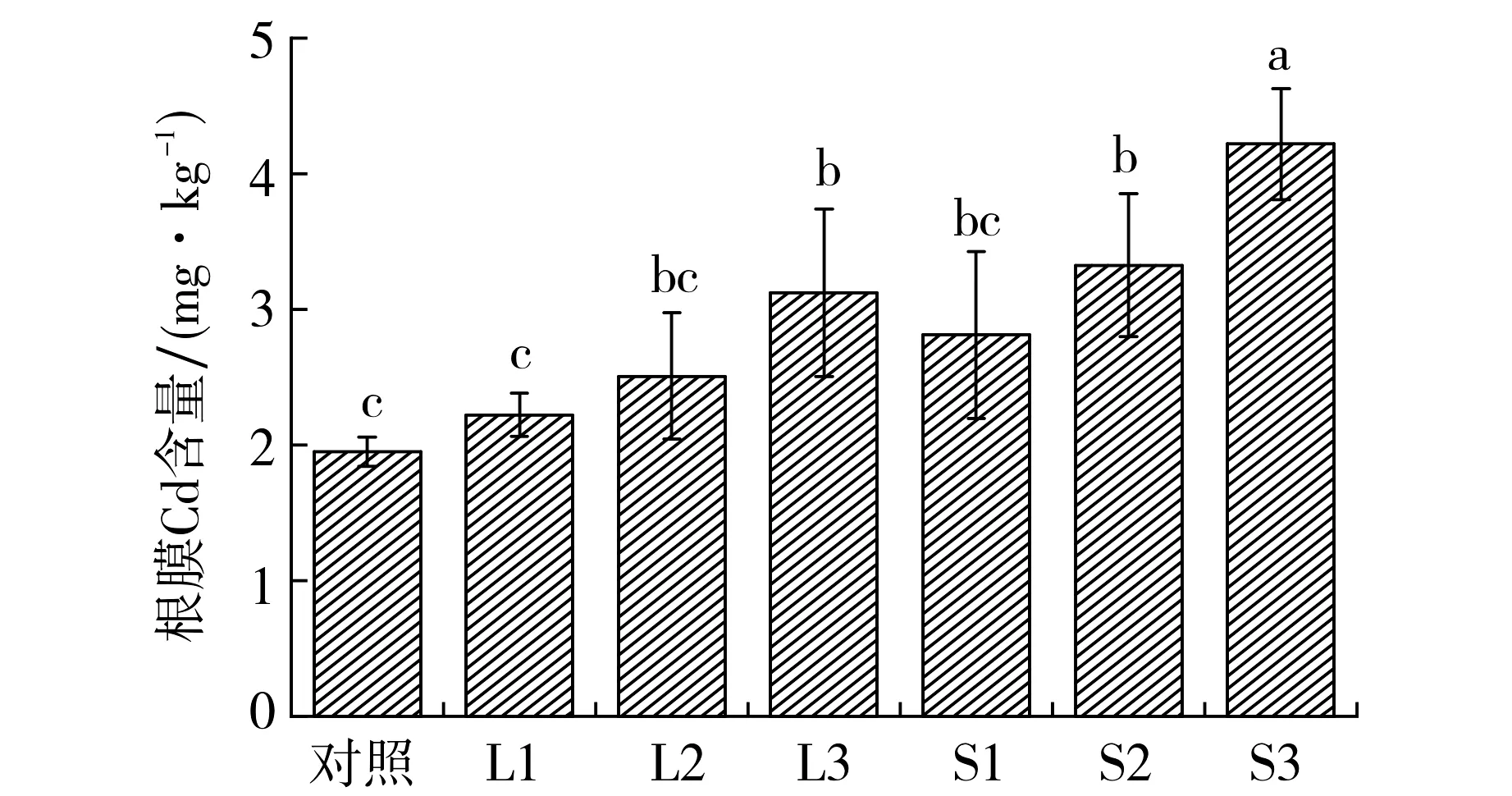
图5 水稻根表铁膜吸附的Cd含量
将水稻根表铁膜中Fe与铁膜吸附的Cd含量进行相关性分析,结果显示,氯化亚铁组根膜Fe含量与其吸附的Cd含量呈显著正相关关系(r=0.541), 硫酸亚铁组根膜Fe含量与其吸附的Cd含量呈极显著正相关关系(r=0.849), 说明本实验中根表铁膜对土壤中的Cd具有吸附作用.
2.4 水稻各部位的Cd含量
不同外源铁对水稻各部位Cd含量的影响如图6所示.由图6可知,无论何种处理,水稻根与茎叶、糙米间的Cd含量差异显著,根部Cd含量为糙米中Cd含量的10~30倍.与对照组相比,两种外源铁的施加使水稻各部位Cd含量均出现不同程度的降低,对于同种外源铁,施加量越大,水稻各部位Cd含量越低.对于根部Cd含量,相同添加量下,硫酸亚铁组的含量显著低于氯化亚铁组;除L1组外,各组茎叶部的Cd含量较对照均显著降低,相同添加量下,硫酸亚铁和氯化亚铁对茎叶部Cd含量的影响差异不明显;对于糙米中的Cd含量,氯化亚铁和硫酸亚铁组较对照组分别降低了8.05%~22.5%和10.6%~36.9%.陈立伟[19]研究发现,向两种不同Cd污染土壤添加外源铁能有效降低水稻糙米中Cd含量,这与本研究成果相一致.本研究中,除添加量为60 mg·kg-1的氯化亚铁组外,其余各外源铁添加组中的糙米Cd含量均低于食品安全国家标准(GB 2762—2017)的限值0.2 mg·kg-1, 其中S3处理组水稻糙米Cd含量最低,仅0.14 mg·kg-1.综上, 硫酸亚铁和氯化亚铁的添加显著降低了水稻植株各部位Cd的含量.
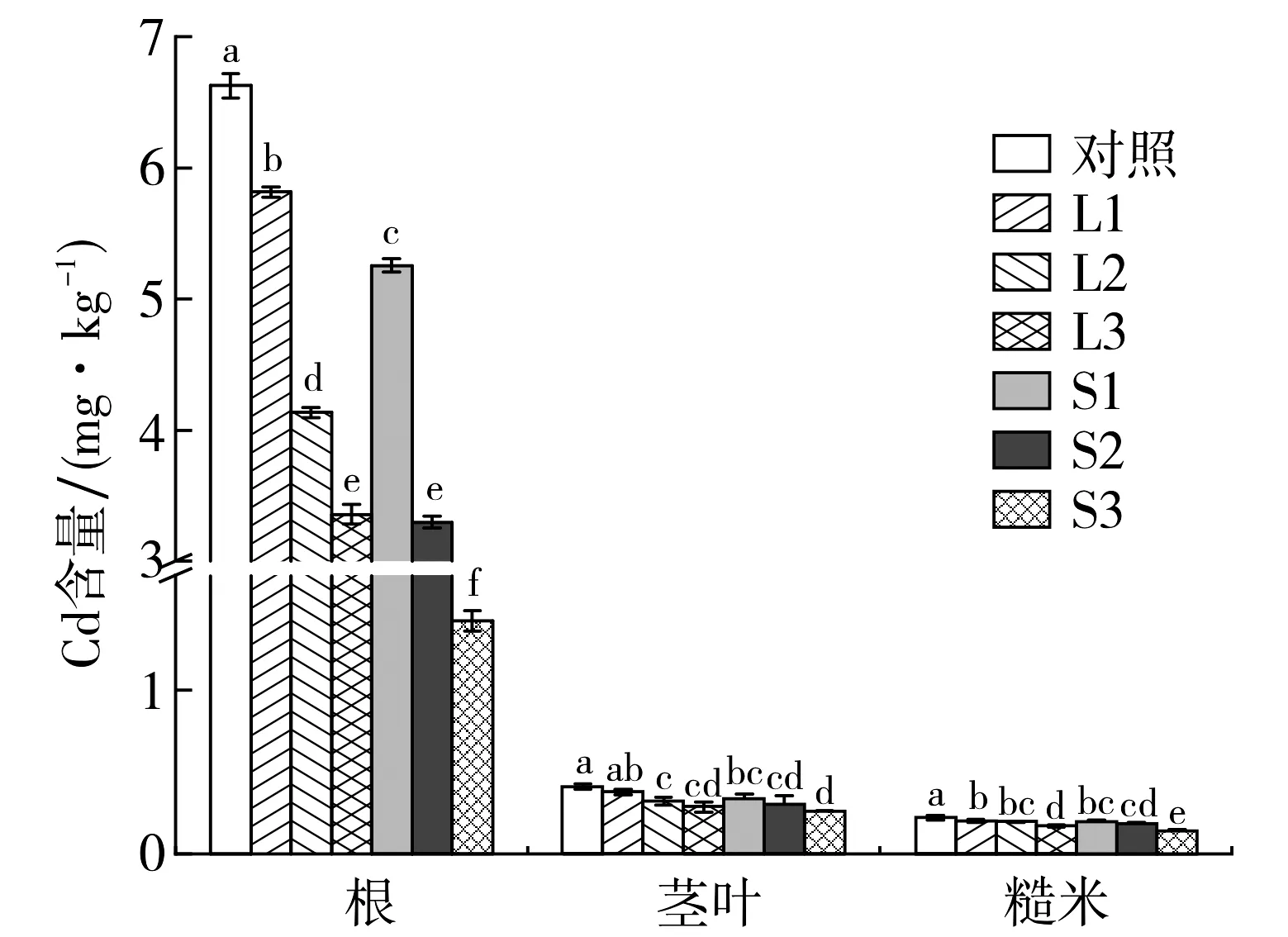
图6 水稻植株各部位的Cd含量
