围生期常用治疗对子代神经发育影响的研究进展
2022-04-20魏思萌综述刘俐审校
魏思萌 综述 刘俐 审校
(西安交通大学附属第一医院新生儿科,陕西西安 710061)
大脑的发育过程受基因编程、表观遗传及环境等多种母婴因素的影响,尤其在围生期内发生的不同事件对大脑的发育进程有着深远影响[1]。而随着救治手段的不断成熟,早产儿、高危儿的生存率也逐渐提高。这些提高存活率的关键治疗或药物是否会对脑发育带来不利结果,尤其对早产儿的近远期生存有怎样的影响?本文全面综述围生期常用治疗对神经发育影响的最新证据。
1 糖皮质激素
1.1 产前使用糖皮质激素
产前使用糖皮质激素(antenatal corticosteroid,ACS)可有效防治早产儿呼吸系统疾病,并对胎儿日后的神经发育起到重要作用[2]。目前国内外研究认可ACS可促进妊娠小于34周胎儿胎肺成熟,降低早产儿多种疾病发生率和病死率,并间接稳定其脑血流量水平,对神经系统有短期益处[3]。然而随着研究的深入,ACS的潜在长期损害逐渐被关注,尤其对于晚期早产及足月产孕妇应用的影响仍有争议。2013年一项研究发现应用单疗程激素治疗与健康足月儿不良神经系统发育结局相关,且这种关联至少持续6~10年[4]。2020年芬兰历时11年的回顾性队列研究也显示,与未治疗组对比,ACS治疗组足月儿及早产儿在儿童期精神行为异常发生率增高(12.01%vs 6.45%)[5]。然而,加拿大最新队列研究分析胎龄31~36+6周儿童的早期发展指数,结果显示,ACS与儿童早期神经发育无关,且胎龄<34周和晚期早产的儿童早期发展指数无差异[6]。因此,ACS对足月儿及晚期早产儿的长期神经危害仍需更多研究证明。
在影响机制方面,研究发现,ACS引起的危害可能是由于胎儿体内皮质醇的大幅增加引起应激反应,并通过激活ACS相关信号通路及下丘脑-垂体-肾上腺轴,进而影响大脑发育进程[7]。动物研究也表明,产前暴露于ACS可造成脑容量、海马细胞密度减少,脑髓鞘形成延迟等,未来仍需了解产前暴露如何影响大脑发育、神经发育障碍,甚至成年期的健康[8]。
1.2 产后使用ACS
ACS主要用于防治早产儿支气管肺发育不良(bronchopulmonary dysplasia,BPD),其使用时机、持续时间、用量及应用种类均会影响与大脑中激素受体的最佳结合及作用效果[9]。目前研究中ACS的种类主要包括地塞米松、氢化可的松及新型吸入性布地奈德。既往研究及Meta分析已证明,生后早期(<8 d)使用地塞米松可有效预防BPD,但易增加脑瘫、神经认知障碍等远期不良结局的发生,而延迟给予(生后7~14 d)地塞米松可使神经发育受损减少[10-11]。相比于地塞米松,早期给予氢化可的松对神经发育的不良作用可能更少。墨尔本一项Meta分析显示,早期给予氢化可的松的早产儿病死率和脑性瘫痪发生率比地塞米松少[12]。但延迟氢化可的松治疗的长期跟踪数据仍缺乏,美国国家儿童健康和人类发展研究所正进行一项试 验 (https://clinicaltrials.gov/ct2/show/study/NCT01353313),对出生胎龄<30周并在生后14~28 d仍保持机械通气的早产儿行氢化可的松治疗,并观察其长期神经发育情况,可进一步关注该研究结果。
相比于全身使用,吸入性布地奈德对治疗BPD的安全性和有效性仍需研究。欧洲一项研究对早期(生后24 h内)接受吸入性布地奈德治疗的婴儿进行随访,结果显示,布地奈德组和对照组患儿在2岁时的神经发育障碍发生率无差异,但布地奈德组的病死率较高[13]。在一项比较吸入性和全身激素治疗的Meta分析中,2种治疗方式在患儿认知、脑性瘫痪及死亡结局方面均无差异[14]。综合来看,寻求最佳的治疗方案对BPD早产儿的近远期发育至关重要,关注吸入性布地奈德等新疗法的研究也将为改进BPD防治方法提供新的参考。
2 抗生素治疗
孕期母体感染易通过多种途径引起新生儿生后神经认知障碍,而产前使用抗生素可以有效降低绒毛膜羊膜炎、新生儿感染、新生儿脑室内出血发生率[15]。目前,产前使用抗生素更多显示出短期的有益影响,长期对神经发育的影响仍需随访。一项随访结果显示,抗生素对胎膜早破新生儿的神经发育无显著影响,而胎膜完整的婴儿产前接触大环内酯类抗生素可增加生后7年时脑性瘫痪的发生率[16]。马拉维地区的研究也显示,母亲在孕期进行阿奇霉素预防治疗,可减少子代13岁之前发育不良的发生率,并对神经认知无明显影响[17]。另外,动物实验提示,产前青霉素治疗对子代神经发育具有性别差异,与雌性小鼠相比,雄性小鼠的神经社会行为明显异常,这与大脑mRNA表达、肠道微生物群的改变密切相关,值得我们进一步关注[18]。
目前,婴儿生后的抗生素使用较广泛,但对神经发育的远期影响仍缺乏证据。2019年一项研究将不同时间使用抗生素的婴儿分类,并对其11岁前的神经认知发育进行随访。结果显示,在生后6个月内首次接受抗生素治疗的儿童神经认知和语言能力显著降低,这可能与肠道微生物群的破坏并通过脑-肠-微生物轴进一步影响神经发育有关[19]。另一项动物实验也印证了脑-肠轴的影响机制,并发现不同剂量的抗生素也对中枢神经系统有长期、性别依赖的影响,而益生菌的治疗策略可能抵消早期抗生素对神经发育的有害影响,这也是未来的研究方向之一[20]。
3 硫酸镁
产前给予硫酸镁已证明是一种重要的神经保护措施,在国际较多指南中已推荐产前常规使用[21-22]。法国一项长达9年的前瞻性研究结果显示,产前给予硫酸镁可降低胎龄<33周婴儿2岁时的脑性瘫痪患病率[23]。最新研究也证明,产后硫酸镁治疗也可改善中重度围产期窒息新生儿的短期神经系统结局,但在6个月时差异不明显[24]。同时,2021年一篇综述对过去10年的研究进行回顾,多数研究虽然表明硫酸镁治疗可改善神经预后,但到学龄期并没有明显益处。同时,这些研究也并未考虑不同体温、性别的影响,这也提示,需要进一步的研究来确定硫酸镁的作用是否有性别差异,以及对远期神经功能的影响[25]。
目前有关的机制研究证明,硫酸镁可能通过抑制IL-6等炎症因子的产生,减少炎症反应发生,并通过影响细胞外谷氨酸兴奋性毒性,减少细胞凋亡。另外,镁离子也可通过保证内皮细胞的正常功能,保护神经递质的释放[26-27]。动物实验已证明,给予硫酸镁可以减少少突胶质前体细胞的凋亡,并减少脑白质损伤和髓鞘脱失的发生,这也为探究硫酸镁对脑发育保护的具体机制提供更多可能[22]。
4 非甾体抗炎药
非甾体抗炎药用于治疗动脉导管未闭(patent ductus arteriosus,PDA),临床主要使用吲哚美辛、布洛芬,近年也有对乙酰氨基酚的研究报道。吲哚美辛能够有效拮抗前列腺素对血管的舒张作用,促进动脉导管的关闭[28]。早期研究证明,吲哚美辛可以减少极低出生体重儿脑室内出血的发生率及严重程度,而神经远期影响则显示出性别差异,治疗组的男孩在学龄期的全量表智商值明显优于未使用组,但女孩并无差别[29]。这提示吲哚美辛对不同性别早产儿脑发育的远期作用及机制值得进一步研究。
与吲哚美辛相比,布洛芬不影响脑肠系膜及肾脏血流,肾功能损害、颅内出血等并发症发生率低[28]。一项纳入9项研究的Meta分析显示,布洛芬治疗可有效降低PDA的发生,但脑室内出血发生率与未治疗组无差异,并没有表现出明显的神经保护作用[30]。2021年美国研究人员拟开展一项多中心随机对照试验,观察早期使用布洛芬治疗的早产儿随访2岁矫正年龄时的神经障碍发生情况,其研究结果值得关注[31]。对乙酰氨基酚作为治疗PDA的新方法,Juujärvi等[32]对使用该方法治疗的早产儿进行为期2年的随访,结果显示,其神经发育水平与未治疗组无差异。另一项历经5年的随访研究也发现,对乙酰氨基酚治疗后的长期不良神经发育结果少见[33]。目前,有关对乙酰氨基酚防治方法的安全性和有效性还需要进行更大规模的试验。
5 吸入一氧化氮
吸入一氧化氮(inhaled nitric oxide,iNO)主要用于治疗新生儿持续性肺动脉高压,它可以选择性调节肺血管张力,也是大脑血流和炎症的关键调节因素[33]。内源性一氧化氮在发育中大脑的髓鞘化和脑损伤调节中发挥重要作用[34]。然而,外源性iNO对新生儿大脑发育的直接或长期影响仍然存在争议,取决于剂量、治疗时间、持续时间和疾病过程等各种因素[35]。最新研究表明,低剂量iNO可通过减少仔猪的神经元变性及小胶质细胞活化,改善炎症反应,达到婴儿神经保护的作用[36]。相反,高剂量iNO与自由基的产生和神经毒性有关,对大脑产生有害影响[37]。另外,针对既往随机对照试验的Meta分析显示,iNO对脑室内出血、脑性瘫痪、神经发育或认知障碍的发生率无显著影响,但因混杂因素较多,未来仍需更多的有力证据论证iNO使用的最佳方案[38]。
6 促红细胞生成素
促红细胞生成素(erythropoietin,EPO)可促进红细胞的成熟及发育,主要用于早产儿贫血的防治。大量研究表明,EPO具有短期(神经营养、抗炎、抗凋亡)和长期神经保护作用(血管发生、神经遗传)。瑞士一项临床试验中,早产儿在生后3 h、12~18 h和36~42 h内接受3次EPO治疗,脑磁共振成像和追踪扫描显示,脑白质损伤较少,突触连接有所改善[39]。相反,美国最新研究中,EPO治疗婴儿的弥散张量成像显示突触连接等无明显改善,且这种影像改变并不影响长期神经发育结果。这可能是因为缺铁影响突触发生及髓鞘形成等,而不是EPO本身影响[40]。最新的Meta分析也表明,EPO改善早产儿神经发育的结果有较大异质性,未来仍需要考虑铁缺乏等因素,获取更多长期有效的随访数据[41]。另外,EPO对脑发育的作用机制研究显示,EPO可以减少炎症因子产生,改善损伤后少突胶质细胞的凋亡[42]。同时,EPO抑制多聚二磷酸腺苷-核糖聚合酶1的活化,从而减少小胶质细胞活化,降低脑白质损伤的发生[26,42]。
另外,EPO剂量与神经保护作用呈倒U型曲线,EPO过少或过多均会导致疗效下降。2020年一项研究结果显示,从出生后24 h至纠正胎龄32周对极早产儿进行大剂量EPO治疗,并未减少其2岁时神经发育障碍或死亡的发生[43]。这提示我们,EPO给药时间、剂量、频次和总治疗时间对神经发育的影响仍需进一步研究。
7 咖啡因类药物
咖啡因类药物是NICU的常用药物之一,主要用于治疗早产儿呼吸暂停。早期研究证明,枸橼酸咖啡因有一定神经保护作用[44]。2019年最新研究对胎龄<29周早产儿使用咖啡因干预并在矫正胎龄18~24个月随访评估神经发育情况,分为早期咖啡因干预(出生48 h内使用首剂)及晚期干预组(出生48 h后使用首剂)。贝利婴幼儿发展量表结果显示,早期干预组得分<85分的比例明显低于晚期组(认知评分13.4%vs 17.6%;语言评分33.4%vs 40.3%)[45]。另一项长期随访研究中,在18~21月龄时枸橼酸咖啡因治疗组的脑性瘫痪及认知障碍发生率均较未治疗组减少,随访至5岁时认知障碍的发生率较18月龄时降低,但在2组间并无差异,而11岁时2组儿童学业和行为障碍的发生率并无明显差异[46-47]。因此,枸橼酸咖啡因呈现一定的长期益处,但使用的最佳剂量等仍待研究。Firman等[48]发现,对极早产儿早期使用高剂量的枸橼酸咖啡因并未造成长期神经发育的异常。动物实验也表明,高剂量咖啡因治疗会影响大脑少突胶质细胞密度及树突长度,从而产生一系列复杂影响,而这种变化是否持续存在并影响远期神经功能尚需进一步验证[49]。
8 肺表面活性物质
肺表面活性物质已广泛应用于新生儿呼吸窘迫综合征的治疗,可显著降低其病死率。早期相关的研究较多,结果显示,肺表面活性物质治疗组颅内出血、脑室周围白质软化的发生率相对于对照组并无增加[50]。对于远期发育的影响,2002年一项Meta研究分析了过往13项随机对照研究显示,1岁时肺表面活性物质治疗组的患儿轻度神经障碍的发生率较对照组低,而在2岁和学龄期时不再观察到这种差异[51]。近年有关肺表面活性物质对神经系统远期预后影响的证据较少,仍需关注。
9 亚低温治疗
新生儿缺氧缺血性脑病患儿留下远期神经系统后遗症的发生率较高,而亚低温治疗可以通过改善脑血管血流,减少再灌注损伤及炎症反应,有效改善神经预后[52]。但需注意,亚低温治疗的应用对象、温度控制、开始及持续时间等因素对治疗的近远期效果有重要影响[52]。回顾既往研究及综述,治疗在生后6 h内开始,并维持72 h在33.5℃,可有效减少中重度缺氧缺血性脑病患儿的神经系统损害,但其远期影响仍需随访[53-54]。同时,复温过程也可引起脑部血流动力学的波动,增加脑室内出血的发生[55]。因此要注意体温的稳定性,制定最安全有效的治疗方案是未来的方向。近年,研究者也在尝试联合使用床旁血流动力学监测及神经保护作用措施。研究显示,亚低温治疗联合抗细胞因子、EPO等具有协同治疗作用,可通过减少缺血相关的血脑屏障功能障碍及细胞因子的表达,在大脑内发挥神经保护作用,这也为未来探索更多亚低温联合治疗提供方向[56]。
10 其他治疗
随着医疗和技术的不断进步,研究者发现更多药物和治疗方法可能对人类早产大脑有神经保护作用。目前有研究表明,脐带结扎的延迟可以改善新生儿循环过渡、提高红细胞容积、减少输血需求及降低坏死性小肠结肠炎和脑室内出血的发生率,其长期神经影响有待研究[57]。除此之外,褪黑素、转铁蛋白及二甲双胍等也被证明具有不同程度的神经保护作用,相关的随访研究也值得进一步关注[21]。
综上所述,硫酸镁、咖啡因、EPO等确实对人类早产儿的大脑表现出神经保护作用,但其作用有限。此外,尚需要更多研究来评估糖皮质激素、抗生素、非甾体类抗炎药等是否可以在临床中保护早产儿的神经发育并对其产生长期影响(表1)。同时,未来也会有更多的药物、细胞新兴疗法可以对神经发育或脑损伤产生影响。即便如此,神经发育障碍的早期诊断和干预治疗对促进早产儿的生长发育仍至关重要。我们仍需及早综合判断患儿的具体情况,制定最优化的治疗方案。
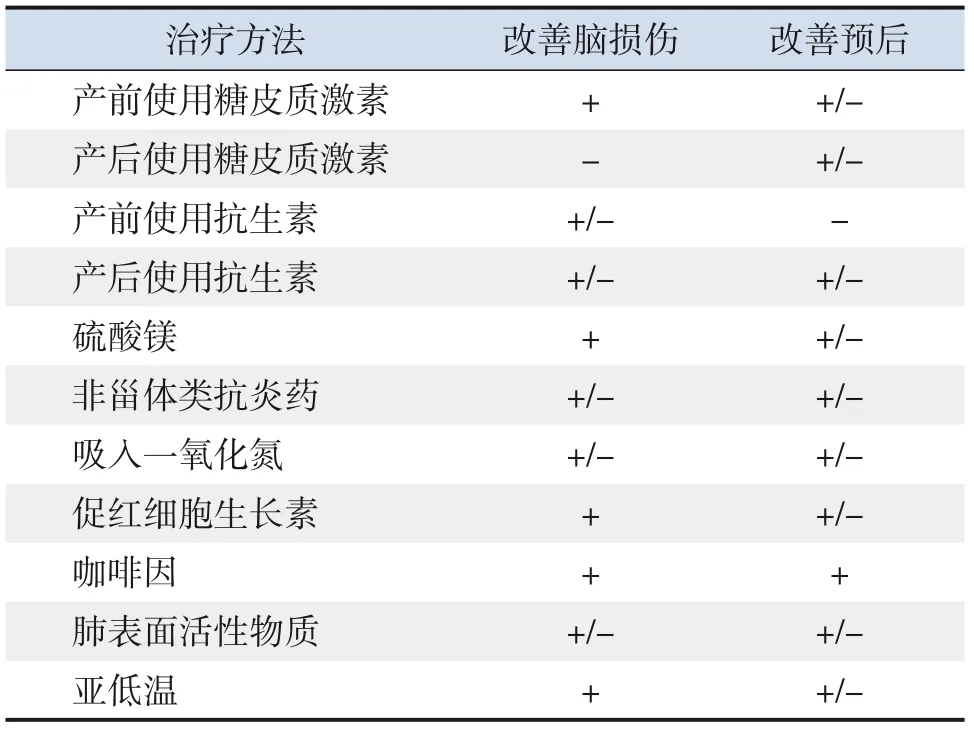
表1 不同治疗方法对新生儿神经发育影响的最新证据总结
