基于高通量测序考察甘肃黄芪种植区根际土壤微生物群落结构及多样性
2022-04-19牟建平滕宝霞史中飞贺晓文曾小梅
牟建平,滕宝霞*,史中飞,贺晓文,赖 晶,朱 玲,肖 静,曾小梅
(1.甘肃省药品检验研究院,甘肃 兰州 730060;2.国家药监局中药材及饮片质量控制重点实验室,甘肃 兰州 730060)
黄芪是一种常用的中药,为甘肃种植的大宗药材,具有补气固表、利尿托毒、排脓、敛疮生肌的功效,多数中成药以黄芪作为君药,《中国药典》2020年版一部收载黄芪为豆科植物蒙古黄芪[Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)
Hsiao]或 膜 荚 黄 芪[Astragalusmembranaceus(Fisch.)]的干燥根[1]。黄芪药材的质量不仅与药材的基因型有关,还会受到特定生态环境的影响,根际微生物群落在植物和土壤之间发挥着重要作用,良好的根际微生物多样性能够维持土壤微生态的平衡,保证植株正常生长,土壤微生物作为评估土壤生态系统的重要指标,对植物生长具有重要意义[2]。
目前,根际微生物的研究侧重于比较根际微生物与非根际微生物群落组成的差异、根际微生物群落构建理论、不同根际微生物类群间的互作,并取得一些重要研究成果。但目前植物根际过程的研究主要是传统的农作物、园艺作物以及模式植物拟南芥和蒺藜苜蓿等,但根际过程调节药用植物产量和质量方面的研究较少,因此开展药用植物根际过程对药用植物产量及其质量方面的研究,这有助于提高药用植物根际过程对不同药用植物产量及其药用成分认识,同时为促进药用植物绿色发展提供理论依据[3]。而且也有助于解决药用植物病害防治及解决连作障碍等实际生产应用问题,提高药用植物的产量和品质[4]。本文基于高通量测序技术,测定甘肃黄芪种植的六个不同地区黄芪根际土壤微生物,比较根际微生物群落组成的差异,通过对根际微生物种群结构分析,为黄芪根际微生物影响土壤养分释放,提升黄芪质量和产量的提供一定的研究基础。
1 研究地区与研究方法
1.1 样本收集
试验选择甘肃省陇西县、漳县、靖远县、渭源县、通渭县和宕昌县6个黄芪广泛的种植区,于黄芪开花生长时期,收集其根际土壤,装入无菌封口袋标记,采样信息见表1。
模式不断更新发展,但只有适合我国教育信息化发展需求、适合信息化环境发展的,才是最好的课程整合模式。本研究也只是罗列两种比较流行的模式进行比较研究,呼吁广大教师不要排斥信息技术与课程整合,根据实际情况尽自己最大努力响应国家的教育改革计划。■

表1 样品采集信息Tab.1 Sample collection information
1.2 DNA抽提和PCR扩增
结果表明,6个甘肃黄芪种植区域根际土壤中真菌分属于13个门,46个纲,98个目,202个科,412个属,共656个种,其根际土壤中真菌的分布情况,见表5。
从稀释曲线的结果可以看出(见图1-2),6个黄芪种植地区样品的稀释曲线均基本上趋于平缓,说明测序趋于饱和,取样基本合理,能够比较真实地反映出这6个地区土壤样品中的细菌和真菌微生物群落,结合各样品覆盖率,细菌和真菌覆盖度均达98%以上,测序结果包含了大多数细菌和真菌微生物类群,能够反应细菌和真菌微生物群落结构组成。以ACE指数、Chao指数和Shannon指数代表菌群的丰度和微生物多样性。从表2-3可以看出,LX细菌的ACE指数、Chao指数和Shannon指数最大,说明LX黄芪根际土壤细菌群落丰富度和多样性高于其他地区根际土壤;ZX真菌的ACE指数、Chao指数最大,说明ZX黄芪根际土壤真菌群落丰富度和多样性高于其他地区根际土壤。
1.3 IlluminaMiseq测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extrac⁃tion Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™Fluorometer(Promega,USA)对回收产物进行检测定量。使用NEXTFLEX®Rapid DNA-Seq Kit进行建库。利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司)。
1.4 数据处理
由图6可知,甘肃黄芪的六个种植区根际土壤真菌群落在纲类水平上主要类群为粪壳菌纲(Sor⁃dariomycetes)、座囊菌纲(Dothideomycetes)、银耳纲(Tremellomycetes)、锤舌菌纲(Leotiomycetes)、散囊菌纲(Eurotiomycetes)、被孢霉纲(Mortierellomyce⁃tes)为主。陇西县采集样本中菌落相对丰度为:粪壳菌纲(Sordariomycetes)占43.4%,座囊菌纲(Do⁃thideomycetes)占22.0%,银耳纲(Tremellomycetes)占14.9%;漳县采集样本中菌落相对丰度为:粪壳菌纲(Sordariomycetes)占31.2%,锤舌菌纲(Leotiomy⁃cetes)占28.7%,座 囊 菌 纲(Dothideomycetes)占19.3%,银耳纲(Tremellomycetes)占11.1%;靖远县采集样本中菌落相对丰度为:粪壳菌纲(Sordariomyce⁃tes)占66.8%,座囊菌纲(Dothideomycetes)占14.9%,被孢霉纲(Mortierellomycetes)占6.0%;渭源县县采集样本中菌落相对丰度为:座囊菌纲(Dothideomyce⁃tes)占75.0%,粪壳菌纲(Sordariomycetes)占11.8%,银耳纲(Tremellomycetes)占7.2%;通渭县采集样本中菌落相对丰度为:粪壳菌纲(Sordariomycetes)占78.5%,银耳纲(Tremellomycetes)占11.6%,座囊菌纲(Dothideomycetes)占5.2%;宕昌县采集样本中菌落相对丰度为:粪壳菌纲(Sordariomycetes)占56.9%,座囊菌纲(Dothideomycetes)占10.0%,银耳纲(Trem⁃ellomycetes)占9.7%,锤舌菌纲(Leotiomycetes)占9.1%。
2 结果与分析
2.1 序列统计和微生物多样性分析
式中:ak>0,取am=1.根据rkm的定义,当ak的赋值准确时,设评价指标xjk的权重系数wk,各指标的权重可以由以下公式确定:
该患者服用华法林已达到INR目标值并稳定后,每日饮用豆浆长达半年,出现INR持续不达标,推测其缘故:结合大豆制品对华法林药效的影响作用,不排除患者INR异常与其长期饮用豆浆有关联性。当患者停止饮用豆浆后,INR逐渐上升,INR重新达到治疗目标范围(2.0左右)。因此,临床药师认为:本例患者长期每日饮用豆浆可能导致了其出院后INR异常持续低于治疗窗。
该水源方案存在的主要缺点是:(1)工程建设费用高,地质要求严,施工难度大,施工涉及面广,遇到的实际问题多,如占地补偿、移民等,不利于工程建设顺利开展。(2)发展规模集中供水,部分村所需管线较长,后期管理、维护难度大,存在二、三级高扬程提水的问题,加大了工程投资,运行成本相对较高,受益户水价难以接受,水费征收困难。(3)天然地表水水质较差,特别是雨季洪水会导致水浑,需安装水质净化设备,增加工程建设费用在所难免。(4)水源地保护范围广、难度大,规划时必须以小流域片区为中心,把水源工程建设和水土流失防治有机结合,权衡开发与保护、治理与利用,确保工程持续健康发展。
由图3可知,甘肃黄芪的六个种植区其根际土壤细菌群落在门类水平上主要类群为放线菌门(Ac⁃tinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、厚壁菌门(Firmicutes)等。陇西种植区的优势菌群是放线菌门(Actinobacteriota)和变形菌门(Proteobacteria),相对丰度分别为34.9%和17.9%;漳县种植区的优势菌群是放线菌门(Actinobacteriota)和绿弯菌门(Chloroflexi),相对丰度分别为50.8%和15.8%;靖远种植区的优势菌群是放线菌门(Actinobacteriota)和变形菌门(Proteobacteria),相对丰度分别为32.3%和20.1%;渭源种植区的优势菌群是放线菌门(Acti⁃nobacteriota)和变形菌门(Proteobacteria),相对丰度分别为44.6%和23.6%;通渭种植区的优势菌群是放线菌门(Actinobacteriota)和变形菌门(Proteobacte⁃ria),相对丰度分别为44.5%和18.6%;宕昌种植区的优势菌群是变形菌门(Proteobacteria)和放线菌门(Actinobacteriota),相对丰度分别为77.7%和13.2%。除宕昌种植区的优势菌为变形菌门(Proteo⁃bacteria)外,其他五个地区的优势菌为放线菌门(Actinobacteriota)。

表2 不同黄芪种植地区土壤细菌多样性指数分析Tab.2 Analysis of soil bacterial diversity index in different A.membranaceus planting areas

图1 细菌多样性指数稀释曲线图Fig.1 Dilution curve of bacterial diversity index
2.2 土壤细菌群落结构分析
结果表明,6个甘肃黄芪种植区域根际土壤中细菌分属于31个门,97个纲,211个目,330个科,614个属,共1163个种,其土壤中细菌的分布情况,见表4。
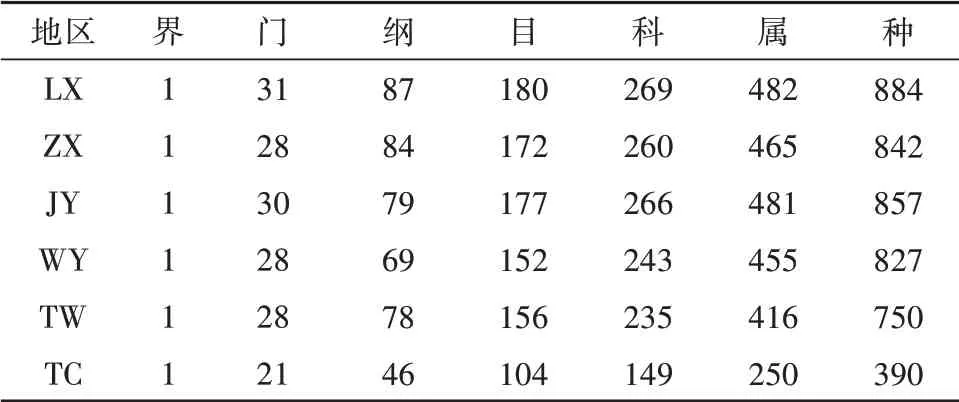
表4 不同种植区土壤根际细菌在分类水平上的物种分布Tab.4 Species distribution of rhizosphere bacteria in different planting areas
她不回应我,起身在我的房间看了一圈,她在我男朋友的照片前停住,回头看着我说,这是你男朋友?我点头说是。
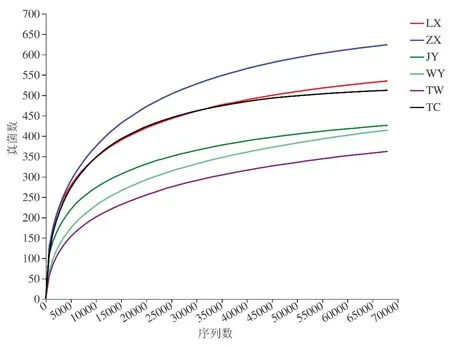
图2 真菌多样性指数稀释曲线图Fig.2 Dilution curve of fungal diversity index
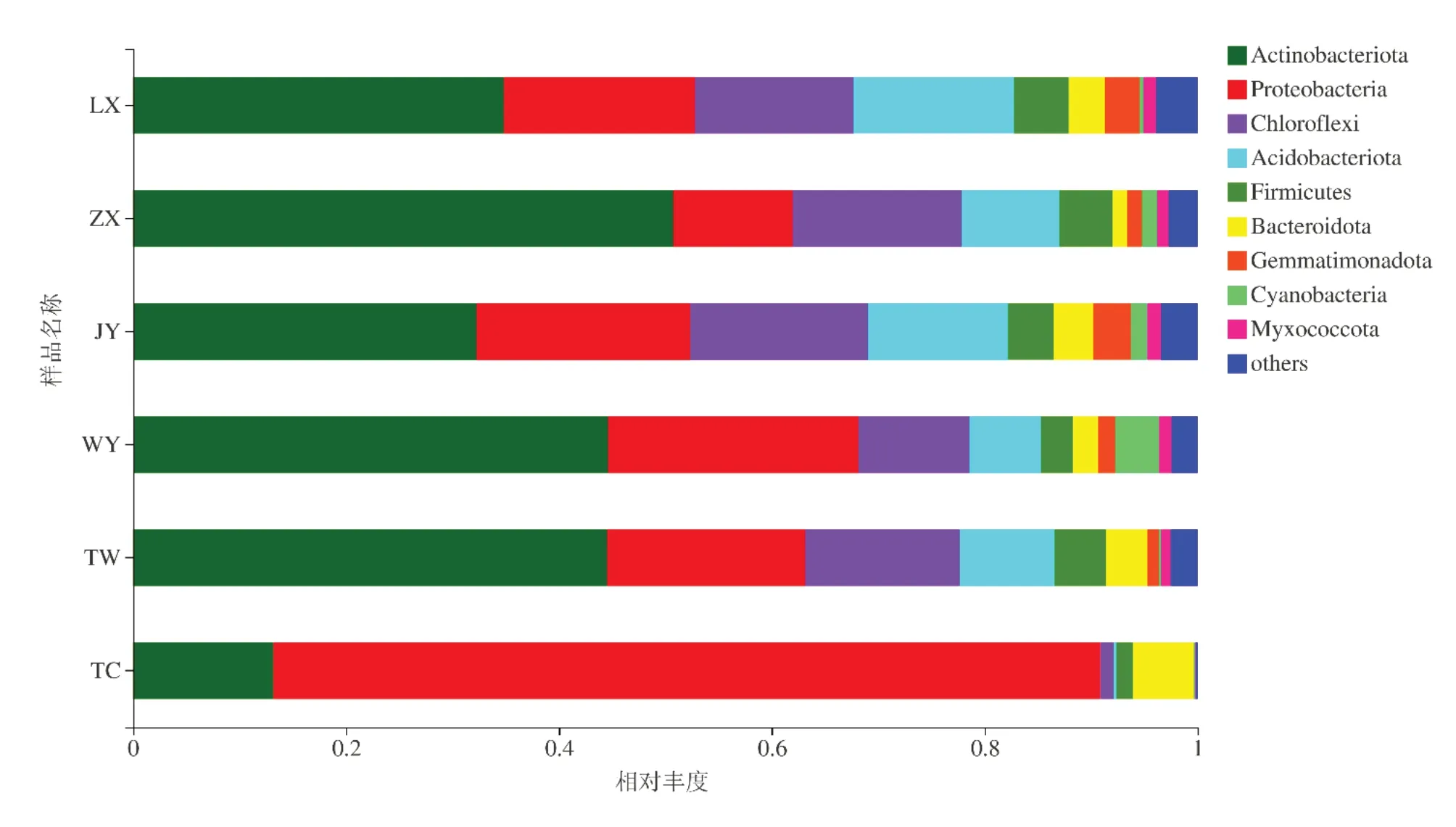
图3 门水平的优势细菌相对丰度Fig.3 Relative abundance of dominant bacteria at phylum level

表3 不同黄芪种植地区土壤真菌多样性指数分析Tab.3 Analysis of soil fungidiversity index in different A.membranaceus planting areas
高家来人了,杨露露带着高成山和高枝赶来谷村;杨露露进了灵堂,坐在桃花对面,一声长一声短地号哭。黄家人原本还担心她责难,但她倒是通情达理的,只怪高木命薄。大家唏嘘不已。杨露露后悔当初不该拆散高木与桃花,如果当初她能像现在这么想,成全了他们,高木也就没事了;但人世间哪有后悔药可买,一切都已经发生了。高木在母亲的哭声中化作一捧灰,埋进了黄家的祖坟。他和梨花埋在一起,埋在张彩凤的右侧。
由图4可知,甘肃黄芪的六个种植区其根际土壤细菌群落在纲类水平上的主要类群为放线菌纲(Actinobacteria)、γ-变形菌纲(Gammaproteobacte⁃ria)、α-变形菌纲(Alphaproteobacteria)、Vicinami⁃bacteria、Chloroflexia等。陇西县采集样本中菌落相对丰度为放线菌纲(Actinobacteria)占23.5%,α-变形菌纲(Alphaproteobacteria)占12.6%,Vicinamibac⁃teria占10.4%;漳县采集样本中菌落相对丰度为:放线菌纲(Actinobacteria)占37.8%,α-变形菌纲(Alp⁃haproteobacteria)占8.7%,嗜热油菌纲(Thermoleo⁃philia)占7.6%;靖远县采集样本中菌落相对丰度为:放线菌纲(Actinobacteria)占26.6%,α-变形菌纲(Alphaproteobacteria)占15.8%,Vicinamibacteria占7.0%;渭源县采集样本中菌落相对丰度为:放线菌纲(Actinobacteria)占37.6%,α-变形菌纲(Alphapro⁃teobacteria)占14.2%,γ-变形菌纲(Gammaproteobac⁃teria)占9.3%;通渭县采集样本中菌落相对丰度为:放线菌纲(Actinobacteria)占31.2%,α-变形菌纲(Al⁃phaproteobacteria)占11.8%,嗜热油菌纲(Thermoleo⁃philia)占8.0%;宕昌县采集样本中菌落相对丰度为:γ-变形菌纲(Gammaproteobacteria)占74.9%,放线菌纲(Actinobacteria)占12.3%,拟杆菌纲(Bacte⁃roidia)占5.7%。

图4 纲水平的优势细菌相对丰度Fig.4 Relative abundance of dominant bacteriaat class level
2.3 土壤真菌群落结构分析
根 据E.Z.N.A.®soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;细菌[5]使 用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16SrRNA基因V3-V4可变区进行PCR扩增,真菌ITS[6]使用ITS1F(5'-CTTGGTCATTTAGAGGAAG⁃TAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGAT⁃GC-3')进行PCR扩增,扩增程序如下:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸45 s),然后72℃稳定延伸10 min,最后在4℃进行保存(PCR仪:ABIGeneAmp®9700型)。PCR反应体系为:5×FastPfu缓冲液4µL,2.5 mM dNTPs 2µL,上下游引物(5µM)各0.8µL,FastPfu DNA聚合酶0.4µL,模板DNA10 ng,补足至20µL。每个样本3个重复。
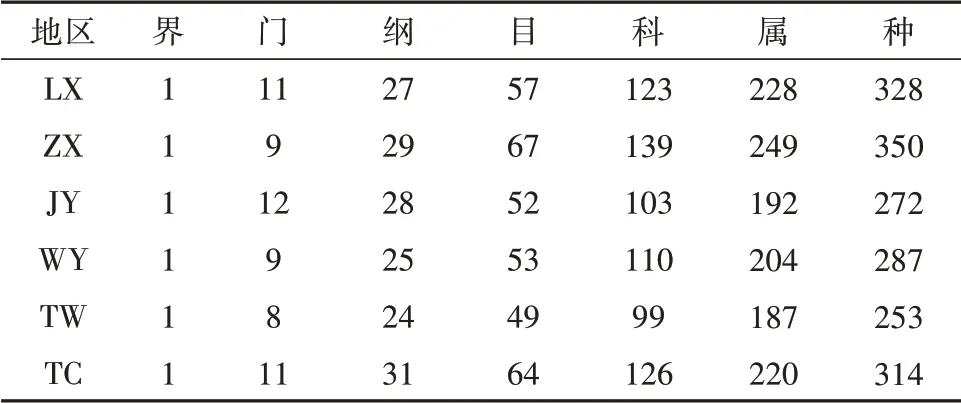
表5 不同种植区土壤根际真菌在分类水平上的物种分布Tab.5 Species distribution of rhizosphere fungiin different planting areas
由图5可知,甘肃黄芪的六个种植区黄芪根际土壤真菌群落在门类水平上主要类群为子囊菌门(As⁃comycota)、担子菌门(Basidiomycota)、被孢霉门(Mor⁃tierellomycota)。陇西种植区各真菌菌落相对丰度为子囊菌门(Ascomycota)占75.5%,担子菌门(Basidio⁃mycota)占17.8%,被孢霉门(Mortierellomycota)占6.1%;漳县种植区各真菌菌落相对丰度为:子囊菌门(Ascomycota)占82.6%,担子菌门(Basidiomycota)占12.0%,被孢霉门(Mortierellomycota)占4.3%;靖远种植区各真菌菌落相对丰度为:子囊菌门(Ascomycota)占91.5%,担子菌门(Basidiomycota)占6.0%,被孢霉门(Mortierellomycota)占1.3%;渭源种植区各真菌菌落相对丰度为:子囊菌门(Ascomycota)占90.9%,担子菌门(Basidiomycota)占8.1%,被孢霉门(Mortierel⁃lomycota)占0.8%;通渭种植区各真菌菌落相对丰度为:子囊菌门(Ascomycota)占87.4%,担子菌门(Ba⁃sidiomycota)占11.9%,被孢霉门(Mortierellomycota)占0.6%;宕昌种植区各真菌菌落相对丰度为:子囊菌门(Ascomycota)占85.4%,担子菌门(Basidiomycota)占10.3%,被孢霉门(Mortierellomycota)占2.0%。
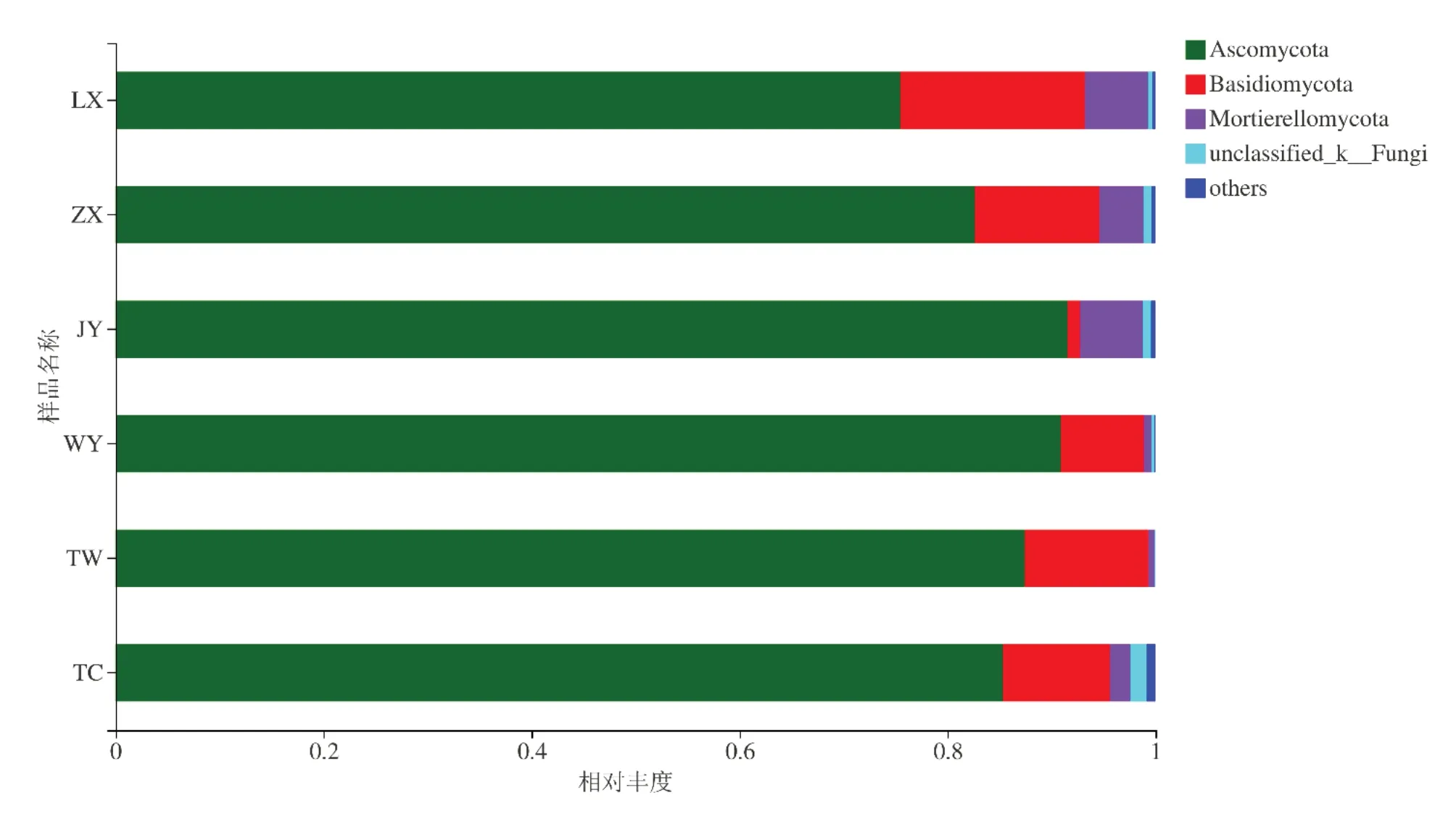
图5 门水平的优势真菌相对丰度Fig.5 Relative abundance of dominant fungiat phylumlevel
使用fastp[7](https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH[8](http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行拼接;使用UPARSE[7]软件(http://drive5.com/uparse/,version 7.1),根据97%[9-10]的相似度对序列进行OTU聚类并剔除嵌合体。利用RDP classifier[11](http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v138),设置比对阈值为70%。
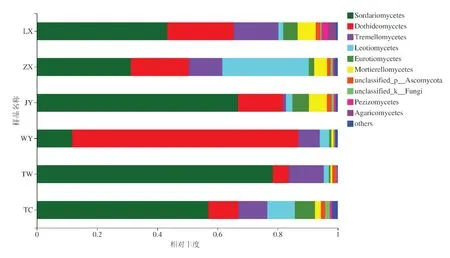
图6 纲水平的优势真菌相对丰度Fig.6 Relative abundance of dominant fungiat class level
2.4 群落的相关性分析
2.4.1 细菌群落的相关性分析
根际土壤微生物的OTU韦恩图,六个黄芪种植区(LX、ZX、JY、WY、TW、TC)土壤样本中检测到细菌OTU分别有1786、1607、1633、1564、1523和514个,其中共有OTU为309个,特有OTU依次为87、81、171、73、57和18个,见图7。
2.4.2 真菌群落的相关性分析
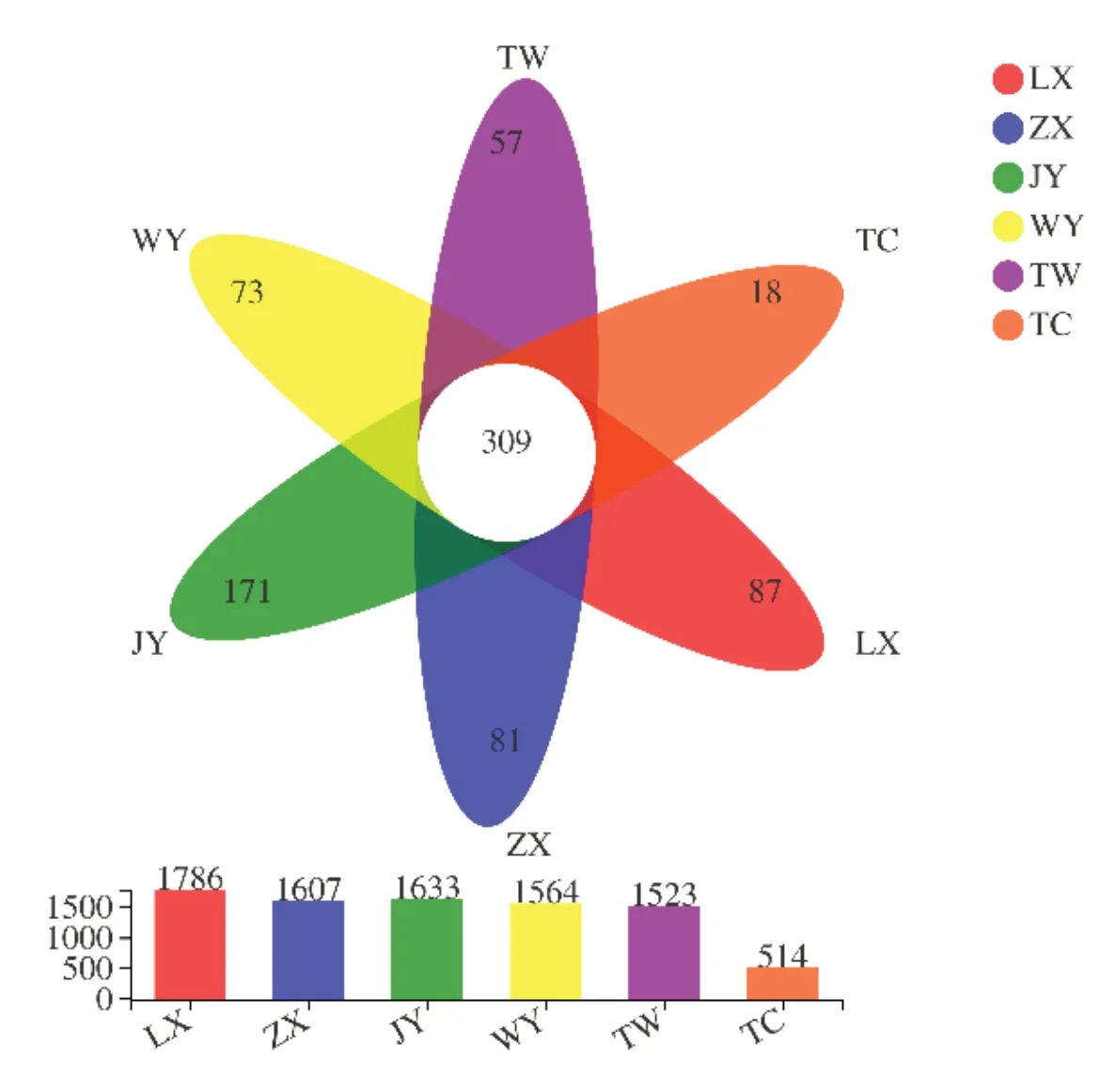
图7 根际土壤细菌OTUs venn图Fig.7 OTUs venn diagramof rhizospheresoil bacteria
根际土壤微生物的OTU韦恩图,六个黄芪种植区(LX、ZX、JY、WY、TW、TC)土壤样本中分别检测到真菌OTU分别有535、624、426、414、362和512个,其中共有OTU为70个,特有OTU依次为100、187、133、54、37和210个,见图8。

图8 根际土壤真菌OTUs venn图Fig.8 OTUs venn of rhizosphere soil fungi
2.5 基于种水平的主坐标分析
分析六个不同黄芪种植地区根际土壤微生物群落组成,分别对根际土壤样品的种水平的细菌和真菌群落进行主坐标分析。不同种植区分散或聚集的分布情况,结果如图9-10所示。六个不同黄芪种植区根际土壤细菌主要在PC2(贡献率为10.33%)上分离,而土壤真菌主要在PC1(贡献率为50.43%)上分离,表明不同黄芪种植地区根际土壤细菌和真菌群落结构组成差异较大。
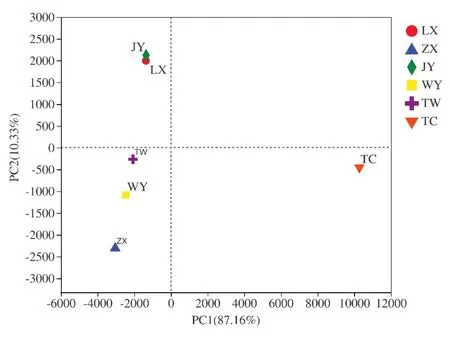
图9 根际土壤中细菌群落主成分分析图Fig.9 Principal component analysis of bacterial community in rhizosphere soil
3 讨论
甘肃黄芪根际具有极其丰富的微生物多样性,放线菌门是一类广泛分布于土壤中的细菌,其中部分细菌对植物有促生作用。变形菌门可以通过同化根系分泌物中的碳水化合物,为自身生长提供碳源,考察结果显示变形菌门的相对丰度较高,这类细菌可以利用根系土中的碳源并与黄芪形成一定的共生关系,促进蒙古黄芪的生长[12]。子囊菌门的真菌多为腐生菌,对降解土壤有机质起着重要作用,不仅是土壤真菌群落中有机质的主要分解者,而且二者可与植物共生形成菌根,参与根际氮素的循环,对植物的生长发育具有重要作用[13]。在六个黄芪种植区,子囊菌门的相对丰度高,说明子囊菌门真菌适应性广泛,在不同的土壤条件下都有广泛的分布[14]。这些微生物通过直接或间接的影响着黄芪的生长发育和品质形成。这些根际微生物可能影响着黄芪生长过程中的光合作用、呼吸代谢等过程,通过改变黄芪根系分泌物的组成,改善了黄芪生长土壤的理化性质,缓解连作障碍,某些根际微生物已被报道能够参与药用成分的合成[15]。黄芪根际微生物调节土壤养分的策略,对提升黄芪产量和药用成分的研究提供基础。
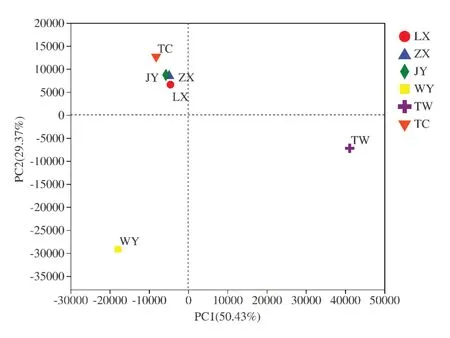
图10 根际土壤中真菌群落主成分分析图Fig.10 Principal component analysisof fungal community in rhizosphere soil
