γ-氨基丁酸对盐碱胁迫下甘草种子萌发的影响
2022-04-19葛甜甜关思静徐蓉蓉张亚丽谢丰璞严加坤颜永刚
葛甜甜,王 楠,高 静*,关思静,徐蓉蓉,张亚丽,谢丰璞,李 瑞,严加坤,颜永刚,张 岗
(1.陕西中医药大学药学院,陕西 西安 712046;2.陕西中医药大学陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究与开发国家重点实验室(培育),陕西 咸阳 712083;3.榆林学院生命科学学院,陕西 榆林,719000)
土壤盐碱化已逐渐成为全球性的问题,其可降低土壤肥力,对植物的生长有较大的伤害。据报道,我国耕地的盐碱化面积达到9913万hm2,广泛分布在西北干旱地区、东部沿海和东北等地区[1-2]。在自然环境下,根据土壤含盐量和pH值,可分为中性、碱性和盐碱混合型,其中中性盐主要有NaCl和Na2SO4,碱性盐有NaHCO3、Na2CO3[3-4]。土壤盐碱成分通常颇为复杂,盐化和碱化常同时发生,并且盐碱混合是两者的协同效应对植物的伤害远大于单一盐、碱胁迫[5-6]。土壤盐碱胁迫会严重阻碍大多数的种子萌发,并且对胚的生长发育产生不利影响,抑制植物正常的生长[7-8],研究表明,高浓度的盐碱处理抑制蓖麻种子萌发,使发芽率、发芽势、发芽指数降低[9]。赵颖[10]等研究发现藜麦种子萌发率随盐碱胁迫浓度的升高而下降并且在高pH下,幼苗在第7天开始腐烂,使其不能正常生长发育。盐碱胁迫不仅能显著抑制种子萌发和幼苗生长,可通过增大细胞脂膜的透性以及膜脂过氧化反应的速度提高,进而破坏细胞膜的正常生理功能,导致植物体内积累了大量的活性氧(Reactive oxygen species,ROS),进一步导致酶系统的损害[11],使部分组织受到一定伤害。
γ-氨基丁酸(γ-Aminobutyric acid,GABA)是一类具有生物活性的四碳非蛋白质氨基酸,作为细胞内源信号分子普遍存在于动植物组织中[12]。相关研究表明,当植物面临缺氧、低温、高温、高盐碱等非生物胁迫时其含量会迅速提高,帮助植物抵御胁迫环境[13]。已有报道指出,叶面喷施GABA后,可提高甜瓜幼苗的抗氧化酶活性,缓解胁迫对植物光系统Ⅱ(PSⅡ)反应中心的抑制作用,增强幼苗叶片的光合能力,从而提高甜瓜幼苗对盐碱胁迫的抗性[14]。此外,GABA浸种能够促进低温[15]和盐碱胁迫[7]下甜瓜种子的萌发,并通过提高抗氧化酶活性缓解其胁迫造成的伤害。
甘草(GlycyrrhizauralensisFisch.)主要分布在东北、华北、西北等盐渍化区域[16],可以在轻微盐碱地正常生长,但是近年来随着土壤盐渍化日益严重,大量研究发现高盐高碱不利于甘草生长,导致其质量与产量下降,无法满足市场需求[17]。因此,本实验以甘草种子为供试材料,通过研究不同浓度GA⁃BA对盐、碱和盐碱胁迫下甘草种子萌发和幼苗生长的影响,探索外源GABA增加甘草耐盐碱性的机理,为提高甘草种子和早期幼苗对盐碱胁迫的抗性提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为甘草种子,于2020年4月采自新疆乌鲁木齐,经陕西中医药大学黄文静副教授鉴定为豆科植物甘草G.uralensis种子。收获净种后,经打磨后放入编织袋内,于2~8℃冷柜贮藏。
1.2 试验方法
取适量的甘草种子用10%的H2O2消毒30 min,用蒸馏水冲洗干净,吹干后将种子置于烧杯中倒入98%H2SO4浸泡30 min后用蒸馏水反复冲洗至中性,晾干,待用。以蒸馏水处理为对照(CK),NaCl浓度为100 mmol·L-1,将其标记为NS;Na2CO3浓度为5 mmol·L-1,标 记 为AS;混 合 盐 碱 浓 度 为80 mmol·L-1NaCl+5 mmol·L-1Na2CO3(获得 与中 性盐 相 同 的Na+碱性溶液),标记为NAS;γ-氨基丁酸(GABA)的浓度设置为0.05、0.1、0.2、0.3、0.5 mmol·L-1,并将其标记为G1、G2、G3、G4和G5。试验采用拌种的方法(将不同浓度的GABA分别与NaCl、Na2CO3和NaCl+Na2CO3配制成不同的处理液,加入种子发芽床,使GABA始终贯穿整个处理过程),将待用的甘草种子均匀的铺在2层滤纸、90 mm的培养皿中,加入适量的不同处理液,每个处理3个重复,每个重复30粒种子,放入人工气候箱中(温度25℃,相对湿度75%,光暗周期交替为12 h/12 h)进行萌发试验。24 h后开始逐日观察并补充相应的处理液,直至发芽结束。
1.3 测定指标及方法
1.3.1 生长指标的测定
以胚根长1 mm作为种子发芽标志,测定种子处理第1 d的发芽势和第7 d的发芽率、发芽势、发芽指数和活力指数以及在第7 d每个处理选取9株幼苗用直尺测量胚根、胚轴和子叶的长度。
1.3.2 生理指标的测定
超氧化物歧化酶(Superoxide dismutase,SOD)采用氮蓝四唑(QNBT)法测定,过氧化物酶(Peroxi⁃dase,POD)采用愈创木酚法测定,过氧化氢酶(Cat⁃alase,CAT)活性采用紫外分吸收法测定[18]。
1.4 数据处理
利用Microsoft Excel 2019软件进行数据处理,利用Graphpad 8.0软件进行绘图,利用SPSS 25.0软件进行方差分析和显著性检验。
分别以甘草种子的发芽率(Germination percent⁃age,GP)、发芽势(Germination potential,GP)、发芽指数(Germination index,GI)、活力指数(Vitality in⁃dex,VI)、鲜 重(Fresh weight,FW)、干 重(Dry weight,DW)、胚根长(Radicle length,RL)、胚轴长(Hypocotyl length,HL)、子叶长(Cotyledon length,CL)、SOD、POD和CAT共12个指标,以及盐、碱和盐碱胁迫、5个GABA浓度处理作为2个变量组,用R软件进行冗余分析(Redundancy analysis,RDA),分析3种胁迫及外源GABA与甘草种子萌发及幼苗生长的关系。
2 结果与分析
2.1 外源GABA对盐、碱和盐碱胁迫下甘草种子萌发的影响
由表1可知,盐(92.22%)、碱(91.67%)和盐碱胁迫(91.67%)与CK相比,种子的发芽率无显著性差异(P>0.05),在盐和碱胁迫下发芽势分别下降了44.26%(P<0.05)、9.01%(P<0.05),活力指数在盐、碱和盐碱胁迫下分别下降了39.24%(P<0.05)、13.76%(P>0.05)、24.27%(P>0.05),而发芽指数只在盐胁迫处理中下降了2.04%(P<0.05)。在盐、碱胁迫条件下,施用不同浓度的GABA可提高甘草种子的发芽势或活力指数,在盐胁迫条件下,0.1mmol·L-1处理能够显著提高活力指数,提高了57.13%(P<0.05),在碱条件下,0.05、0.2和0.3mmol·L-1的GABA处理下发芽势分别提高了18.91%、17.11%和4.49%(P<0.05)。
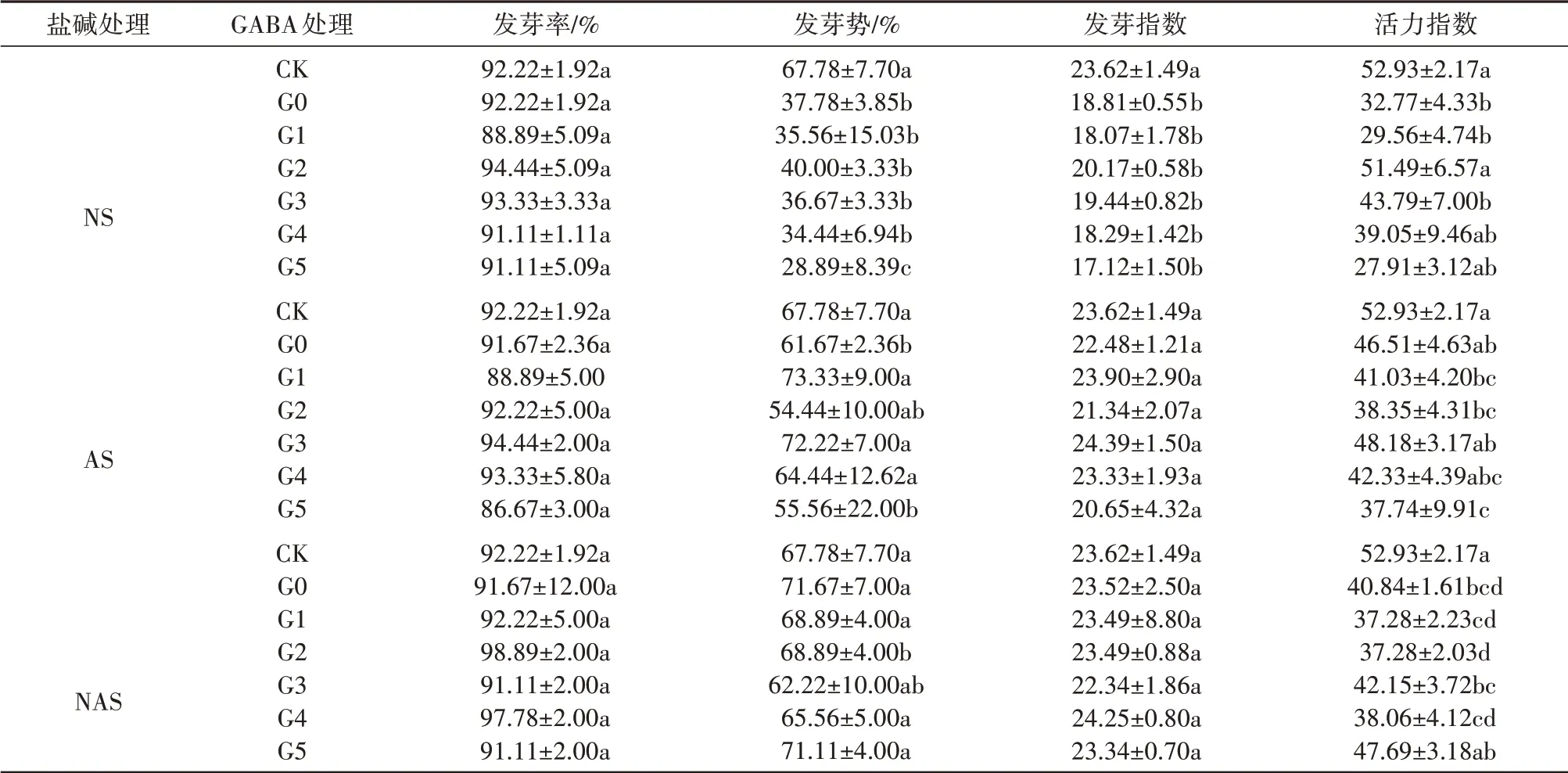
表1 外源GABA对盐、碱和盐碱胁迫下对甘草种子萌发指标的影响Tab.1 Effect of exogenous GABA on seed germination index of G.uralensis under saline,alkaline,and saline-alkaline stresses
2.2 外源GABA对盐、碱和盐碱胁迫下甘草幼苗生长的影响
由表2可知,与CK相比,3种处理显著抑制了甘草幼苗的胚根、胚轴或子叶的生长(P<0.05),其中,盐处理显著抑制胚轴和子叶的生长,碱处理显著抑制了胚根和胚轴的生长,盐碱处理则抑制了胚根和子叶的生长。不同浓度的GABA大部分可有效缓解三种胁迫对上述指标的抑制作用。其中,盐胁迫条件下,0.2 mmol·L-1的GABA处理对甘草幼苗的胚根、胚轴的促进作用最显著,分别为2.46 cm、1.46 cm。在碱胁迫条件下,浓度为0.5 mmol·L-1的GABA可显著促进胚根的生长,较AS增加了43.07%(P<0.05)。盐碱混合条件下,GABA在0.05~0.3 mmol·L-1可提高胚根长和鲜重质量,相比NAS胚根长度提高了11.76%~45.1%(P<0.05),鲜 重 提 高 了28.57% ~64.29%(P<0.05),并且,GABA浓度在0.3 mmol·L-1时达到最大,为1.48 cm、0.23 g。

表2 GABA对盐、碱和盐碱胁迫下甘草种子生长指标的影响Tab.2 Effect exogenous GABA on seedling growth index of of G.uralensis under saline,alkaline,and saline-alkaline stresses
2.3 GABA对盐、碱和盐碱胁迫下甘草幼苗抗氧化酶活性的影响
由图1可知,盐胁迫处理显著增加了甘草幼苗内POD和CAT活性(P<0.05),外源GABA处理后的甘草幼苗内SOD和POD活性表现出先下降后上升再下降的变化趋势,且SOD在GABA浓度为0.2 mmol·L-1时活性 最 大,POD则在0.05 mmol·L-1的GABA时活性最大,与NS相比分别增加了8.82%(P<0.05),而CAT活性则表现为先上升后下降的趋势,GABA在0.2mmol·L-1时达到最大。
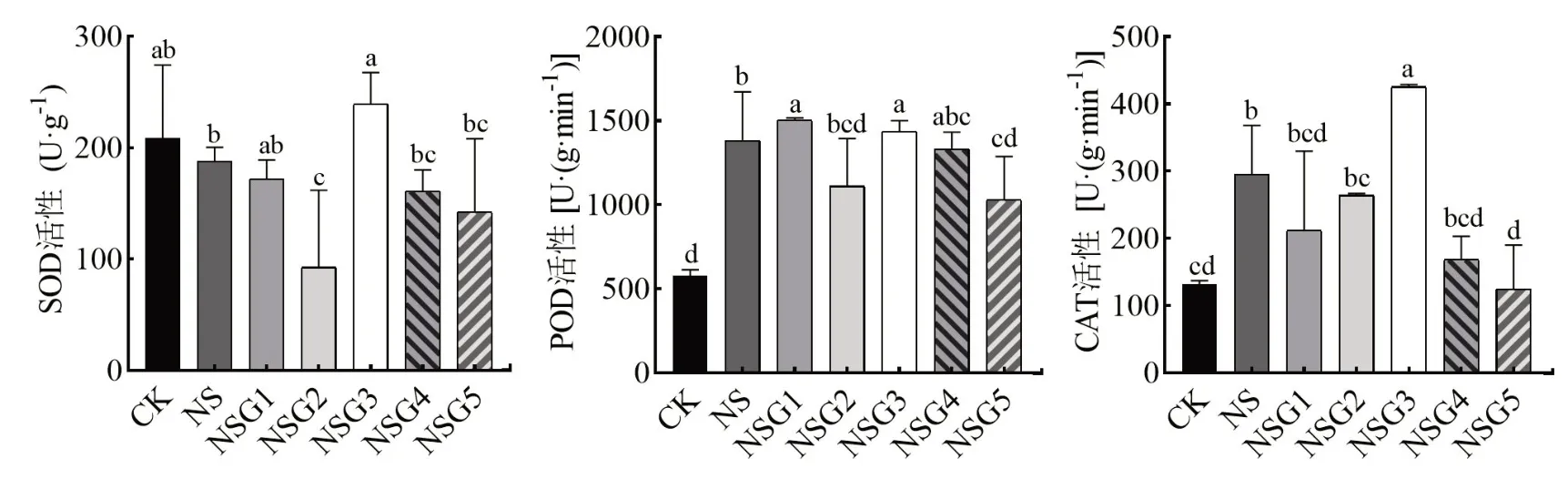
图1 GABA对盐胁迫下甘草幼苗抗氧化酶活性的影响Fig.1 Effect of melatonin on antioxidant enzyme activities of G.uralensis seedling under saline stress
由图2可知,与CK相比,碱胁迫处理显著抑制了SOD和POD活性(P<0.05),分别下降了24.03%、15.79%。外源施加不同浓度的GABA后SOD、POD和CAT活性大部分显著增加。其中,0.3 mmol·L-1的GABA处理下对POD和CAT活性的效果最为明显,是NS的1.77倍、4.48倍(P<0.05)。0.5 mmol·L-1的GABA处理显著提高了SOD活性,使其增加了18.25%(P<0.05)。
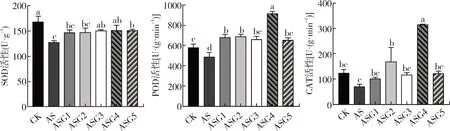
图2 GABA对碱胁迫下甘草幼苗抗氧化酶活性的影响Fig.2 Effect of melatonin on antioxidant enzyme activities of G.uralensis seedling under alkaline stress
由图3可知,与CK相比,盐碱胁迫处理下SOD和POD活性均显著增加(P<0.05),上升幅度分别为17.9%、55.67%。与NAS相比,SOD和POD活性随着GABA浓度的升高呈现出先下降后上升的变化趋势,且0.05、0.5mmol·L-1的GABA下达到最大,SOD活性增加了10.26%、12.9%(P<0.05),POD活性增加了16.87%、17.67%。CAT表现出随外源GA⁃BA浓度的增加而先上升后下降的变化趋势。GA⁃BA浓度在0.2、0.3mmol·L-1时达到最大,分别增加了19.50%、21.24%(P<0.05)。

图3 GABA对盐碱胁迫下甘草幼苗抗氧化酶活性的影响Fig.3 Effect of melatonin on antioxidant enzyme activities of G.uralensis seedling under saline-alkaline stresses
2.4 GABA、盐、碱和盐碱胁迫与种子萌发和幼苗生长参数的冗余分析
由图4A可知,FW、DW、CAT、POD与NAG1、NSG3、NS呈正相关,NSG4、NSG5与CL、SOD相关性强,GP、GF、GI、VI、RL、HL与CK、NSG2呈正相关,而NS与其呈负相关。由图4B得知,AS与SOD、CAT、POD、GP、GI、RL、HL、CL、DW呈负相关。ASG2、ASG4与GP、DW、POD和CAT相关性强,ASG5与GF、GI、VI、RL、HL、CL和SOD呈正相关。由图4C可知,NAS、NASG1、NASG3、NASG5与POD、CAT、SOD、HL、GF、GI呈正相关,NASG2和NASG4与FW、DW和GP呈正相关。

图4 外源GABA对盐(A)、碱(B)和盐碱胁迫(C)下甘草种子萌发和幼苗生长参数RDA二维排序图Fig.4 RDA sequence of exogenous GABA on germination and growth parametersof G.uralensis seeds under saline(A),alkaline(B)and saline-alkaline stressessaline-alkali stresses(C)
3 讨论与结论
植物的整个生育期中,种子萌发阶段是植物体生命的开始,也是植物生长最敏感和关键的阶段,这时期土壤盐分过高会严重抑制种子的萌发[19]。本实验研究结果表明,盐、碱和盐碱胁迫显著降低了甘草种子的发芽势、发芽指数和活力指数,并且抑制了甘草幼苗的胚根、胚轴和子叶的生长,这与王妍[20]等的研究结果一致。同时,本实验发现盐、碱和盐碱胁迫对种子的发芽率没有显著影响,据前人研究发现,甘草具有较强的抗寒、抗旱和抗盐碱能力,可在轻微的在盐碱地生长[16],因此推测在较高的盐碱环境下不影响甘草种子的萌发率,但是会阻碍早期幼苗的正常生长。本研究中,外源GABA可提高盐、碱和盐碱胁迫下甘草种子的发芽势、发芽指数和活力指数,这与前人研究表明GABA能够显著缓解铝胁迫对种子的伤害,提高铝胁迫下种子的发芽势、发芽指数、活力指数的结果一致[13]。此外,GABA可有效缓解三种胁迫对胚根、胚轴和子叶生长的抑制作用,其中0.2 mmol·L-1的GABA处理可促进盐碱胁迫下对甘草幼苗的胚根伸长和鲜重的积累,说明外源GABA具有加快盐碱胁迫下萌发期甘草种子生长进程的作用。有研究表明,外源GA⁃BA能缓解高温胁迫对水稻幼苗生长的抑制作用,并且可增加株高和根长的干物质,这与外源GABA增加內源GABA的含量有关[21]。此外,有研究发现,在低温、高温、盐和干旱等胁迫下,GABA含量增加的同时乙烯含量增加[22],说明了外源施加GABA后,种子萌发期在逆境胁迫下可积累一定的GABA,其能够促进乙烯的合成,以此来消减胁迫环境对种子萌发与幼苗生长的抑制作用。
植物在正常生长条件下,体内活性氧(Reactive oxygen species,ROS)的产生与清除处于动态平衡且不会对细胞膜造成伤害,当植物在低温、高温、干旱和盐碱等逆境时,这种动态平衡被打破,造成了ROS的大量积累,对细胞造成了不同程度的氧化伤害,同时植物体内会启动自生的抗氧化酶系统,以此来清除过多的ROS,增强植株抗逆性[23-24]。植物体内三种常见的抗氧化酶为SOD、POD和CAT,这三种酶活性的高低可直接反应植物耐逆境胁迫的能力。研究表明,GABA可通过调控植物的抗氧化防御系统来缓解其逆境胁迫[25],例如,王泳超[26]等在玉米种子耐盐性的研究中表明,盐胁迫导致玉米幼苗中丙二醛(MDA)和超氧阴离子(O2.-)含量升高,但用GABA浸种后有效降低了MDA和O2.-的升高幅度,且提高了盐胁迫下玉米幼苗内SOD、POD和CAT活性。本研究结果表明,在盐胁迫中,0.05 mmol·L-1的GABA可提高POD活性,0.2 mmol·L-1的GABA可提高SOD和CAT活性;在碱胁迫下,0.3 mmol·L-1的GABA处理后甘草种子发芽过程中SOD、POD和CAT活性均显著增加;盐碱胁迫处理后甘草幼苗内的SOD、POD和CAT活性均显著上升,说明了盐碱胁迫造成种子萌发过程中氧化伤害,甘草自身可以通过提高抗氧化酶活性以降低盐碱胁迫的伤害。冗余分析结果表明,不同胁迫下,GABA对甘草幼苗抗氧化酶活性的影响不同,其中,盐碱胁迫下0.05 mmol·L-1、0.2~0.5 mmol·L-1的GABA与SOD、POD、CAT三种酶活性相关性均很强,这与上述盐碱胁迫可提高甘草自身抗氧化酶活性的结果一致,同时,外源GABA可进一步使植物产生更多的抗氧化酶活性来抵御盐碱胁迫对种子萌发及幼苗生长的伤害。此外,王泳超[27]等研究发现,內源GABA含量与SOD、POD和CAT三种抗氧化酶活性呈显著正相关。Mahmud[28]等在芥菜对铬胁迫耐受性的研究中发现,GABA可上调酶类抗氧化剂,如谷胱甘肽还原酶(Glutathione reductase,GR)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、SOD、POD、CAT,以此减少氧化损伤。这说明了GABA可能作为一种信号分子通过上调抗氧化防御系统的酶活性,诱导有利于抗氧化酶活性的某些基因的表达。
综上所述,盐、碱和盐碱胁迫会抑制甘草早期幼苗生长。外源添加GABA提高种子的发芽势和活力指数,还可以通过提高SOD、POD和CAT活性来维持细胞内活性氧稳态,进而缓解盐碱胁迫对甘草早期幼苗的伤害。
