徐州地区354例耳聋患者耳聋基因筛查及基因谱分析
2022-04-19燕志强孙岩郑桐高盛宏张俊王青卢宇
燕志强孙岩郑桐高盛宏张俊王青卢宇
1陆军第七十一集团军医院/徐州医科大学附属淮海医院耳鼻咽喉-头颈外科(徐州 221004)
2四川大学华西医院罕见病研究院(成都 610041)
儿童听力下降,可导致语言和认知功能发育迟缓;成年人听力下降,对学业、工作及社会交流都会有很大影响。耳聋患者往往会受到旁人的歧视并被社会所孤立,这些问题给他们的身心健康带来极大损害。此外,耳聋的治疗、康复及教育所需要的费用对耳聋家庭及国家社会也是一项沉重的负担。因此,防聋治聋仍然是我国目前面临的一项重大的医学问题和社会问题。
遗传因素是先天性耳聋的主要致病原因,也存在明显的异质性。目前已发现的非综合征型耳聋基因110个,其中常染色体显性遗传非综合征型聋(DFNA)基因45个,常染色体隐性遗传非综合征型聋(DFNB)基因70个,10个既表现为DFNA,又表现为 DFNB(COL11A2、GJB2、GJB6、MYO3A、MYO6、MYO7A、PTPRQ、TBC1D24、TECTA、TMC1),X-连锁遗传非综合征型聋(DFNX)基因5个[1]。迄今为止已发现400多个遗传综合征伴有听力障碍[2,3]。及时准确的鉴别出耳聋患者的致病原因是否与遗传因素有关,哪些基因变异导致了耳聋,如何有效地阻断耳聋基因的下一代遗传是耳科医师关注和研究的重点。由于临床耳聋基因芯片在技术上和普及性上的局限性,目前我国耳聋临床基因诊断仍有许多不足,许多检出的基因突变致病性不明,另外尚有更多的新致聋基因有待揭示。
本研究以聋校学生为主要研究对象,旨在探索提高耳聋基因诊断方法与策略,一方面提高诊断率,同时尽可能节省资源提升诊断效率。
1 材料与方法
1.1 研究对象
研究对象来自徐州地区的354名聋校学生,年龄3-22岁,女性111例,男性243例,均为汉族。经现场询问病史、专科查体及听力测试等方法,对聋校学生进行了集中调查收集资料,征求患者及家属同意并签署知情同意书采集血样,同时进行科普宣传及教育学习。所有患者家属均签署知情同意书。所有患者根据世界卫生组织WHO《障碍、残疾和残废的国际分类》(1997)听力损失分级标准,受检对象中3人为中度感音神经性聋,其余均为重度或极重度感音神经性聋。首先采用SNPscan技术对36个GJB2基因突变位点、77个SLC26A4基因突变位点以及2个mt DNA突变位点(m.1555A>G、m.1494C>T)进行检测,随后对基因诊断结果阴性病例采用大规模平行测序技术行158个耳聋相关基因检测。
1.2 提取DNA
所有受检对象采集外周血5ml备用,应用AxyPrep血基因组DNA中量试剂盒提取DNA。具体操作步骤按照说明书进行。
1.3 常见耳聋致病基因突变的检测
利用SNPscan技术采用联合设计的基因芯片对所有患者首先进行常见致病基因筛查,该基因芯片包含36个GJB2基因突变位点、77个SLC26A4基因突变位点、2个线粒体突变位点(m.1555A>G、m.1494C>T)。具体检测步骤参考操作说明书及先期报道[4]。
1.4 应用大规模平行测序方法检测158个耳聋基因
对常见耳聋致病基因诊断结果阴性结果患者,采用由袁慧军教授团队研发的耳聋基因大规模平行测序方法测定158个耳聋相关基因,其中包括已知非综合征型耳聋基因和常见综合征型耳聋基因。
步骤及方法简述如下:用安捷伦公司定制目标区域捕获试剂盒(Agilent Technologies,Santa Clara,CA,USA),根据试剂盒说明书(Agilent Technolo-gies,Santa Clara,CA,USA)进行基因组DNA建库。捕获了158个基因的所有外显子、侧翼区内含子和剪接区域。精确定量后,在Illumina HiSeq2000分析仪上对捕获的DNA片段进行测序。按照标准Illumina程序进行数据分析和生物信息学处理。使用BWA软件包(http://bio-bwa.sourceforge)将测序所得短片段序列与GRCh37/hg19参考基因组数据集比对,识别可能影响蛋白质功能的非同义候选突变,候选致病变异通过公共数据库和内部外显子组数据库中等位基因频率小于0.005进行筛选。
对新发现罕见变异的患者,收集家庭成员信息和血样,通过Sanger测序对候选致病突变进行基因分型,进行共分离分析。
2 结果
2.1 常见耳聋致病基因突变的检测
354例患者共检出113例(31.92%)携带GJB2基因致病突变,其中53例GJB2基因致病突变(14.97%)为复合杂合突变,60例(16.95%)GJB2基因突变为纯合突变;58例(16.38%)携带SLC26A4基因致病突变,其中SLC26A4基因复合杂合突变37例(10.45%),纯合突变21例(5.93%),另外有m.1555A>G均质性突变4例(1.13%),未发现m.1494C>T突变病例。
2.2 158个耳聋基因大规模平行测序检测
对初筛后未诊断的179例患者进行158个耳聋相关基因大规模平行测序检测,其中41例(11.58%,41/354)基因诊断阳性,共包括11个耳聋基因,其中GJB2基因3例,SLC26A4基因9例,MYO15A基因13例,CDH23基因5例,具体情况见表1。GJB2基因和SLC26A4基因分别较常见耳聋致病基因突变检测新增检出突变位点2个和10个。
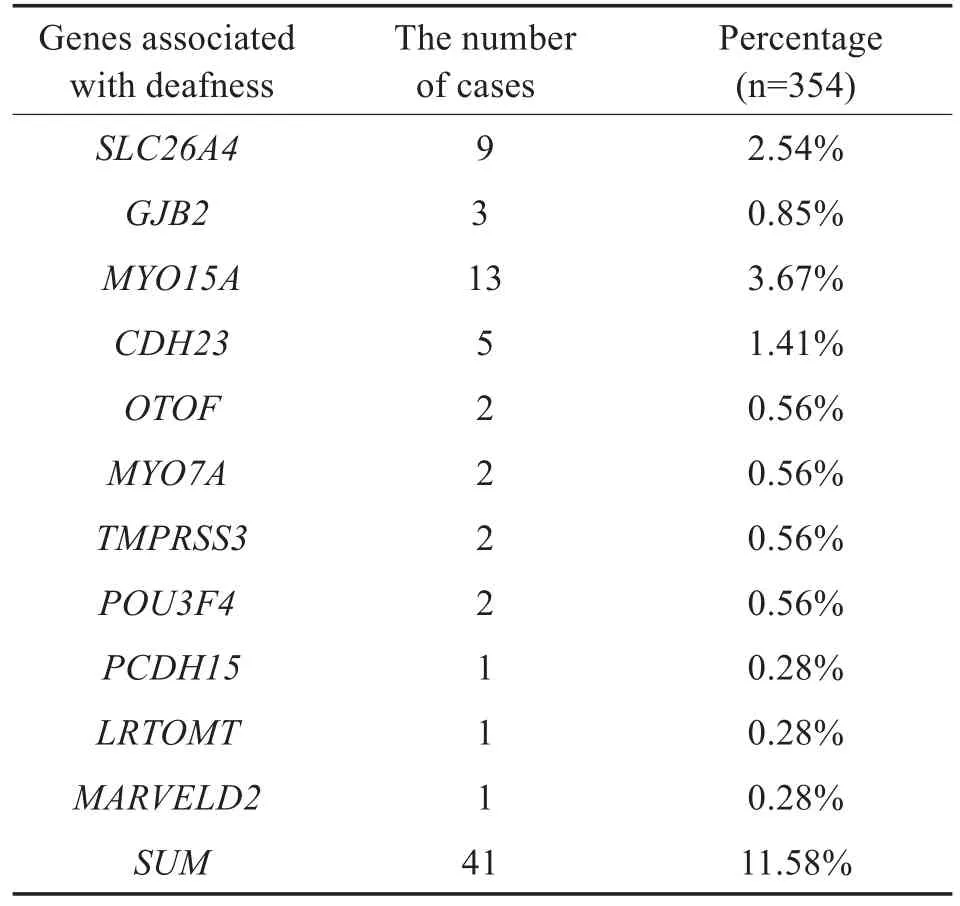
表1 复筛检测耳聋相关基因情况Table 1 The deafness related genes detected by secondary screening
2.3 基因谱及诊断率
经常见耳聋致病基因检测发现阳性患者175例,诊断率49.43%;应用大规模平行测序方法检测158个耳聋基因发现阳性病例41人,诊断率11.58%,累计阳性患者216人,诊断率61.02%。经两次检测共检出各种致病基因12个,其中GJB2、SLC26A4基因致病率分别高达32.77%(116/354)、18.93%(67/354),其余依次为MYO15A、CDH23、m.A1555G、MYO7A、OTOF、TMPRSS3、POU3F4、PCDH15、LR-TOMT及MARVELD2。徐州地区耳聋基因谱如图1。
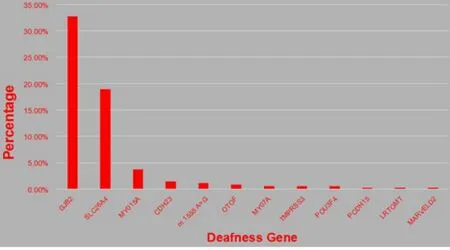
图1 徐州地区耳聋基因谱Fig.1 Gene spectrum of deafness in Xuzhou area
2.4 GJB2、SLC26A4基因位点突变频率
GJB2、SLC26A4基因是最常见的致聋基因,常见耳聋致病基因突变的检测共检出不同GJB2基因阳性突变位点10个,SLC26A4阳性突变位点18个,二次检测分别新增突变位点2个、8个,累计分别12、26个。GJB2基因突变频率最高的为c.235delC突变,共检出56例(48.28%,56/116)纯合突变患者,SLC26A4基因突变频率最高的为c.919-2A>G突变,共检出20例(20/77)纯合突变患者,各突变位点突变频率情况见下图2、3。
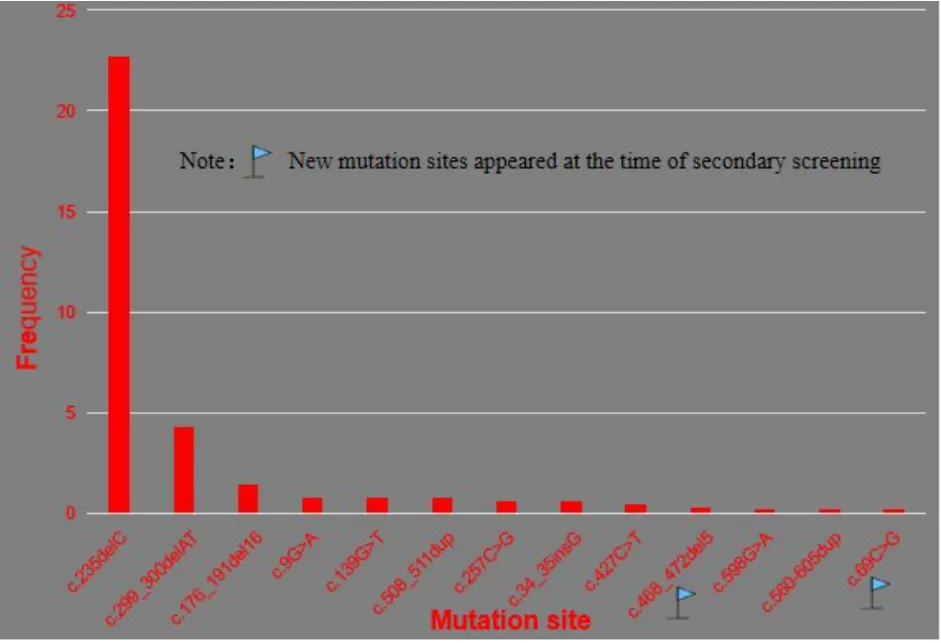
图2 GJB2各基因位点突变频率Fig.2 Mutation frequency of each locus of GJB2

图3 SLC26A4各基因位点突变频率Fig.3 Mutation frequency of each locus of SLC26A4
3 讨论
耳聋是临床常见疾病,也是常见的出生缺陷,是中国乃至全球重要的致残原因。遗传性耳聋约占先天性耳聋人群的60%,除人工耳蜗外目前尚无其它有效的治疗方法,尽管助听器和人工耳蜗技术取得了进步,但听觉的质量仍然无法模仿正常的耳朵[5]。现阶段,我们临床工作中遗传性耳聋基因诊断采用的芯片仅包含了中国人群最常见的突变热点,更全面的基因检测技术虽然能够检测出更多的基因,但是检出基因的一些变异是否致病仍不能确定,另外尚有更多的新致聋基因有待揭示和探索。这些所面临的问题及困难给我们提出了挑战,促使我们必须积极应对,寻找简便、快速、低成本、高通量的遗传性耳聋筛查方法及诊断技术,提高诊断率,对于阻断其遗传通路,预防其发生将起到十分关键的作用。
本研究中我们分两阶段先后对常见耳聋致病基因进行初筛,158个耳聋相关基因复筛检测模式,后期我们拟通过全外显子测序鉴定致病基因,以期发现新的致病基因及突变,提高诊断率。
本研究通过对354名先天性耳聋患者进行基因学分析,结果显示本地区耳聋基因诊断率较高的分别为GJB2>SLC26A4>MYO15A>CDH23>12SrRNA,诊断率分别为32.77%、18.93%、3.67%、1.41%及1.13%。其中采用大规模平行测序检测158个耳聋相关基因二次检测检出了41例(11.58%)患者的致病基因。
本研究中共检测了两种线粒体耳聋相关基因突变,仅有m.1555A>G发现4例患者,这些患者大多具有明确的氨基甙糖甙类药物用药史,为遗传因素和环境因素相互作用致病。m.1494C>T基因突变发病率低,分布较局限,本研究没有发现m.1494C>T阳性患者,提示m.1555A>G是本地主要的线粒体耳聋基因突变形式。m.1555A>G在各个地区的致病率差异较大,本研究结果提示m.1555A>G致病率为1.13%(4/354),相比较而言处于较低水平[6]。
在第二阶段新发现的基因突变既有常见致病基因GJB2、SLC26A4,还有其他9个耳聋相关基因,这些相关基因致病率相对于GJB2、SLC26A4基因普遍偏低,但MYO15A、CDH23基因致病率处于相对较高水平,在本组病例中高于12SrRNA(m.1555A>G)致病率。通过这些检测有助于我们了解本地区耳聋基因分布情况,绘制本地区耳聋基因突变谱,并与其它地区进行对照,发现地区间的差异,从而对后续其他患者的检测提供指导和借鉴具有重要的科学意义。
Reiisi等报道在全球范围内,常染色体隐性遗传非综合征型耳聋基因最常见的致病基因依次为GJB2、SLC26A4、MYO15A、OTOF和CDH23[7]。袁永一等针对中国患者的一项研究显示常染色体隐性遗传非综合征型耳聋基因最常见的致病基因依次为GJB2、SLC26A4、12SrRNA、MYO15A、POU3F4和USH2A[8]。这些结果与本研究结果基本一致,其中OTOF基因在本研究中致病率偏低,而MYO15A基因致病率在本地区较高,这些结果表明耳聋基因在中国人群中的致病形式大致相似,但也存在一定的地区差异性。
本研究结果提示GJB2基因在本地区的主要突变形式是c.235delC,其次是c.299_300delAT、c.176_191del16。戴朴等对北京市180,469名新生儿行基因筛查结果亦提示,此三种突变热点是主要突变形式,携带率分别为1.80%、0.50%、0.12%[9]。在许多西方种群中,c.35delG为GJB2基因的主要突变热点,c.167delT在德系犹太人中很常见;而在印度和巴基斯坦血统的个体中,c.71G>A是常见的GJB2基因突变[10-12]。SLC26A4基因是仅次于GJB2基因的耳聋致病基因,检测结果显示本地区SLC26A4基因主要突变形式是c.919-2A>G,其次是c.2168A>G及c.1229C>T,与国内之前的报道基本一致[13]。戴朴等对北京市180,469名新生儿行基因筛查结果亦提示c.919-2A>G、c.2168A>G携带率分别为1.34%、0.27%[9]。研究显示伊朗人群SLC26A4基因主要突变热点为c.1334T>G,捷克种群中最常见的突变为c.412G>T,而c.707T>C、c.1246A>C、c.1001+1G>A主要在白种人中检测到,c.2168A>G是韩国人中主要突变热点,c.1826T>G和c.1001+1G>A突变则分别在南美和北美的失聪人群中为主要发现,显示出显著的地区及种族差异[14,15]。本研究在二次检测时确诊了共12例GJB2和SLC26A4基因致病的病例,其中11例在初筛中检出为携带者,说明在本地区的筛查中选择GJB2基因235delC和SLC26A4基因c.919-2A>G热点突变可以有效检出和发现患者的可疑病因,同时也提示在耳聋患者的筛查中发现杂合突变,应当进一步检测明确遗传性病因。本研究二次检测的突变谱提示可将SLC26A4基因c.1001+5G>C纳入徐州地区初筛热点突变范围,以进一步提高初筛检出率。
本研究显示首先通过常见致病基因及热点突变位点的初步筛查,筛查阴性耳聋患者再次行耳聋相关基因筛查检测策略,显著提高了遗传耳聋患者致病基因诊断率。同时对于更为全面的了解本地区耳聋患者的耳聋致病基因突变谱也有重要的科学意义。对于经二次检测均阴性患者,我们拟进行全外显子测序,这对于进一步全面了解耳聋致病基因有重要意义。
