基于Akt/GSK-3β通路研究紫檀茋对脑缺血再灌注大鼠脑保护作用及血管内皮间质过度转化的影响
2022-04-19白方会刘圆方温昌明
汪 宁,高 军,白方会,刘圆方,温昌明*
基于Akt/GSK-3β通路研究紫檀茋对脑缺血再灌注大鼠脑保护作用及血管内皮间质过度转化的影响
汪 宁1,高 军1,白方会1,刘圆方2,温昌明1*
1. 南阳市中心医院 神经内科脑血管病介入病区,河南 南阳 473000 2. 南阳市中心医院 儿外科,河南 南阳 473000
研究紫檀茋对脑缺血再灌注大鼠的脑保护作用,并考察其对血管内皮间质过度转化与蛋白激酶B/糖原合成激酶-3β(protein kinase B/glycogen synthesizing kinase-3β,Akt/GSK-3β)通路的影响。建立脑缺血再灌注大鼠模型,给予紫檀茋和硫酸氢氯吡格雷片干预6 d后,检测大鼠神经功能缺损程度;采用ELISA法检测各组大鼠血清血小板活化因子(platelet activating factor,PAF)、血小板源性CD40配体(CD40L)和血小板P选择素(P-slelctin,CD62P)水平;采用试剂盒检测各组大鼠脑组织超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)水平;采用苏木素-伊红(HE)染色法观察各组大鼠脑皮质病理变化;采用免疫荧光染色法检测各组大鼠脑血管内皮和间质标志物血小板-内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1,PECAM-1,又名CD31)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达;采用Western blotting法检测各组大鼠脑血管CD31、α-SMA和脑皮质Akt和GSK-3β蛋白表达情况;采用免疫组化法检测各组大鼠脑皮质Akt和GSK-3β蛋白表达。与假手术组比较,模型组大鼠神经功能缺损评分显著升高(<0.05);血清PAF、CD40L和CD62P水平显著升高(<0.05);脑组织SOD活性显著降低,MDA水平升高(<0.05);脑皮质细胞形态破坏,呈空泡样坏死,细胞间隙增大,染色变浅,残存细胞体积缩小,细胞核固缩、深染,细胞边界不清;脑血管CD31表达减弱,α-SMA表达增强;脑血管CD31和脑皮质p-Akt、p-GSK-3β蛋白表达水平显著降低(<0.05),脑血管α-SMA蛋白表达水平显著升高(<0.05)。与模型组比较,各给药组大鼠神经功能缺损评分显著降低(<0.05);血清PAF、CD40L和CD62P水平降低(<0.05);脑组织SOD活性升高(<0.05),MDA水平降低(<0.05);脑皮质细胞形态、排列、细胞核清晰度以及间质染色均匀度等均改善;脑血管CD31表达增强,α-SMA表达减弱;脑血管CD31和脑皮质p-Akt、p-GSK-3β蛋白表达水平显著升高(<0.05),脑血管α-SMA蛋白表达水平显著降低(<0.05)。紫檀茋对脑缺血再灌注大鼠具有脑保护作用,可抑制血管内皮-间质过度转化,其作用机制可能与激活Akt/GSK-3β通路有关。
紫檀茋;脑缺血再灌注;血管内皮-间质过度转化;蛋白激酶B;糖原合成激酶-3β
缺血性脑血管病为常见中枢神经系统疾病,以脑血液循环障碍为主要特征。脑缺血再灌注是指缺血性脑血管病患者脑部缺血一段时间后恢复血供,但脑功能非但没有恢复,反而出现更严重的脑机能障碍的现象[1]。脑缺血再灌注损伤是一个复杂的动态生理病理过程,主要原因是氧化应激损伤、细胞炎症损伤等造成病理级联反应[2]。Pan等[3]发现缺血性脑血管疾病与个体血小板功能异常有关;Chen等[4]发现缺血性脑血管病可诱导血管的内皮间质转化与血管纤维化,并认为内皮间质转化是脑血管病的潜在治疗靶点。脑缺血再灌注后过量自由基攻击重获血液供应的组织细胞,导致脑血管内皮细胞受损,发生内皮间质转化。
紫檀茋是白藜芦醇同系衍生物,是从黑莓、蓝莓等浆果中提取的一类非黄酮类多酚化合物。Song等[5]发现紫檀茋可抑制肝细胞上皮-间质转化;Malik等[6]发现紫檀茋可减少氧化应激性损伤;Liu等[7]经动物实验发现紫檀茋可通过抗炎减轻脑缺血再灌注损伤。蛋白激酶B(protein kinase B,Akt)/糖原合成激酶-3β(glycogen synthasc kinase-3β,GSK-3β)信号通路参与调节细胞凋亡,其中GSK-3β是一种进化保守的丝氨酸/苏氨酸激酶,可调节细胞分化、增殖和凋亡等生物学行为,在脑缺血再灌注时可诱导细胞凋亡,放大级联反应,加重脑血管细胞凋亡损伤。本研究旨在探究紫檀茋对脑缺血再灌注损伤大鼠的脑保护作用,并考察其对血管内皮间质转化的影响。
1 材料
1.1 动物
SPF级雄性SD大鼠60只,7周龄,体质量260~270 g,购自北京斯贝福生物技术有限公司,生产许可证号SCXK(京)2019-0010。动物饲养于动物房,温度24~26 ℃,相对湿度40%~60%,昼夜周期为12 h,自由摄食饮水,实验开展前适应性饲养1周。动物实验操作均符合3R原则,经实验动物伦理委员会批准(批准号2020042216-007)。
1.2 药品与试剂
紫檀茋(质量分数98.0%,批号20190811)购自宝鸡市国康生物科技有限公司,用时以含0.5%聚山梨酯80的生理盐水溶解成混悬液;硫酸氢氯吡格雷片(批号20191105)购自深圳信立泰药业股份有限公司,用时研碎成粉末,溶于蒸馏水,超声溶解定容到1 mg/mL;大鼠血小板活化因子(platelet activating factor,PAF)、血小板源性CD40配体(CD40L)和血小板P选择素(P-slelctin,CD62P)ELISA试剂盒购自上海科顺生物科技有限公司,批号分别为20190513、20190814、20191108;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号20190712)、丙二醛(malondialdehyde,MDA)试剂盒(批号20190917)购自南京建成生物工程研究所;尼龙线栓购自北京西浓科技有限公司;HRP标记的山羊抗兔IgG抗体(批号ab6721)、荧光血小板-内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1,PECAM-1,又名CD31)抗体(批号ab28364)、荧光α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号ab232784)、Alexa Fluor 488偶联的驴抗兔二抗(批号ab150077)、兔抗大鼠蛋白激酶B(protein kinase B,Akt)抗体、磷酸化Akt(phosphorylated Akt,p-Akt)抗体、糖原合成激酶-3β(glycogen synthasc kinase-3β,GSK-3β)抗体、p-GSK-3β抗体、CD31抗体、α-SMA抗体、GAPDH抗体(批号分别为ab8805、ab18785、ab141295、ab145937、ab108424、ab8425、ab9485)购自英国Abcam公司。
1.3 仪器
Infinite M20 Pro多功能酶标仪(瑞士Tecan公司);Light Cycler 96 qRT-PCR仪(瑞士Roche公司);Kestrel 200型光学测量显微镜(英国Vision公司);PowerPacUniversal通用电泳仪(美国Bio-Rad公司)。
2 方法
2.1 造模、分组及给药
取50只大鼠建立脑缺血再灌注大鼠模型[8]:大鼠麻醉后,在颈部正中取切口,暴露右颈内、外动脉以及总动脉,眼科剪将颈总动脉剪1个小口,插入线栓直至颈内动脉,深度为距离动脉分叉2 mm,结扎颈内动脉,栓塞2 h后拔出线栓。剩余10只大鼠作为假手术组,其操作同上,但不实施栓塞处理。拔出线栓再灌注24 h,大鼠清醒后,参考Zea-Longa评分法[9]评估大鼠神经功能缺损程度,评分为1~3分表示造模成功,纳入实验。共40只大鼠造模成功,随机分为模型组及紫檀茋低、高剂量(5、10 mg/kg)[10]组和硫酸氢氯吡格雷(6.8 mg/kg)组,每组10只。各给药组ip相应药物,模型组和假手术组ip含0.5%聚山梨酯80的生理盐水,1次/d,连续6 d。
2.2 神经行为学检测
末次给药2 h后,参考Zea-Longa神经功能缺损评分标准[9],评估大鼠神经行为学。评分标准:无神经功能缺损征象为0分,提尾时病灶对侧前肢收缩为1分,向瘫痪侧旋转为2分,向病灶对侧跌倒为3分,无自发活动和意识障碍为4分。
2.3 ELISA检测血清PAF、CD40L和CD62P水平
完成神经行为学检测后处死大鼠,腹主动脉采血10 mL,离心取血清,于−80 ℃保存备用。按照ELISA试剂盒说明书测定大鼠血清PAF、CD40L和CD62P水平。
2.4 脑组织SOD活性和MDA水平的检测
各组大鼠采血后,断头取脑,快速冲洗后滤纸吸干水分,于冰上快速分离右侧额极后3~5 mm处大脑皮层,用超声波细胞粉碎机制成组织匀浆,3500 r/min离心15 min,取上清液,按照试剂盒说明书采取黄嘌呤氧化酶法检测脑组织SOD活性,硫代巴比妥酸法检测MDA水平。
2.5 苏木素-伊红(HE)染色观察大鼠脑皮质病理变化
取各组大鼠脑组织,于4%多聚甲醛固定2 d,梯度乙醇脱水后石蜡包埋,制作4 μm厚的石蜡切片,进行HE染色,经脱水、透明后,中性树胶封片,于显微镜下观察脑皮质组织染色结果。
2.6 免疫荧光染色法检测大鼠脑血管内皮和间质标志物CD31和α-SMA表达
取大鼠脑组织石蜡切片,脱蜡至水,二甲苯透明,梯度乙醇脱水,TBS冲洗,进行抗原修复,加入3% H2O2阻断,用10%山羊血清封闭30 min,弃血清,滴加50 μL CD31抗体(1∶800),4 ℃孵育过夜;TBST冲洗,滴加50 μL HRP标记的山羊抗兔IgG抗体(1∶4000),37 ℃孵育45 min;滴加50 μL CY3工作液(1∶200),室温孵育10 min;以pH 6.0柠檬酸抗原修复5 min,蒸馏水浸洗3 min,加入10%山羊血清,室温封闭30 min;弃血清,滴加50 μL α-SMA抗体(1∶200),4 ℃孵育过夜;滴加50 μL Alexa Fluor 488偶联的驴抗兔二抗(1∶400),37 ℃孵育45 min;滴加50 μL DAPI工作液(1∶500),避光染核5 min;加入荧光封片剂进行封片,避光保存。经荧光、明场扫描系统Tissue FAXS PLUS扫描,随机采集CD31/α-SMA阳性染色大鼠脑组织微血管照片,采用Image J软件测定α-SMA荧光强度,进行半定量分析。
2.7 Western blotting检测大鼠脑血管CD31和α-SMA蛋白表达
取各组大鼠脑血管组织,加入裂解液提取蛋白,加入上样缓冲液,沸水浴使蛋白变性,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,分别加入CD31、α-SMA和GAPDH抗体,孵育过夜;加入HRP标记的山羊抗兔IgG抗体,孵育1 h;加入ECL发光液显影,采用Image J软件检测蛋白条带灰度值。
2.8 免疫组化法检测大鼠脑组织Akt和GSK-3β蛋白表达
取各组大鼠脑组织石蜡切片,脱蜡至水,加柠檬酸,用微波炉进行抗原修复,加入3% H2O2室温孵育,分别加入Akt、GSK-3β抗体,孵育过夜;加入二抗孵育1 h,DAB染色,苏木素复染,脱水,透明,封片,于光学显微镜下观察并拍照。
2.9 Western blotting检测大鼠脑皮质Akt和GSK-3β蛋白表达
取假手术组、模型组和紫檀茋低、高剂量组大鼠脑皮质组织,按“2.6”项下方法提取蛋白,检测Akt、p-Akt、GSK-3β、p-GSK-3β蛋白表达情况。
2.10 统计学方法
3 结果
3.1 紫檀茋对脑缺血再灌注大鼠神经功能缺损评分的影响
如表1所示,与假手术组比较,模型组大鼠神经功能缺损评分显著升高(<0.05);与模型组比较,各给药组大鼠神经功能缺损评分显著降低(<0.05)。
3.2 紫檀茋对脑缺血再灌注大鼠血清PAF、CD40L和CD62P水平的影响
如表2所示,与假手术组比较,模型组大鼠血清PAF、CD40L和CD62P水平显著升高(<0.05);与模型组比较,各给药组大鼠血清PAF、CD40L和CD62P水平显著降低(<0.05)。
表1 紫檀茋对脑缺血再灌注大鼠神经功能缺损评分的影响(, n = 10)
Table 1 Effect of pterostilbene on scores of neurological deficits in rats with cerebral ischemia-reperfusion (, n = 10)
组别剂量/(mg·kg−1)评分 假手术—0 模型—3.44±0.39* 紫檀茋52.55±0.18# 101.96±0.22# 硫酸氢氯吡格雷6.81.14±0.11#
与假手术组比较:*<0.05;与模型组比较:#<0.05,下表同
*< 0.05sham group;#< 0.05model group, same as below tables
表2 紫檀茋对脑缺血再灌注大鼠血清PAF、CD40L和CD62P水平的影响(, n = 10)
Table 2 Effect of pterostilbene on PAF, CD40L and CD62P levels in serum of rats with cerebral ischemia-reperfusion (, n = 10)
组别剂量/ (mg·kg−1)PAF/(ng·mL−1)CD40L/(ng·mL−1)CD62P/(ng·mL−1) 假手术—0.03±0.0113.42±1.294.15±0.82 模型—0.18±0.03*30.45±2.78*11.49±1.18* 紫檀茋50.15±0.02#25.17±2.16#9.42±0.95# 100.11±0.02#20.39±1.47#7.58±0.81# 硫酸氢氯吡格雷6.80.07±0.01#16.88±1.12#6.55±0.45#
3.3 紫檀茋对脑缺血再灌注大鼠脑组织SOD活性和MDA水平的影响
如表3所示,与假手术组比较,模型组大鼠脑组织SOD活性显著降低(<0.05),MDA水平显著升高(<0.05);与模型组比较,各给药组大鼠脑组织SOD活性显著升高(<0.05),MDA水平显著降低(<0.05)。
3.4 紫檀茋对脑缺血再灌注大鼠脑皮质病理变化的影响
如图1所示,假手术组大鼠脑皮质区细胞形态完整,排列整齐,边缘清晰,细胞核与间质着色均匀;模型组大鼠脑皮质区细胞形态破坏,呈空泡样坏死,细胞间隙增大,染色变浅,残存细胞体积缩小,细胞核固缩、深染,细胞边界不清;与模型组比较,各给药组大鼠脑皮质细胞形态、排列、细胞核清晰度以及间质染色均匀度等均改善。
表3 紫檀茋对脑缺血再灌注大鼠脑组织SOD活性和MDA水平的影响(, n = 10)
Table 3 Effect of pterostilbene on SOD activity and MDA level in brain tissue of rats with cerebral ischemia-reperfusion (, n = 10)
组别剂量/(mg·kg−1)SOD/(U·mg−1)MDA/(mmoL·mg−1) 假手术—43.69±3.181.22±0.25 模型—24.99±2.47*3.88±0.41* 紫檀茋531.28±3.24#2.98±0.32# 1036.94±2.12#2.35±0.27# 硫酸氢氯吡格雷6.840.82±2.55#1.77±0.16#
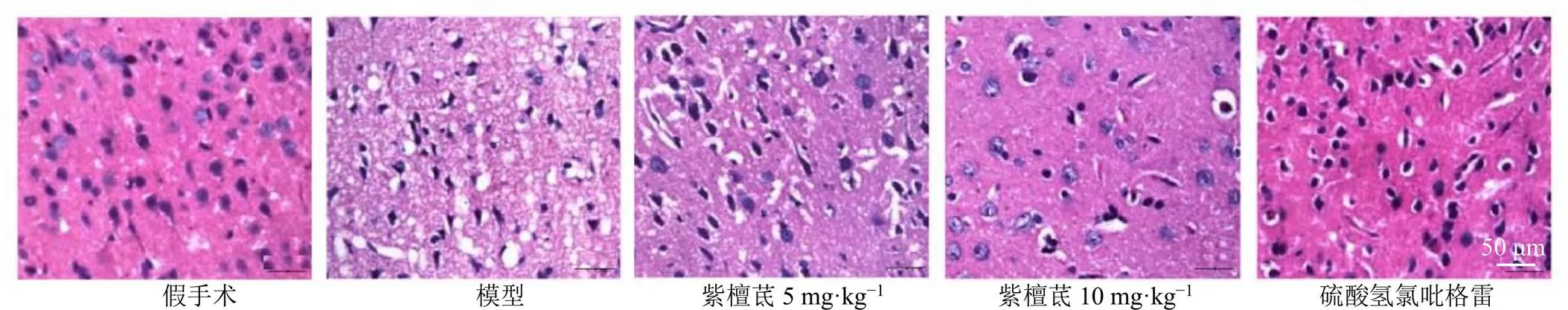
图1 紫檀茋对脑缺血再灌注大鼠脑皮质病理变化的影响(HE, ×400)
3.5 紫檀茋对脑缺血再灌注大鼠脑血管CD31和α-SMA蛋白表达的影响
CY3标记CD31为血管内皮细胞标记物,呈红色荧光;Alexa Fluor 488标记的α-SMA为血管间质细胞标记物,呈绿色荧光。如图2、3所示,与假手术组比较,模型组大鼠脑血管CD31表达减弱,α-SMA荧光强度显著升高(<0.05);与模型组比较,各给药组大鼠脑血管CD31表达增强,α-SMA荧光强度显著降低(<0.05)。Western blotting结果如图4和表4所示,与假手术组比较,模型组大鼠脑血管CD31蛋白表达水平显著降低(<0.05),α-SMA蛋白表达水平显著升高(<0.05);与模型组比较,各给药组大鼠脑血管CD31蛋白表达水平显著升高(<0.05),α-SMA蛋白表达水平显著降低(<0.05)。
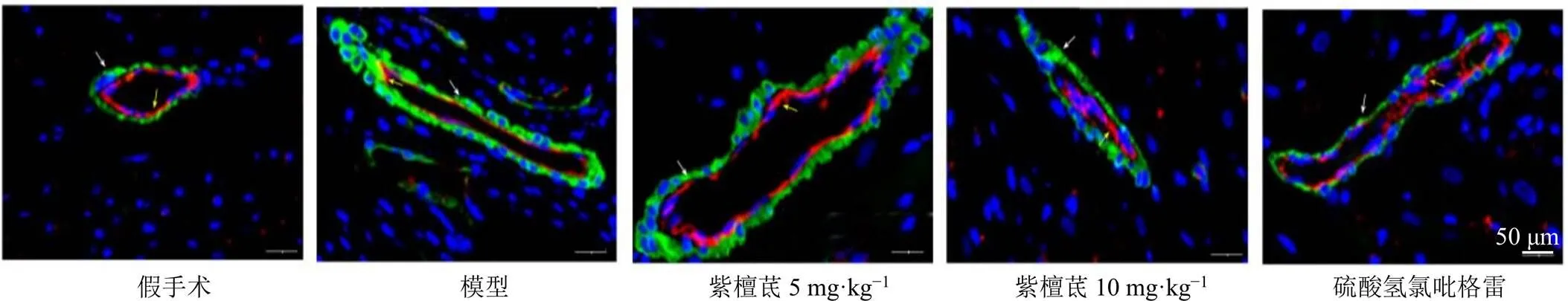
白色箭头为α-SMA阳性表达,黄色箭头为CD31阳性表达
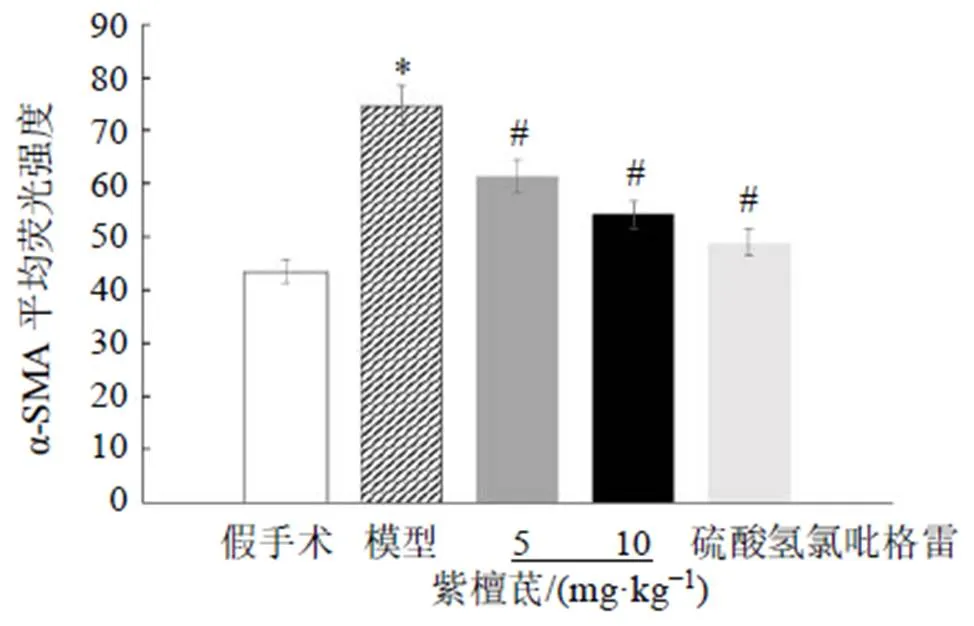
与假手术组比较:*P<0.05;与模型组比较:#P<0.05
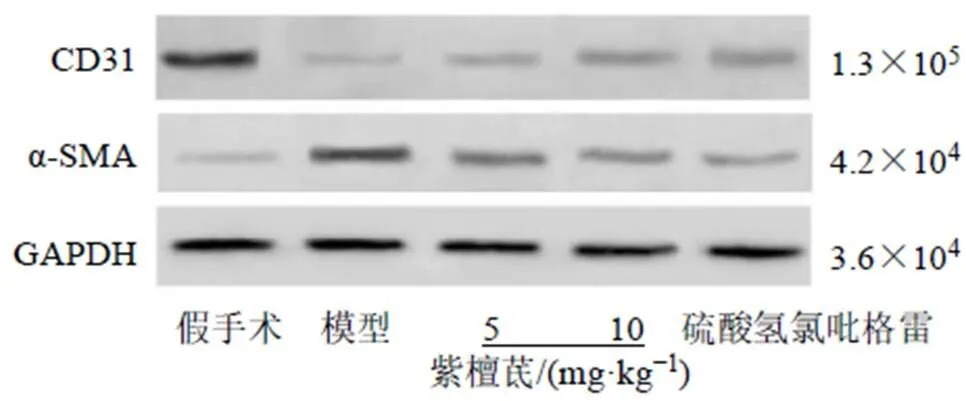
图4 Western blotting检测各组大鼠脑血管CD31和α-SMA蛋白表达
3.6 紫檀茋对脑缺血再灌注大鼠脑皮质Akt和GSK-3β蛋白表达的影响
免疫组化结果如图5所示,与假手术组比较,模型组大鼠脑皮质Akt、GSK-3β阳性表达较少;与模型组比较,紫檀茋组大鼠脑皮质Akt、GSK-3β阳性表达较多。Western blotting结果如图6和表5所示,各组大鼠脑皮质Akt、GSK-3β蛋白表达水平无统计学意义。与假手术组比较,模型组大鼠脑皮质p-Akt、p-GSK-3β蛋白表达水平显著降低(<0.05);与模型组比较,紫檀茋组大鼠脑皮质p-Akt、p-GSK-3β蛋白表达水平显著升高(<0.05)。
表4 紫檀茋对脑缺血再灌注大鼠脑血管CD31和α-SMA蛋白表达的影响(, n = 10)
Table 4 Effect of pterostilbene on CD31 and α-SMA protein expressions in cerebral blood vessels of rats with cerebral ischemia-reperfusion (, n = 10)
组别剂量/(mg·kg−1)蛋白相对表达量 CD31α-SMA 假手术—0.91±0.080.09±0.01 模型—0.16±0.02*0.89±0.07* 紫檀茋50.33±0.03#0.65±0.05# 100.45±0.03#0.36±0.04# 硫酸氢氯吡格雷6.80.66±0.04#0.21±0.03#
4 讨论
脑缺血再灌注损伤时,缺血大脑恢复血供后出现的脑部超微结构、功能与代谢等方面进一步损伤,是缺血性脑损伤的延续与恶化。随着对神经细胞死亡分子机制的深入研究,脑缺血后氧化应激损伤和炎症损伤已被证明是导致再灌注损伤的重要原因。紫檀茋作为一种天然、多功能抗氧化剂,可清除体内氧自由基,Keser等[11]研究表明紫檀茋在急性肾缺血再灌注损伤治疗中有辅助作用。故本研究选择紫檀茋为实验药物,为紫檀茋在脑缺血再灌注治疗中的应用提供理论基础。

图5 免疫组化法检测大鼠脑组织Akt和GSK-3β蛋白表达 (×400)
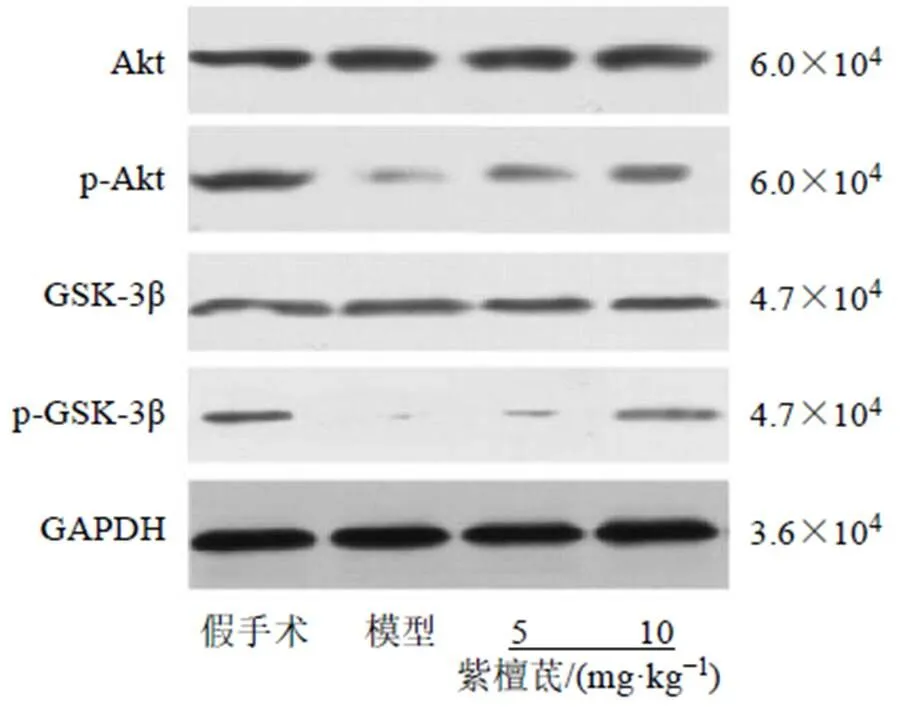
图6 紫檀茋对脑缺血再灌注大鼠脑皮质Akt和GSK-3β蛋白表达的影响
表5 紫檀茋对脑缺血再灌注大鼠脑皮质Akt和GSK-3β蛋白表达的影响(, n = 10)
Table 5 Effect of pterostilbene on Akt and GSK-3β protein expressions in brain cortex of rats with cerebral ischemia-reperfusion (, n = 10)
组别剂量/(mg·kg−1)蛋白相对表达量 Aktp-AktGSK-3βp-GSK-3β 假手术—0.93±0.130.85±0.090.81±0.080.49±0.04 模型—0.99±0.110.07±0.01*0.82±0.090.03±0.01* 紫檀茋50.97±0.120.15±0.03#0.79±0.090.11±0.02# 101.01±0.130.36±0.03#0.78±0.080.23±0.03#
动物神经功能变化是检测脑缺血再灌注大鼠模型的宏观指标,神经功能缺损评分可反映其神经系统破坏程度。本研究结果显示,紫檀茋组大鼠神经功能缺损评分低于模型组,提示紫檀茋可优化脑缺血再灌注大鼠的神经功能恢复效果。脑皮质是脑缺血再灌注容易损伤的区域,大鼠脑皮质的HE染色结果显示,与假手术组比较,模型组大鼠脑皮质细胞质、细胞核和细胞形态等均发生明显的病理改变,而紫檀茋组大鼠脑皮质细胞变性、坏死等病理改善,提示紫檀茋可减轻大鼠脑皮质细胞损伤,这对减少脑部神经细胞凋亡、保护神经功能有一定作用。Khan等[12]发现紫檀茋可通过抗氧化应激作用,改善全脑缺血再灌注和氧化损伤诱导的神经行为改变。脑缺血发生时脑组织氧供减少,产生大量自由基,引起神经元死亡,酶活性丧失。SOD为机体内重要的抗氧化酶,对体内抗氧化平衡有重要作用。MDA是脂质过氧化作用的产物,可反映脂质过氧化程度,间接反映了细胞受损程度。本研究发现,与模型组比较,紫檀茋组大鼠脑组织SOD活性增强,MDA水平降低,提示紫檀茋可减轻大鼠脑组织氧化应激损伤。Chen等[13]发现血小板活化与脑缺血再灌注损伤的发生有关。PAF为内源性磷酸介质,Belayev等[14]研究表明PAF可诱导血小板聚集,快速促进血小板活化。CD40L是肿瘤坏死因子超家族成员,血清中CD40L含量升高是血小板活化标志,也是预测心脑血管事件的独立指标。CD62P为选择素家族成员,是血小板活化的高灵敏度、特异度指标之一。本研究结果显示,紫檀茋组大鼠血清PAF、CD40L和CD62P水平低于模型组,提示紫檀茋可抑制血小板活化。除血小板活化外,血管功能的稳定性也是脑缺血再灌注发生的重要原因。脑缺血后,内皮细胞脱离血管内皮,经内皮间质转化为肌成纤维细胞,导致血管周围间质中产生大量细胞外基质,从而产生间质细胞,减弱内皮功能,破坏血管微环境,减少血供。因此,保护血管内皮细胞、减轻内皮间质转化程度,可能对缺血再灌注的脑组织有益。为考察紫檀茋对大鼠脑血管内皮间质转化的影响,进行CD31/α-SMA免疫荧光染色,发现紫檀茋组大鼠脑血管CD31表达增强,α-SMA表达减弱,且经半定量检测发现α-SMA荧光强度降低,提示紫檀茋对内皮间质转化有抑制作用。
Akt信号通路是膜受体信号向细胞内传导的主要途径转移,在心、肺等多种器官缺血再灌注损伤中发挥了抑制细胞凋亡的作用[15-16]。Akt蛋白是一种在脑缺血后发挥保护作用的促生存激酶,可通过磷酸化Ser473残基而激活,从而磷酸化其下游蛋白如GSK-3β。GSK-3β是广泛存在于生物体内的多功能丝氨酸/苏氨酸蛋白激酶,被激活后,可抑制线粒体通透性转换孔开口,减少线粒体膜电位,从而减少自由基产生,发挥抗氧化应激作用。Li等[17]发现脑缺血再灌注损伤的改善与Akt/GSK-3β的激活有关,Li等[18]发现Akt可能是结肠癌细胞中上皮间质转化的关键调节因子,白藜芦醇可能通过Akt/GSK-3β/Snail信号通路逆转上皮间质转化。本研究结果显示,与假手术组比较,模型组大鼠脑组织p-Akt、p-GSK-3β蛋白表达水平降低,提示脑缺血再灌注的发生抑制了大鼠脑组织Akt、GSK-3β蛋白表达;与模型组比较,紫檀茋组大鼠脑组织p-Akt、p-GSK-3β蛋白表达水平升高,提示紫檀茋可促进p-Akt、p-GSK-3β蛋白磷酸化,激活Akt/GSK-3β通路,从而减轻氧化应激损伤,抑制血小板活化和内皮间质转化,发挥脑保护作用,这可能是其改善脑缺血再灌注损伤的作用机制。
综上所述,紫檀茋可能通过激活Akt/GSK-3β通路,从而发挥对脑缺血再灌注损伤大鼠的脑保护作用,并抑制脑血管内皮间质转化。
利益冲突 所有作者均声明不存在利益冲突
[1] Liao Y J, Cheng J B, Kong X X,. HDAC3 inhibition ameliorates ischemia/reperfusion-induced brain injury by regulating the microglial cGAS-STING pathway [J]., 2020, 10(21): 9644-9662.
[2] Li X G, Cheng S L, Hu H,. Progranulin protects against cerebral ischemia-reperfusion (I/R) injury by inhibiting necroptosis and oxidative stress [J]., 2020, 521(3): 569-576.
[3] Pan Y S, Elm J J, Li H,. Outcomes associated with clopidogrel-aspirin use in minor stroke or transient ischemic attack: A pooled analysis of clopidogrel in high-risk patients with acute non-disabling cerebrovascular events (CHANCE) and platelet-oriented inhibition in new TIA and minor ischemic stroke (POINT) trials [J]., 2019, 76(12): 1466-1473.
[4] Chen D Q, Li L, Wang Y,. Ischemia-reperfusion injury of brain induces endothelial-mesenchymal transition and vascular fibrosis via activating let-7i/TGF-βR1 double-negative feedback loop [J]., 2020, 34(5): 7178-7191.
[5] Song L, Chen T Y, Zhao X J,. Pterostilbene prevents hepatocyte epithelial-mesenchymal transition in fructose- induced liver fibrosis through suppressing miR-34a/Sirt1/ p53 and TGF-β1/Smads signalling [J]., 2019, 176(11): 1619-1634.
[6] Malik S A, Acharya J D, Mehendale N K,. Pterostilbene reverses palmitic acid mediated insulin resistance in HepG2 cells by reducing oxidative stress and triglyceride accumulation [J]., 2019, 53(7): 815-827.
[7] Liu J Y, Xu J K, Mi Y,. Pterostilbene alleviates cerebral ischemia and reperfusion injury in rats by modulating microglial activation [J]., 2020, 11(6): 5432-5445.
[8] 余智, 于民, 顾苏兵, 等. [Gly14]-Humanin对大鼠局灶性脑缺血再灌注损伤的影响及其机制研究 [J]. 中国康复医学杂志, 2019, 34(5): 515-520.
[9] Xiao Q X, Wen S, Zhang X R,. miR-410-3p overexpression ameliorates neurological deficits in rats with hypoxic-ischemic brain damage [J]., 2020, 162: 218-230.
[10] 田士来, 康军林, 魏玉娥, 等. 紫檀茋对小鼠缺血性脑损伤的神经保护机制研究 [J]. 神经解剖学杂志, 2020, 36(1): 71-76.
[11] Keser H, Bozkurt Girit Ö, Majeed M,. Pterostilbene administration improves the recovery potential of extremely low-frequency magnetic field in acute renal ischemia-reperfusion injury: An FTIR spectroscopic study [J]., 2020, 44(1): 48-60.
[12] Khan M M, Badruddeen, Ahmad U,. Cerebroprotective effect of pterostilbene against global cerebral ischemia in rats [J]., 2021, 7(5): e07083.
[13] Chen F F, Wang M M, Xia W W,. Tao-Hong-Si-Wu Decoction promotes angiogenesis after cerebral ischaemia in rats via platelet microparticles [J]., 2020, 18(8): 620-627.
[14] Belayev L, Obenaus A, Mukherjee P K,. Blocking pro-inflammatory platelet-activating factor receptors and activating cell survival pathways: A novel therapeutic strategy in experimental ischemic stroke [J]., 2020, 6(4): 260-268.
[15] Liang S, Wang Y, Liu Y. Dexmedetomidine alleviates lung ischemia-reperfusion injury in rats by activating PI3K/Akt pathway [J]., 2019, 23(1): 370-377.
[16] Yu P, Ma S C, Dai X C,. Elabela alleviates myocardial ischemia reperfusion-induced apoptosis, fibrosis and mitochondrial dysfunction through PI3K/ AKT signaling [J]., 2020, 12(8): 4467-4477.
[17] Li M, Gao W W, Liu L,. The Akt/glycogen synthase kinase-3β pathway participates in the neuroprotective effect of interleukin-4 against cerebral ischemia/ reperfusion injury [J]., 2020, 15(9): 1716-1723.
[18] Li Y, Zhou M M, Huang D W,. Resveratrol inhibits the invasion and metastasis of colon cancer through reversal of epithelial‑mesenchymal transition via the AKT/ GSK‑3β/Snail signaling pathway [J]., 2019, 20(3): 2783-2795.
Effect of pterostilbene on brain protection and vascular endothelial mesenchymal transition in rats with cerebral ischemia-reperfusion based on Akt/GSK-3β pathway
WANG Ning1, GAO Jun1, BAI Fang-hui1, LIU Yuan-fang2, WEN Chang-ming1
1. Interventional Ward of Cerebrovascular Disease, Department of Neurology, Nanyang Central Hospital, Nanyang 473000, China 2. Department of Pediatric Surgery, Nanyang Central Hospital, Nanyang 473000, China
To study the cerebral protective effect of pterostilbene on cerebral ischemia-reperfusion rats, and investigate its effect on vascular endothelial mesenchymal transition and protein kinase B/glycogen synthesizing kinase-3β (Akt/GSK-3β) pathway.A rat model of cerebral ischemia-reperfusion was established, and after 6 d of intervention with pterostilbene and clopidogrel hydrogen sulfate tablets, degree of neurological deficit in rats was detected; Platelet activating factor (PAF), platelet-derived CD40 ligand (CD40L) and platelet P-selectin (CD62P) levels in serum were detected by ELISA; Kits were used to detect superoxide dismutase (SOD) activity and malondialdehyde (MDA) level in brain tissue of rats in each group; Hematoxylin-eosin (HE) staining was used to observe the pathological changes of cerebral cortex of rats in each group; Immunofluorescence staining was used to detect the cerebral vascular endothelial and interstitial markers platelet endothelial cell adhesion molecule-1 (PECAM-1, also known as CD31) and α-smooth muscle actin (α-SMA) expressions of rats in each group; Western blotting was used to detect CD31 and α-SMA protein expressions in cerebrovascular, Akt and GSK-3β protein expressions in cerebral cortex of rats; Akt and GSK-3β expressions in cerebral cortex of rats in each group were detected by immunohistochemistry.Compared with sham group, neurological deficit score of rats in model group was significantly increased (< 0.05); Levels of PAF, CD40L and CD62P in serum were significantly increased (< 0.05); SOD activity in brain tissue was significantly decreased, and MDA level was increased (< 0.05); Cerebral cortical cells were morphologically damaged, showing vacuolar necrosis, intercellular space was increased, staining was lighted, residual cell volume was reduced, nuclei were pyknotic and hyperchromatic, and cell boundaries were unclear; CD31 expression in cerebral blood vessels was weakened, α-SMA expression was enhanced; CD31 protein expression in cerebrovascular, p-Akt and p-GSK-3β protein expressions in cerebral cortex of rats were significantly decreased (< 0.05), α-SMA protein expression in cerebrovascular was significantly increased (< 0.05). Compared with model group, neurological deficit score of rats in each administration group were significantly decreased (< 0.05); Levels of PAF, CD40L and CD62P in serum were decreased (< 0.05); SOD activity in brain tissue was increased (< 0.05), MDA level of cerebral cortex was decreased (< 0.05); Morphology, arrangement, nuclear clarity and interstitial staining uniformity of cerebral cortex were improved; CD31 expression in cerebral blood vessels was increased, and α-SMA expression was decreased; CD31 protein expression in cerebrovascular, p-Akt and p-GSK-3β protein expressions in cerebral cortex of rats were significantly increased (< 0.05), α-SMA protein expression in cerebrovascular was significantly decreased (< 0.05).Pterostilbene has cerebral protective effect on cerebral ischemia-reperfusion rats, and can inhibit the excessive transition of vascular endothelium to mesenchyme, and its mechanism may be related to the activation of Akt/GSK-3β pathway.
pterostilbene; cerebral ischemia-reperfusion; endothelial-mesenchymal excessive transition; protein kinase B; glycogen synthesis kinase-3β
R285.5
A
0253 - 2670(2022)08 - 2399 - 08
10.7501/j.issn.0253-2670.2022.08.017
2021-12-24
河南省科技发展计划项目(192102310349)
汪 宁(1983—),男,硕士,副主任医师,研究方向为神经内科脑血管介入。E-mail: 17165864481@163.com
温昌明(1974—),男,硕士,主任医师,研究方向为神经内科脑血管介入。E-mail: qtxvjh@163.com
[责任编辑 李亚楠]
