基于代谢组学的灯盏花素抗阿霉素心脏毒性作用机制研究
2022-04-19李梦娇孙文社张钰坤邹林峰高远真邢东明
李梦娇,原 阳,孙文社,张钰坤,卢 琦,邹林峰,高远真,叶 婷,邢东明, 3*
• 药理与临床 •
基于代谢组学的灯盏花素抗阿霉素心脏毒性作用机制研究
李梦娇1, 2,原 阳2#,孙文社2,张钰坤1, 2,卢 琦1, 2,邹林峰1, 2,高远真1, 2,叶 婷1, 2,邢东明1, 2, 3*
1.青岛大学基础医学院,山东 青岛 266071 2. 青岛大学附属医院肿瘤研究所和青岛肿瘤研究院,山东 青岛 266000 3. 清华大学生命科学学院,北京 100091
通过体内外实验研究灯盏花素对阿霉素诱导心脏毒性的保护作用及机制。体内实验中,将C57BL/6小鼠随机分为对照组、模型组、右雷佐生(12 mg/kg)组和灯盏花素低、中、高剂量(4、8、16 mg/kg)组,给予药物干预3周后,采用苏木素-伊红(HE)染色观察小鼠心肌组织的病理变化;采用ELISA法检测各组小鼠血浆端B型利钠肽前体(amino-terminal pro-B-type natriuretic peptide,NT-proBNP)水平;采用超高效液相色谱/四极杆飞行时间质谱(UHPLC/Q-TOF MS)研究其代谢途径和主要代谢产物。体外实验中,将大鼠心肌细胞H9c2随机分为对照组、阿霉素组、右雷佐生组和灯盏花素组,给予药物处理后,检测丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)水平,观察H9c2细胞抗氧化能力;采用TUNEL及Annexin V-FITC/PI双染法检测各组细胞凋亡情况;采用Western blotting法检测H9c2细胞核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和Ras同源蛋白A(Ras homolog gene family member A,RhoA)蛋白表达情况。与对照组比较,模型组小鼠血浆NT-proBNP水平显著升高(<0.05),心肌组织发生肌原纤维紊乱、破裂以及心肌纤维的波状变性;与模型组比较,灯盏花素组和右雷佐生组心肌组织的形态损伤减轻,血浆NT-proBNP水平显著降低(<0.05);代谢组学分析筛选出16个显著改变的代谢物作为潜在的生物标志物,涉及氨基酸代谢、脂质代谢及炎症因子调节等代谢路径。在H9c2细胞中,阿霉素组GSH水平显著降低(<0.05),MDA水平显著升高(<0.05),心肌细胞凋亡率显著升高(<0.05),RhoA和Nrf2蛋白表达水平均显著降低(<0.05),AMPK蛋白表达水平显著升高(<0.05);与阿霉素组比较,灯盏花素组和右雷佐生组细胞存活率升高(<0.05),MDA水平显著降低(<0.05),GSH水平显著升高(<0.05),心肌细胞凋亡率和ROS生成均显著降低(<0.05),RhoA和Nrf2蛋白表达水平均显著升高(<0.05),AMPK蛋白表达水平显著降低(<0.05)。灯盏花素通过调节脂质代谢、氨基酸代谢以及炎症因子水平维持细胞氧化还原状态和炎症水平,恢复心肌细胞稳态,抑制了阿霉素诱导的细胞损伤和凋亡,缓解心脏毒性,此外灯盏花素可能通过调节神经活性配体受体相互作用保护受损心脏功能。灯盏花素可能是一种很有前途的心脏保护剂。
灯盏花素;阿霉素;心脏毒性;细胞凋亡;代谢途径
20世纪50年代起,蒽环类化疗药物阿霉素广泛应用于乳腺癌、淋巴瘤等实体瘤以及多种血液肿瘤的临床治疗[1-2],随着其临床使用增多,其不良反应如心脏毒性、高血压及心律失常等常见的心血管疾病损害也日益突出[3],制约其进一步发展和应用。研究显示,蒽环类化疗药物是导致心脏毒性的首要因素,肿瘤患者因药物相关心脏毒性导致的死亡风险已超过了肿瘤自身或因复发而导致的死亡风险[4-7]。右雷佐生是临床指南推荐的作为预防蒽环类化疗药物心脏毒性的唯一有效药物,近20年来一直用于防止蒽环类抗肿瘤药物产生的心脏毒性[8],然而右雷佐生会增加霍奇金淋巴瘤儿童经前综合症、骨髓抑制等[9-10],不良反应显著。因此为进一步提高蒽环类化疗药物临床发展,急需开发新型安全高效的心脏毒性保护剂。
灯盏花素是灯盏花中几种黄酮类化合物的粗提物,具有抗氧化、抗炎、清除自由基等生物活性[11],主要用于治疗高血压、脑栓塞和脑血管意外引起的瘫痪等疾病[12-13]。研究表明,灯盏花素可用于治疗脑梗死和糖尿病肾病,具有明显的神经改善和保护作用[14-17]。然而其对化疗药物导致的心脏损伤有无保护价值,迄今为止并未发现相关报道。本研究利用超高效液相色谱-四极杆-飞行时间质谱(UHPLC-Q-TOF/MS)技术,探究灯盏花素对阿霉素诱导的具有心脏毒性的小鼠血浆代谢物的变化趋势及其相关代谢通路,通过代谢组学阐明灯盏花素治疗阿霉素诱导的心脏毒性的潜在生物标志物和可能机制。
1 材料
1.1 动物
SPF级雌性C57BL/6小鼠48只,8周龄,体质量18~22 g,购自北京斯贝福动物中心,动物合格证号为SCXK(京)2019-0010。动物分笼饲养于青岛大学医学部动物实验中心,自由进食饮水,饲养温度为(22±3)℃,湿度为50%。动物实验通过青岛大学医学部实验动物伦理委员会批准(批准号C577620210617068)。
1.2 细胞
大鼠心肌细胞H9c2(批号CRL1531446)购自美国ATCC。
1.3 药品与试剂
阿霉素(批号HBW200804-3)、右雷佐生(批号HBW200701-3)购自湖北威德利化学科技有限公司;灯盏花素(批号ETYSW200915-1,质量分数≥98%)购自上海第一生化药业有限公司;胎牛血清购自美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号D8371)、丙二醛(malondialdehyde,MDA)试剂盒(批号S0021)、谷胱甘肽(glutathione,GSH)活性检测试剂盒(批号S0053)购自北京索莱宝科技有限公司;细胞活性CCK-8试剂盒(批号MA0718-L)、TUNEL检测试剂盒(批号MA0723-L)、苏木素-伊红(HE)染色试剂(批号MB9898-1)购自碧云天生物技术研究所;DMEM培养基、青霉素/链霉素(批号PWL062)、活性氧(reactive oxygen species,ROS)荧光检测试剂盒(批号MA0082-2)、Annexin V-FITC/PI细胞凋亡检测试剂盒(批号MA0220-1)、BCA蛋白定量试剂盒(批号MA0082-2)、ECL超敏发光液(批号MA0186)、RIPA裂解液(批号MA0152)购自大连美仑生物技术有限公司;端B型利钠肽前体(amino-terminal pro-B-type natriuretic peptide,NT-proBNP)ELISA试剂盒(批号H421AD0355)购自上海玉博生物科技有限公司;核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)抗体(批号WH180316)、Ras同源蛋白A(Ras homolog gene family member A,RhoA)抗体(批号WH180696)、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)抗体(批号WH182712)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号WH180745)、HRP标记的山羊抗兔IgG抗体(批号WH183453)购自武汉爱博泰克生物技术有限公司;色谱级甲醇、甲酸、醋酸铵购自美国Thermo Fisher Scientific公司;超纯水购自德国Merck公司。
1.4 仪器
Q Exactive™ HF质谱仪、Vanquish UHPLC色谱仪(美国Thermo Fisher Scientific公司);低温离心机(美国Scilogex公司);VICTOR Nivo酶标仪(美国PerkinElmer公司);Cyto FLEX流式细胞仪(美国Beckman公司);DM IL LED倒置荧光显微镜(德国Leica公司)。
2 方法
2.1 动物造模、分组及给药
小鼠随机分为对照组、模型组、右雷佐生(12 mg/kg)[18]组和灯盏花素低、中、高剂量(4、8、16 mg/kg)[19]组,每组8只。除对照组外,其余各组小鼠每7天ip阿霉素(4 mg/kg),持续3周,累积剂量为12 mg/kg[20];造模同时各给药组ip相应药物,1次/d,连续3周。对照组不做任何处理,每天监测各组小鼠存活率并记录体质量变化。
2.2 血浆NT-proBNP水平的测定
小鼠麻醉后采血,收集血液,离心取上清,按照ELISA试剂盒说明书测定血浆NT-proBNP水平。
2.3 心脏组织病理变化
给药结束后,麻醉小鼠,以0.9%氯化钠溶液进行心脏灌注后,断头处死取心脏。将心脏组织置于4%多聚甲醛中固定,经切片、二甲苯脱蜡、乙醇梯度脱水、苏木素染色、清洗、伊红染色、乙醇梯度脱水、封片,于荧光显微镜下观察并拍照。
2.4 组织代谢研究
2.4.1 样本代谢物提取 取100 μL血样置于EP管中,加入400 μL 80%甲醇水溶液,涡旋振荡,冰浴静置5 min,4 ℃、15 000×离心20 min;取一定量的上清液加质谱级水稀释至甲醇含量为53%,4 ℃、15 000×离心20 min,收集上清,LC-MS进样分析。
2.4.2 UHPLC-MS分析 C18色谱柱(100 mm×2.1 mm,1.9 μm),流动相为含0.1%甲酸的乙腈溶液(A)-0.1%甲酸水溶液(B),梯度洗脱:0~1.5 min,2% B;1.5~12.0 min,2%~100% B;12.0~14.0 min,100% B;14.0~14.1 min,100%~2% B;14.1~17.0 min,2% B;柱温40 ℃;体积流量0.2 mL/min;进样量4 μL;在分析过程中,所有样品于4 ℃保存。在质谱仪上用电喷雾进行质谱分析,/设定为100~1500;分辨率设置为30 000的全扫描模式;干燥气为氮气;电喷雾毛细管电压3.2 kV;气体温度为320 ℃。
2.4.3 数据预处理和代谢物鉴定 将下机数据文件导入CD 3.1搜库软件中进行处理,对每个代谢物进行保留时间、质荷比等参数的简单筛选,然后设置相应参数等信息进行峰提取,同时对峰面积进行定量,整合目标离子,然后通过分子离子峰和碎片离子进行分子式的预测并与数据库进行比对,去除背景离子,并对原始定量结果进行标准化处理,最后得到代谢物的鉴定和相对定量结果。
2.4.4 差异代谢物的筛选 使用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库(https://www.genome.jp/ kegg/pathway.html)、HMDB数据库(https:// hmdb.ca/metabolites)和LIPID Maps 数据(http:// www.lipidmaps.org/)对鉴定到的代谢物进行注释。使用代谢组学数据处理软件对数据进行转换,然后进行主成分分析(principal component analysis,PCA)和偏最小二乘法判别分析(partial least square-discriminant analysis,PLS-DA),进而得到每个代谢物的变量投影重要性(variable importance plot,VIP)值。基于检验来计算各代谢物在两组间统计学显著性(值),并计算代谢物在两组间的差异倍数即FC值。差异代谢物筛选的默认标准为VIP>1、<0.05且FC≥2或FC≤0.5。对筛选到的差异代谢物进行层次聚类分析,将具有相同特征的代谢物归为一类,并发现代谢物在实验组间的变化特征,结果以热图进行展示。
2.4.5 差异表达代谢物的代谢通路分析 KEGG数据库搜索差异表达代谢物的相关代谢通路。
2.5 体外实验
2.5.1 细胞培养 H9c2细胞用含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养基,于37 ℃、5% CO2培养箱中培养。待细胞融合度达到80%以上时进行传代,取处于对数生长期、生长状态良好的细胞进行实验。
2.5.2 CCK-8法测定灯盏花素最佳浓度 取处于对数生长期的H9c2细胞,胰酶消化后以1×104/孔接种于96孔板中,设置对照组、阿霉素组、右雷佐生(20 μmol/L)[21]组和不同浓度(10、20、50、100、200 μmol/L)的灯盏花素[22]组。对照组仅加入DMEM培养基,其余各组加入阿霉素(5 μmol/L)[23],各给药组再加入相应药物,处理24 h。每孔加入10 μL CCK-8溶液,孵育0.5~4 h后,采用酶标仪测定450 nm处的吸光度()值。
2.5.3 GSH和MDA含量检测 取处于对数生长期的H9c2细胞,胰酶消化后以1×104/孔接种于6孔板中,对照组仅加入DMEM培养基,其余各组细胞分别加入阿霉素(5 μmol/L)、右雷佐生(20 μmol/L)、阿霉素(5 μmol/L)+右雷佐生(20 μmol/L)、灯盏花素(200 μmol/L)、阿霉素(5 μmol/L)+灯盏花素(200 μmol/L),处理24 h,按照试剂盒说明书测定测定GSH、MDA含量。
2.5.4 细胞ROS水平测定 按“2.5.3”项下方法分组及给药,收集细胞,用PBS洗涤,加入DCFH-DA探针(10 μmol/L)孵育30 min,弃上清,用PBS洗涤2次,于荧光显微镜下观察并拍照。
2.5.5 Annexin V-FITC/PI测定细胞凋亡 按“2.5.3”项下方法分组及给药,收集细胞,用无EDTA的胰酶消化收集到15 mL离心管中,室温孵育5 min;加入DPBS,离心弃上清,加入染色液重悬细胞,孵育后采用流式细胞仪采集细胞。
2.5.6 TUNEL染色分析细胞凋亡情况 按“2.5.3”项下方法分组及给药,收集细胞,用4%多聚甲醛固定15 min,然后用0.2% Triton X-100固定5 min,用100 μL平衡缓冲液平衡,除去缓冲液,用50 μL末端脱氧核苷酸转移酶反应混合物处理细胞,37 ℃孵育60 min,用2×SSC缓冲液冲洗2次细胞,然后通过Green 226荧光染色检测TUNEL阳性细胞,于荧光显微镜下观察并拍照。
2.5.7 Western blotting法检测细胞Nrf2、AMPK和RhoA蛋白表达情况 取处于对数生长期的H9c2细胞,胰酶消化后以1×104/孔接种于6孔板中,对照组仅加入DMEM培养基,其余各组细胞分别加入阿霉素(5 μmol/L)、灯盏花素(200 μmol/L)、阿霉素(5 μmol/L)+灯盏花素(200 μmol/L),处理24 h,收集细胞,加入RIPA细胞裂解缓冲液,于冰上裂解,4 ℃、12 000 r/min离心10 min,取上清液,用BCA蛋白定量试剂盒测定蛋白质量浓度,将等量的蛋白与5×Loading Buffer混合,100 ℃煮沸5 min。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭,分别加入Nrf2、AMPK、RhoA和GAPDH抗体,4 ℃孵育过夜;TBST洗膜后,加入HRP标记的山羊抗兔IgG抗体,室温孵育,使用BioRad凝胶doc系统曝光显影,采用Image J软件进行定量分析。
2.5.8 统计分析 使用IBM SPSS Statistics 25软件对数据进行分析,数据以表示。多组间均数比较采用单因素方差分析。
3 结果
3.1 灯盏花素可减轻阿霉素引起的心脏功能障碍和心肌形态变化
如图1-A所示,与对照组相比,模型组小鼠血浆心脏毒性标志物NT-proBNP水平显著升高(<0.05);与模型组比较,各给药组小鼠血浆NT-proBNP水平均显著降低(<0.05)。如图1-B所示,对照组小鼠心肌组织结构正常,与对照组相比,模型组小鼠心肌组织产生损伤性形态学改变包括心肌萎缩、间隙增大、变性坏死、水肿、炎性浸润,各给药组以上变化减轻。

A-各组小鼠血浆NT-proBNP水平 B-各组小鼠心肌组织HE染色(×400) 与对照组比较:*P<0.05;与模型组比较:#P<0.05
3.2 阿霉素诱导的心肌细胞的代谢紊乱
血浆的代谢组学可以在一定程度上反映药物干预对心脏功能的影响。通过PCA分析了对照组、模型组、右雷佐生组和灯盏花素低、中、高剂量组总离子模式下的PCA图,用来评估各组代谢物之间的分布和差异。如图2所示,PCA图表明所有样本都在置信区域内,不同组别之间存在较明显的差异,同时可能由于不同小鼠生活习惯及对药物适应性差异,同组内样本之间的分布呈现一定分散。在对照组和模型组的代谢物之间观察到明显的分离,表明由于ip阿霉素引起小鼠代谢情况改变,造成小鼠血浆中的内源性物质水平受到干扰。各给药组均向对照组前移,表明灯盏花素和右雷佐生缓解了阿霉素诱导的心脏中毒小鼠的代谢紊乱,恢复了小鼠的内源性物质水平。但具体的差异情况还需要使用PLS-DA来研究对照组和模型组、模型组和灯盏花素组间的差异,以寻找治疗心脏中毒的潜在生物标志物。
3.3 阿霉素心脏毒性的潜在生物标志物
为了研究给予不同剂量灯盏花素后对小鼠内源性物质代谢影响的大小,采用PLS-DA法分析了组间差异。根据VIP≥1、<0.05标准,将组间有显著差异的候选物确定为代谢的候选生物标志物,评估灯盏花素治疗阿霉素诱导心脏毒性的潜在机制和可能的代谢物的变化。
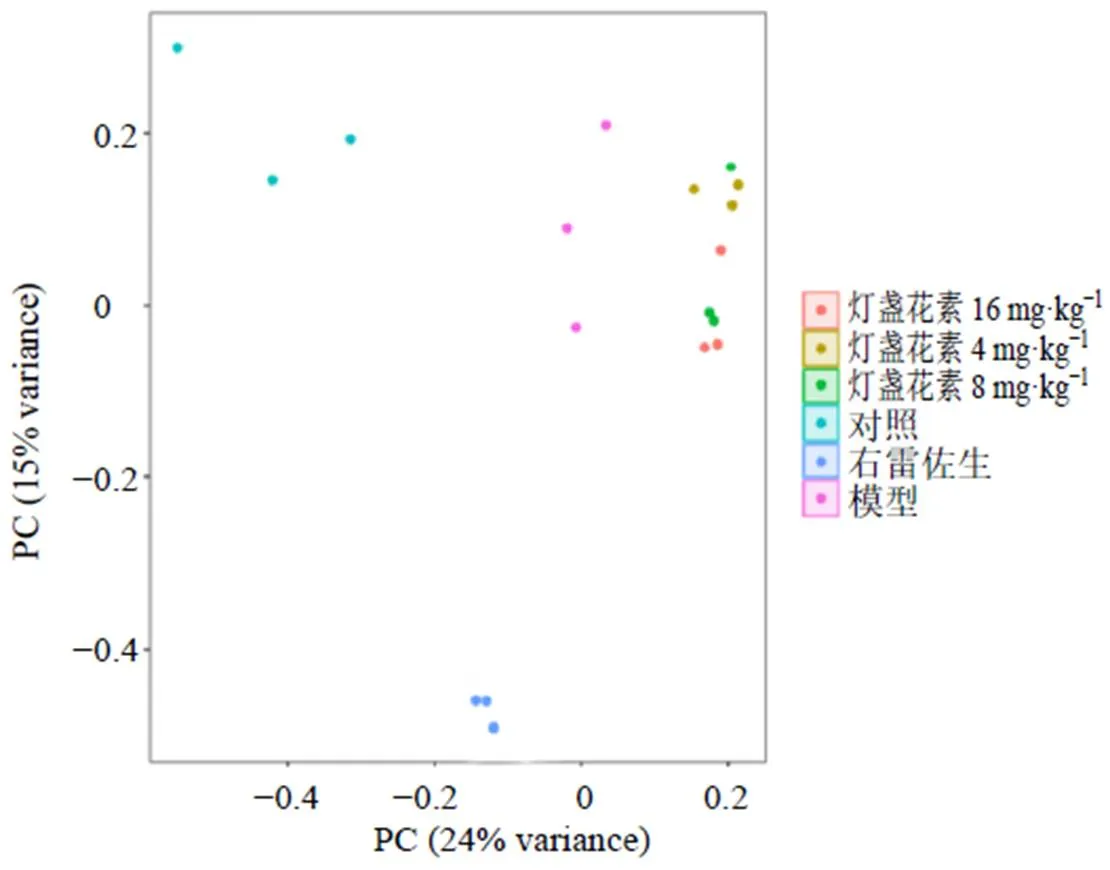
图2 PCA图
如表1所示,在各组中找到-精氨酸(-arginine)、-苏氨酸(-threonine)、缬氨酸(valine)、丝氨酸(-serine)、肌酸(creatine)、牛磺酸(taurine)、前列腺素(prostaglandin)、磷脂酰胆碱(PC)、溶血磷脂酰肌醇(LPI)等16个代谢物可以作为灯盏花素干预后的生物标志物,其中-精氨酸、-苏氨酸、缬氨酸、丝氨酸等水平降低,前列腺素水平显著升高,不同剂量灯盏花素干预后,含量异常的代谢物均有不同程度的回调,这些生物标志物在灯盏花素的作用下含量都有显著变化(图3),它们在机体氨基酸代谢、脂质代谢及炎症水平调节中发挥重要作用[24-28]。此外还构建了基于代谢物的聚类热图(图4),以确定分布情况并找出组间差异。以上结果表明在不同剂量灯盏花素的干预下,模型组小鼠血浆代谢物的含量产生了显著变化。
表1 模型组和对照组的差异代谢物
Table 1 Differential metabolites between model group and control group
编号差异代谢物分子式相对分子质量tR/minm/z趋势 1prostaglandin F2αC20H34O5354.239 8513.688355.247 01↑* 2L-asparagineC4H8N2O3132.053 151.341155.042 31↓* 3L-arginineC6H14N4O2174.112 031.945173.104 75↓* 4L-kynurenineC10H12N2O3208.084 205.315209.091 51↑* 5valineC5H11NO2117.078 821.884118.086 11↓* 6taurineC2H7NO3S125.015 021.316124.007 77↓* 7DL-arginineC6H14N4O2157.084 611.303158.092 10↓* 8D-phenylalanineC9H11NO2165.078 719.459166.086 04↓* 9O-aceyl-L-serineC5H9NO4147.052 921.331148.060 06↓* 10L-threonineC4H9NO3119.058 581.353118.051 31↓* 112-furoylglycineC7H7NO4169.035 451.263168.028 27↓* 12creatineC4H9N3O2131.069 201.372132.076 43↓* 13LPE 16∶1C21H42NO7P451.268 7714.511452.276 28↓* 14LPI 18∶1C27H51O12P598.312 5614.740597.305 80↑* 15LPS 22∶6C28H44NO9P569.275 8514.433568.267 80↓* 16PC (18∶1e/22∶4)C48H88NO7P881.655 2316.300880.646 55↓*
↑表示升高;↓表示降低*<0.05
↑ means increase; ↓ means decrease*< 0.05

与对照组比较:*P<0.05;与模型组比较:#P<0.05
3.4 差异代谢物的相关通路
使用KEGG数据库对差异代谢物的相关代谢通路进行识别分析,以<0.05、Pathway impact>0.1为条件筛选出主要的代谢通路。如图5所示,轴为值,代表该通路的显著性水平。值越大,节点颜色越红。轴是通路影响因子,表示代谢通路的重要性,数值越大,节点半径越长。基于此共筛选出4条主要代谢通路:铁死亡(ferroptosis),甘氨酸、丝氨酸和苏氨酸代谢(glycine,serine and threonine metabolism),不饱和脂肪酸的生物合成(biosynthesis of unsaturated fatty acids)以及神经活性配体受体的相互作用(neuroactive ligand-receptor interaction)。此外,组氨酸代谢(histidine metabolism)、-谷氨酰胺和-谷氨酸代谢(-glutamine and-glutamate metabolism)等也被筛选出作为相关途径之一。
3.5 灯盏花素减弱阿霉素诱导的H9c2细胞毒性
如图6-A所示,与阿霉素组相比,10~200 μmol/L灯盏花素显著升高细胞存活率(<0.05)。
3.6 灯盏花素改善阿霉素诱导的H9c2细胞氧化应激及细胞凋亡
研究表明,阿霉素能够诱导心脏毒性和氧化应激,产生的过量ROS可能会破坏DNA、蛋白质和膜结构的不饱和脂质等成分,最终加速细胞凋亡或诱发脂质过氧化引起细胞铁死亡,从而导致心脏毒性[29]。如图6-B~D所示,阿霉素处理的H9c2细胞中MDA、ROS水平显著升高(<0.05),GSH水平显著降低(<0.05);灯盏花素明显降低阿霉素诱导的H9c2细胞中MDA和ROS水平(<0.05),显著升高GSH水平(<0.05)。
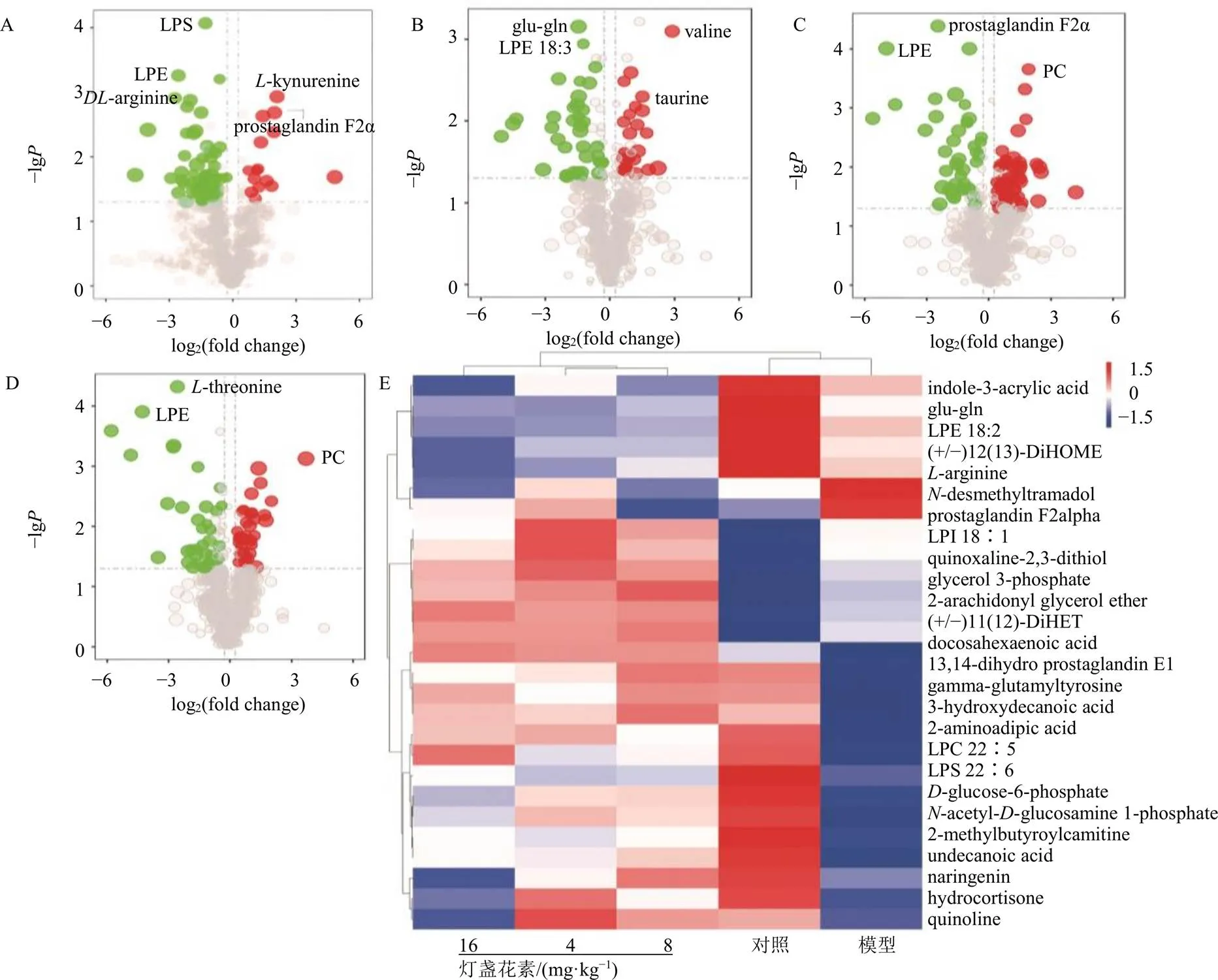
A-模型组和对照组的差异代谢物火山图 B-灯盏花素低剂量组和模型组的差异代谢物火山图 C-灯盏花素中剂量组和模型组的差异代谢物火山图 D-灯盏花素高剂量组和模型组的差异代谢物火山图 E-生物标志物的热图

A-模型组与对照组的差异代谢物代谢通路图 B-灯盏花素低剂量组与模型组的差异代谢物代谢通路图 C-灯盏花素中剂量组与模型组的差异代谢物代谢通路图 D-灯盏花素高剂量组与模型组的差异代谢物代谢通路图

A-CCK8法测定细胞毒性 B-MDA含量 C-GSH含量 D-ROS水平 与对照组比较:*P<0.05;与阿霉素组比较:#P<0.05,图7、8同
细胞凋亡是阿霉素诱导心脏毒性的重要表现。如图7-A所示,与对照组相比,阿霉素处理后细胞凋亡和坏死比重明显升高,活细胞数量显著减少,经灯盏花素和右雷佐生处理后凋亡细胞数量显著减少。如图7-B所示,H9c2心肌细胞长期暴露于阿霉素下导致DNA片段化增加,与对照组相比,TUNEL阳性细胞数显著增加(<0.05),用灯盏花素处理后TUNEL阳性细胞数量显著减少(<0.05),表明灯盏花素有效改善阿霉素诱导的DNA断裂。
3.7 灯盏花素调控阿霉素诱导的H9c2细胞Nrf2、RhoA和AMPK蛋白表达
阿霉素诱导心脏毒性不仅增加细胞凋亡,而且影响凋亡相关蛋白的表达[30-34]。如图8所示,与对照组比较,阿霉素组H9c2细胞AMPK蛋白表达水平显著升高(<0.05),Nrf2和RhoA蛋白表达水平均显著降低(<0.05);与阿霉素组比较,灯盏花素组和灯盏花+阿霉素组H9c2细胞AMPK蛋白表达水平显著降低(<0.05),Nrf2和RhoA蛋白表达水平均显著升高(<0.05)。

A-Annexin V-FITC/PI测定细胞凋亡 B-TUNEL染色测定细胞凋亡

图8 灯盏花素对阿霉素诱导的H9c2细胞Nrf2、AMPK和RhoA蛋白表达的影响
4 讨论
灯盏花素临床常用于治疗心脑血管等疾病,然而其介导的心脏保护所依赖的代谢调节机制尚不明确。为了进一步探究灯盏花素治疗阿霉素诱导心脏毒性的作用机制,研究了小鼠血浆代谢物和代谢途径的相关情况,结果显示灯盏花素治疗阿霉素心脏毒性与脂质代谢、氨基酸代谢和炎症水平调节密切相关。作为灯盏花素心脏保护形成的核心环节,神经活性配体受体相互作用是灯盏花素富集的主要通路。结合本研究结果,推测灯盏花素可能通过调节氨基酸代谢、脂质代谢和炎症水平来抑制细胞凋亡,通过神经活性配体-受体通路保护受损心脏功能,最终抑制阿霉素产生的心脏毒性。
本研究结果显示,阿霉素诱导的心脏毒性与铁死亡,甘氨酸、丝氨酸及苏氨酸代谢和不饱和脂肪酸的生物合成等有关,这些代谢途径与细胞凋亡的发生密切相关,进一步在体外实验中重复验证了阿霉素诱导的细胞凋亡水平升高。铁死亡是一种由细胞内磷脂过氧化引发的细胞死亡类型,与细胞的铁含量、氨基酸代谢以及氧化还原状态密切相关,会催化细胞膜上不饱和脂肪酸的高表达,诱发脂质过氧化,从而导致细胞凋亡[35-37]。甘氨酸、丝氨酸及苏氨酸代谢途径的异常变化会影响免疫系统和其他器官功能的正常发挥,氨基酸为构建细胞质量提供底物,其异常会减少细胞增殖和迁移,导致细胞凋亡[38-39]。不饱和脂肪酸的生物合成涉及脂质含量较高的中枢神经系统,与许多心血管疾病的发生有关[29],脂质代谢参与多种细胞信号通路,是维持细胞结构和提供能量的基本成分,但其异常变化可导致细胞功能障碍和坏死,从而引起细胞凋亡[40],脂质代谢异常会影响AMPK信号通路和神经活性配体受体相互作用通路。神经活性配体受体相互作用是灯盏花素发挥心脏保护作用的核心途径,调节神经活性配体受体的相互作用可以缓解心脏功能受损[41]。AMPK是调节脂质代谢和细胞凋亡连接器上的关键蛋白,抑制AMPK信号可以显著减弱阿霉素参与的脂质代谢异常,从而减少细胞凋亡和铁死亡,抑制细胞毒性[42-43]。丝氨酸和苏氨酸是RhoA家族的下游介质,RhoA蛋白可以通过三磷酸鸟苷(guanosine triphosphate,GTP)依赖的方式激活丝氨酸和苏氨酸,2个氨基酸的末端可能是Rho家族潜在的药物靶点,丝氨酸和苏氨酸含量异常,会诱发RhoA蛋白表达异常,引发细胞凋亡[44-45],此外,Rho家族相关蛋白表达异常会激活AMPK,继而加重细胞凋亡[46]。Nrf2蛋白所在通路激活后会有效抑制炎症反应,减少炎症介质释放,降低细胞凋亡率[47-48]。阿霉素处理后的细胞AMPK蛋白表达水平显著增加,严重干扰机体正常的脂质代谢,而Nrf2和RhoA蛋白表达水平显著降低,使氨基酸代谢异常,炎症水平升高,细胞凋亡增加。因此推测灯盏花素可能通过调节异常的氨基酸代谢、脂质代谢和炎症水平来抑制细胞凋亡,通过神经活性配体-受体通路保护受损心脏功能,最终抑制阿霉素产生的心脏毒性。
本研究采用右雷佐生作为阳性对照药物,以确证灯盏花素对于阿霉素造成心脏损伤的治疗效果。右雷佐生可以通过减少炎症和细胞凋亡增加心肌细胞活力,从而减轻阿霉素心脏毒性[19],而灯盏花素主要通过减弱细胞氧化应激和细胞凋亡减轻阿霉素心脏毒性。从代谢角度出发,不同于右雷佐生发挥心脏保护的主要代谢途径与能量代谢、氧化还原维持、磷脂和蛋白质代谢有关[50-52],灯盏花素的保护作用更偏向于稳定氨基酸代谢、脂质代谢及炎症代谢,并且通过神经活性配体受体作用途径来保护心脏功能等。但灯盏花素通过抑制细胞凋亡来减轻阿霉素产生心脏毒性的具体通路有待进一步研究。
综上所述,本研究发现灯盏花素可以改善阿霉素诱导的心脏毒性,可能是通过调节脂质代谢、氨基酸代谢、炎症水平和神经活性配体受体相互作用等途径抑制阿霉素产生的细胞凋亡和心脏损伤。
利益冲突 所有作者均声明不存在利益冲突
[1] Rimal H, Lee S W, Lee J H,. Understanding of real alternative redox partner ofDoxA: Prediction and validation using in silico andanalyses [J]., 2015, 585: 64-74.
[2] Lewis W D, Lilly S, Jones K L. Lymphoma: Diagnosis and treatment [J]., 2020, 101(1): 34-41.
[3] van der Zanden S Y, Qiao X H, Neefjes J. New insights into the activities and toxicities of the old anticancer drug doxorubicin [J]., 2021, 288(21): 6095-6111.
[4] Caron J, Nohria A. Cardiac toxicity from breast cancer treatment: Can we avoid this? [J]., 2018, 20(8): 61.
[5] Narezkina A, Nasim K. Anthracycline cardiotoxicity [J]., 2019, 12(3): e005910.
[6] Curigliano G, Cardinale D, Dent S,. Cardiotoxicity of anticancer treatments: Epidemiology, detection, and management [J]., 2016, 66(4): 309-325.
[7] McGowan J V, Chung R, Maulik A,. Anthracycline chemotherapy and cardiotoxicity [J]., 2017, 31(1): 63-75.
[8] Eneh C, Lekkala M R.[M]. StatPearls: Treasure Island, 2021: 24-25.
[9] Kopp L M, Womer R B, Schwartz C L,. Effects of dexrazoxane on doxorubicin-related cardiotoxicity and second malignant neoplasms in children with osteosarcoma: A report from the Children’s oncology group [J]., 2019, 5: 15.
[10] Getz K D, Sung L, Alonzo T A,. Effect of dexrazoxane on left ventricular systolic function and treatment outcomes in patients with acute myeloid leukemia: A report from the children’s oncology group [J]., 2020, 38(21): 2398-2406.
[11] 田丽华, 赵立忠, 顾佳, 等. 灯盏花素新品种及剂型研究进展[J]. 中国中药杂志, 2014, 39(19): 3719-3722.
[12] Gao J L, Chen G, He H Q,. Therapeutic effects of breviscapine in cardiovascular diseases: A review [J]., 2017, 8: 289.
[13] Wu L H, Liu M, Fang Z Y. Combined therapy of hypertensive nephropathy with breviscapine injection and antihypertensive drugs: A systematic review and a meta-analysis [J]., 2018, 2018: 2958717.
[14] 赵俊, 智英杰, 赵辉, 等. 灯盏花素注射液治疗糖尿病肾病的疗效和安全性: 随机对照试验的综述和Meta分析[J]. 中国中药杂志, 2019, 44(4): 833-844.
[15] Li Z, Zhang X B, Gu J H,. Breviscapine exerts neuroprotective effects through multiple mechanisms in APP/PS1transgenic mice [J]., 2020, 468(1/2): 1-11.
[16] Wang M, Zhang W B, Song J L,. Effect of breviscapine on recovery of viable myocardium and left ventricular remodeling in chronic total occlusion patients after revascularization: Rationale and design for a randomized controlled trial [J]., 2018, 24: 4602-4609.
[17] Liu X D, Yao L, Sun D,. Effect of breviscapine injection on clinical parameters in diabetic nephropathy: A meta-analysis of randomized controlled trials [J]., 2016, 12(3): 1383-1397.
[18] 马军, 秦叔逵, 沈志祥. 蒽环类药物心脏毒性防治指南(2013年版) [J]. 临床肿瘤学杂志, 2013, 18(10): 925-934.
[19] Chen Z Q, Zhou Y, Chen F,. Breviscapine pretreatment inhibits myocardial inflammation and apoptosis in rats after coronary microembolization by activating the PI3K/Akt/GSK-3β signaling pathway [J]., 2021, 15: 843-855.
[20] Li M C, Sala V, de Santis M C,. Phosphoinositide 3-kinase gamma inhibition protects from anthracycline cardiotoxicity and reduces tumor growth [J]., 2018, 138(7): 696-711.
[21] Shabalala S C, Dludla P V, Muller C J F,. Aspalathin ameliorates doxorubicin-induced oxidative stress in H9c2 cardiomyoblasts [J]., 2019, 55: 134-139.
[22] Wang J, Ji S Y, Liu S Z,. Cardioprotective effect of breviscapine: Inhibition of apoptosis in H9c2 cardiomyocytes via the PI3K/Akt/eNOS pathway following simulated ischemia/reperfusion injury [J]., 2015, 70(9): 593-597.
[23] Upadhyay S, Mantha A K, Dhiman M.(Licorice) root extract attenuates doxorubicin-induced cardiotoxicity via alleviating oxidative stress and stabilising the cardiac health in H9c2 cardiomyocytes [J]., 2020, 258: 112690.
[24] Mondanelli G, Iacono A, Carvalho A,. Amino acid metabolism as drug target in autoimmune diseases [J]., 2019, 18(4): 334-348.
[25] Basu S. Novel cyclooxygenase-catalyzed bioactive prostaglandin F2alpha from physiology to new principles in inflammation [J]., 2007, 27(4): 435-468.
[26] Michel M, Dubowy K O, Entenmann A,. Targeted metabolomic analysis of serum amino acids in the adult Fontan patient with a dominant left ventricle [J]., 2020, 10(1): 8930.
[27] Aquilani R, La Rovere M T, Corbellini D,. Plasma amino acid abnormalities in chronic heart failure mechanisms, potential risks and targets in human myocardium metabolism [J]., 2017, 9(11): E1251.
[28] Sun H P, Wang Y B. Branched chain amino acid metabolic reprogramming in heart failure [J]., 2016, 1862(12): 2270-2275.
[29] Liu Y C, Zeng L P, Yang Y,. Acyl-CoA thioesterase 1 prevents cardiomyocytes from doxorubicin-induced ferroptosis via shaping the lipid composition [J]., 2020, 11(9): 756.
[30] Liu D, Ma Z Q, di S Y,. AMPK/PGC1α activation by melatonin attenuates acute doxorubicin cardiotoxicity via alleviating mitochondrial oxidative damage and apoptosis [J]., 2018, 129: 59-72.
[31] Chang Z F, Lee H H. RhoA signaling in phorbol ester-induced apoptosis [J]., 2006, 13(2): 173-180.
[32] Cheng X L, Liu D, Xing R N,. Orosomucoid 1 attenuates doxorubicin-induced oxidative stress and apoptosis in cardiomyocytes via Nrf2 signaling [J]., 2020, 2020: 5923572.
[33] Feng K, Chen Z X, Pengcheng L,. Quercetin attenuates oxidative stress-induced apoptosis via SIRT1/ AMPK-mediated inhibition of ER stress in rat chondrocytes and prevents the progression of osteoarthritis in a rat model [J]., 2019, 234(10): 18192-18205.
[34] Lin H, Zhang J, Ni T J,. Yellow wine polyphenolic compounds prevents doxorubicin-induced cardiotoxicity through activation of the Nrf2 signalling pathway [J]., 2019, 23(9): 6034-6047.
[35] Stockwell B R, Jiang X J, Gu W. Emerging mechanisms and disease relevance of ferroptosis [J]., 2020, 30(6): 478-490.
[36] Sun Y T, Chen P, Zhai B T,. The emerging role of ferroptosis in inflammation [J]., 2020, 127: 110108.
[37] Qiu Y M, Cao Y, Cao W J,. The application of ferroptosis in diseases [J]., 2020, 159: 104919.
[38] Koochekpour S, Majumdar S, Azabdaftari G,. Serum glutamate levels correlate with Gleason score and glutamate blockade decreases proliferation, migration, and invasion and induces apoptosis in prostate cancer cells [J]., 2012, 18(21): 5888-5901.
[39] Phang J M, Liu W, Hancock C,. The proline regulatory axis and cancer [J]., 2012, 2: 60.
[40] da Cunha Menezes Souza L, Fernandes F H, Presti P T,. Effect of doxorubicin on cardiac lipid metabolism-related transcriptome and the protective activity of Alda-1 [J]., 2021, 898: 173955.
[41] Bai H, Sun K, Wu J H,. Proteomic and metabolomic characterization of cardiac tissue in acute myocardial ischemia injury rats [J]., 2020, 15(5): e0231797.
[42] Gao L X, Xu Z G, Huang Z,. CPI-613 rewires lipid metabolism to enhance pancreatic cancer apoptosis via the AMPK-ACC signaling [J]., 2020, 39(1): 73.
[43] Zhong Y, Tian F, Ma H X,. FTY720 induces ferroptosis and autophagy via PP2A/AMPK pathway in multiple myeloma cells [J]., 2020, 260: 118077.
[44] Lim W G, Chen X, Liu J P,. The-terminus of PRK2/PKNgamma is required for optimal activation by RhoA in a GTP-dependent manner [J]., 2008, 479(2): 170-178.
[45] Lim W G, Zhu Y M, Wang C H,. The last five amino acid residues at the-terminus of PRK1/PKN is essential for full lipid responsiveness [J]., 2005, 17(9): 1084-1097.
[46] Kamel W A, Sugihara E, Nobusue H,. Simvastatin-induced apoptosis in osteosarcoma cells: A key role of RhoA-AMPK/p38 MAPK signaling in antitumor activity [J]., 2017, 16(1): 182-192.
[47] Gao X Y, He D W, Liu D F,. Beta-naphthoflavone inhibits LPS-induced inflammation in BV-2 cells via AKT/Nrf-2/HO-1-NF-κB signaling axis [J]., 2020, 225(4): 151965.
[48] Prasanna P L, Renu K, Valsala Gopalakrishnan A. New molecular and biochemical insights of doxorubicin-induced hepatotoxicity [J]., 2020, 250: 117599.
[49] Eneh C, Lekkala M R.[M].StatPearls: Treasure Island, 2021: 87.
[50] Yang Q J, Yang G J, Wan L L,. Protective effects of dexrazoxane against doxorubicin-induced cardiotoxicity: A metabolomic study [J]., 2017, 12(1): e0169567.
[51] Dallons M, Schepkens C, Dupuis A,. New insights about doxorubicin-induced toxicity to cardiomyoblast-derived H9c2 cells and dexrazoxane cytoprotective effect: Contribution of1H-NMR metabonomics [J]., 2020, 11: 79.
[52] Carvalho R A, Sousa R P, Cadete V J,. Metabolic remodeling associated with subchronic doxorubicin cardiomyopathy [J]., 2010, 270(2/3): 92-98.
Mechanisms of breviscapine against doxorubicin-induced cardiotoxicity based on metabolomics
LI Meng-jiao1, 2, YUAN Yang2, SUN Wen-she2, ZHANGYu-kun1, 2, LU Qi1, 2, ZOU Lin-feng1, 2, GAO Yuan-zhen1, 2, YE Ting1, 2, XING Dong-ming1, 2, 3
1. School of Basic Medicine, Qingdao University, Qingdao 266071, China 2. Cancer Institute of The Affiliated Hospital of Qingdao University and Qingdao Cancer Institute, Qingdao 266000, China 3. School of Life Sciences, Tsinghua University, Beijing 100091, China
To investigate the effects and mechanism of breviscapine against doxorubicin-induced cardiotoxicityand, C57BL/6 mice were randomly divided into control group, model group, dexrazoxane (12 mg/kg) group and breviscapine low-, medium- and high-dose (4, 8, 16 mg/kg) groups, drugs were given for intervention for 3 weeks, hematoxylin-eosin (HE) staining was used to observe the pathological changes of myocardial tissue in mice; ELISA method was used to detect the amino-terminal pro-B-type natriuretic peptide (NT-proBNP) level in plasma; Metabolic pathways and major metabolites were studied by ultra-high performance liquid chromatography/quadrupole time-of-flight mass spectrometry (UHPLC/Q-TOF MS).experiments, rat cardiomyocytes H9c2 were randomly divided into control group, adriamycin group, dexrazoxane group and breviscapine group. After treatment, malondialdehyde (MDA) and glutathione (GSH) levels were detected to observe the antioxidant capacity of H9c2 cells; TUNEL and Annexin V-FITC/PI double staining were used to detect the apoptosis of cells in each group; Western blotting was used to detect nuclear factor E2 related factor 2 (Nrf2), adenylate-activated protein kinase (AMPK) and Ras homolog gene family member A (RhoA) protein expressions of H9c2 cells.Compared with control group, NT-proBNP level in plasma of mice in model group was significantly increased (< 0.05), myofibrils were disordered, ruptured and wavy degeneration of myocardial fibers occurred in myocardial tissue; Compared with model group, morphological damage of myocardial tissue in breviscapine group and dexrazoxane group was alleviated, and NT-proBNP level in plasma was significantly decreased (< 0.05). Metabolomics analysis screened out 16 significantly altered metabolites as potential biomarkers, involving metabolic pathways such as amino acid metabolism, lipid metabolism and regulation of inflammatory factors. In H9c2 cells, GSH level was significantly decreased (< 0.05), MDA level was significantly increased (< 0.05), apoptosis rate of cardiomyocytes was significantly increased (< 0.05), RhoA and Nrf2 protein expressions in adriamycin group were significantly decreased (< 0.05), AMPK protein expression was significantly increased (< 0.05). Compared with doxorubicin group, survival rate of cells in breviscapine group and dexrazoxane group was increased (< 0.05), MDA level was significantly decreased (< 0.05), GSH level was significantly increased (< 0.05), apoptosis rate and ROS generation of cardiomyocytes were significantly decreased (< 0.05), RhoA and Nrf2 protein expressions were significantly increased (< 0.05), AMPK protein expression was significantly decreased (< 0.05).Breviscapine maintains cellular redox state and inflammatory level by regulating lipid metabolism, amino acid metabolism and inflammatory factor levels, restores myocardial cell homeostasis, inhibits doxorubicin-induced cell damage and apoptosis, and relieves cardiac toxicity, and breviscapine may protect impaired cardiac function through neuroactive ligand-receptor interactions. Breviscapine may be a promising cardioprotective agent.
breviscapine; doxorubicin; cardiotoxicity; cell apoptosis; metabolic pathways
R285.5
A
0253 - 2670(2022)08 - 2356 - 12
10.7501/j.issn.0253-2670.2022.08.012
2021-12-09
国家自然科学基金资助项目(3200830);中国博士后基金资助项目(2021T140356);山东省自然科学基金资助项目(ZR2020MH369)
李梦娇(1996—),女,硕士,主要从事肿瘤保护剂研究。Tel: 13636756256 E-mail: L04040112@163.com
邢东明,男,博士生导师,主要从事药理学及药物开发研究。E-mail: xdm_tsinghua@163.com
#共同第一作者:原 阳(1988—),男,博士后,主要从事化疗性心肌损伤研究。Tel: 18053237721 E-mail: yuanyangofficial@yeah.net
[责任编辑 李亚楠]
