基于抗凝血活性的丹红注射液生物效价测定方法的建立
2022-04-19张宇航吴宿慧李寒冰唐进法
张宇航,杨 静,吴宿慧*,李寒冰,唐进法
基于抗凝血活性的丹红注射液生物效价测定方法的建立
张宇航1,杨 静1,吴宿慧1*,李寒冰1,唐进法2*
1. 河南中医药大学 河南省健康衰老产业工程研究中心,河南 郑州 450046 2. 河南中医药大学第一附属医院 河南省中药临床应用、评价与转化工程研究中心,河南 郑州 450000
以凝血酶时间(thrombin time,TT)为指标,建立丹红注射液(Danhong Injection,DHI)抗凝血生物效价测定方法,以评价其质量。收集10批次合格DHI,同时采用光照、高温、暴露进行稳定性加速处理,共得样品40批。工作参照物的制备采用丹酚酸B、羟基红花黄色素A与辅料1∶1∶8混合,并调制成40 mg/mL。按照“量反应平行线(3.3)法”设计抗凝血活性测定实验,所用的血浆为4只家兔等比混合的血浆,药物剂间距为1∶0.8,半自动凝血分析仪测定TT值,对线性关系、可靠性、精密度、重复性、稳定性进行考察,优化并确定检测条件,即反应体系为100 μL血浆+工作参照物或样品溶液50 μL+凝血酶试剂100 μL,对样品开展生物效价检测。工作参照物和DHI在20~40 mg/mL时,与TT值线性关系良好,值分别为0.982 7、0.969 6。生物效价结果表明工作参照物和合格的DHI均具有显著的抗凝血活性,且结果能通过可靠性检验,10批次DHI的效价值范围为3700~4300 U/mL;与加速处理的样品生物效价测定结果比较,暴露、光照处理DHI样品可被全部检出,高温处理DHI检出率80%。所建立的生物效价方法用于DHI的质量评价,具有精密度高、重复性好、结果可靠的特点。
生物效价;丹红注射液;量反应平行线;凝血酶时间;质量评价
中药注射剂(traditional Chinese medicine injection,TCMI)是遵循中医药理论,结合实践经验,利用先进技术手段从天然药物的单方或复方中提取有效物质精制而成的,可供注入体内的溶液、乳状液、临用前配制为溶液的粉末或浓溶液的灭菌制剂[1]。中药注射剂在心脑血管领域、呼吸系统均具有显著成就,尤其是对中重型和危重型新冠肺炎患者的治疗发挥着重要作用[2-4],充分证明了中药注射剂的卓著疗效。但是随着中药注射剂的普及使用,不良反应时有报道。中药质量可控是保证中药临床安全和有效的重要前提,“质量可控、安全有效”也是我国药品研发的首要原则[5]。目前,对于中药及中药注射剂,已经建立了以指标性成分检测为核心的中药质量评控体系,然而,这种方法存在与临床功效和安全性关联不紧密的问题,难以评控中药及中药注射剂的内在质量,故常受到业内外的质疑和诟病[6]。
生物检定是利用生物体包括整体动物、离体组织、器官、细胞和微生物等评估药物生物活性的一种方法。特别适用于成分不明确或未找到合适理化检验方法的物质,如中药、生物制品。现代意义上的生物检定多开始于抗生素的生物检定,但是并不局限于此[7]。采用生物检定的方法来评价中药或其制剂的质量已被广泛认可。与传统化学指标性成分含量测定不同,生物检定因具有药效相关、整体可控等技术优势,符合中医药特点的质量控制模式和方法,已经成为中药质量标准化的重要发展方向之一[8],“中药生物活性指导原则”也得到国家药典委员会的认可,被收录于《中国药典》[9]。如有研究报道采用抗病毒活性的生物评价方法来控制板蓝根的质量[10];采用抗血小板聚集的生物效价方法评价水蛭、当归、大黄等中药的质量[11-13];采用生物毒价的方法评价雷公藤的肝毒性[14]。
本实验以疗效确切、临床用量大同时少见不良反应报道的丹红注射液(Danhong Injection,DHI)为示范,开展中药注射液生物效价质量评价研究。DHI主要由中药丹参与红花配伍而成,具有活血化瘀、通脉舒络的功效,常用于瘀血闭阻所致的胸痹及中风,冠心病、淤血型肺心病、心绞痛、脑血栓等。常见的不良反应有皮肤过敏、胸闷、心悸、头痛等。因此,提高和完善DHI的现有质量控制模式和方法,对于保证其临床使用的安全有效至关重要。
生物评价的关键在于与药效相关的评价指标的选择。临床上,常通过凝血酶时间(thrombin time,TT)监测凝血共同途径、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)监测内源性凝血途径、凝血酶原时间(prothrombin time,PT)监测外源性凝血途径,凝血时间过长可能有出血的风险,过短则可能形成血栓阻碍血液流通。DHI具有活血化瘀,通脉舒络的功效。故DHI的生物检定评价指标可选择APTT、TT、PT等。TT是指在待测血浆中加入标定的凝血酶溶液,在凝血酶的作用下,血浆中的纤维蛋白原转变为纤维蛋白丝所需的时间[15]。因此,本研究拟围绕以上指标开展DHI活血生物效价测定。
本研究收集10批DHI合格样品,并根据《中国药典》2020年版四部中原料药物与制剂稳定性试验指导原则和文献报道进行处理[9,16],获得高温处理样品10批、光照处理样品10批、暴露处理样品10批。利用生物检定的原理,以TT为指标,建立了测定DHI抗凝血活性的方法,为DHI的质量评价提供新的研究思路与方法。
1 仪器与材料
1.1 仪器
SC40型半自动凝血分析仪,泰州中勤世帝生物技术有限公司;BSA224S-CW型电子天平,赛多利斯科学仪器有限公司;SPSS统计分析软件,26.0版,美国IBM公司;BS2000生物统计软件,中国食品药品检定研究院;Multifuge X1R型高速离心机,赛默飞世尔科技有限公司;FDU-1200型冷冻干燥仪,日本EYELA东京理化器械株式会社。
1.2 动物
日本大耳白兔4只,雄性,体质量约2.5 kg,由陕西西咸新区沣东新城实验动物养殖场提供,实验动物许可证号:SCXK(陕)2017-002。所有动物实验遵循河南中医药大学有关实验动物管理和使用的规定,均符合3R原则。
1.3 试剂与药品
丹酚酸B(批号P13N11F130912,质量分数≥98%)、3.2%枸橼酸钠抗凝剂(批号J20GR152301),上海源叶生物科技有限公司;羟基红花黄色素A,批号619F021,质量分数≥98%,北京索莱宝科技有限公司;TT测定试剂盒(批号STY50301-37-7)、APTT测定试剂盒(批号STY50201-36-1)、PT测定试剂盒(批号STY50101-30-1),泰州中勤世帝生物技术有限公司。10批次DHI,批号20061020、19101025、20031019、20071020、20111019、20011002、20031004、20061007、20041004、20101005,均来源于山东丹红制药有限公司。
2 方法与结果
2.1 DHI稳定性影响因素试验[9,16]
2.1.1 高温处理样品 取正常合格DHI样品若干支,于(60±5)℃恒温放置10 d制得。
2.1.2 光照处理样品 取正常合格DHI样品若干支,于(4000±500)lx条件下放置10 d制得。
2.1.3 暴露处理样品 取正常合格DHI样品若干支,开启瓶口与室温避光开放条件下放置10 d制得。
2.1.4 光照、高温、暴露处理结果 DHI经光照、高温、暴露处理结果见图1。DHI经过光照、高温处理后,颜色、气味均与合格样品无异,未见沉淀产生;经暴露处理后,出现颜色发黑现象,部分瓶内有菌落或胶状物质产生。
2.2 实验方法的选择与条件优化
2.2.1 TT测定的方法 取一次性血凝仪四联测试杯,每通道加入血浆100 μL,待测药液50 μL和测试珠1颗,轻轻摇动,使血浆和药物混合均匀,放置在预温区,37 ℃预温3 min,结束后迅速转移至测试区,并加入100 μL的凝血酶试剂,立即开始计时。每个质量浓度平行测定4次[17-18]。
2.2.2 实验体系条件优化 为了获得灵敏、稳定、可靠的抗凝血活性测定结果,分别以纯水和生理盐水为溶媒对DHI稀释,考察不同体积分数DHI对TT的影响。结果表明(图2),以纯水为溶媒时DHI的体积分数()与TT值()呈线性回归关系为=2.734 2+10.954 0,=0.992 9,表明线性关系良好,与文献报道一致[22],故选择纯水作为溶媒。

图1 光照、高温、暴露处理DHI结果
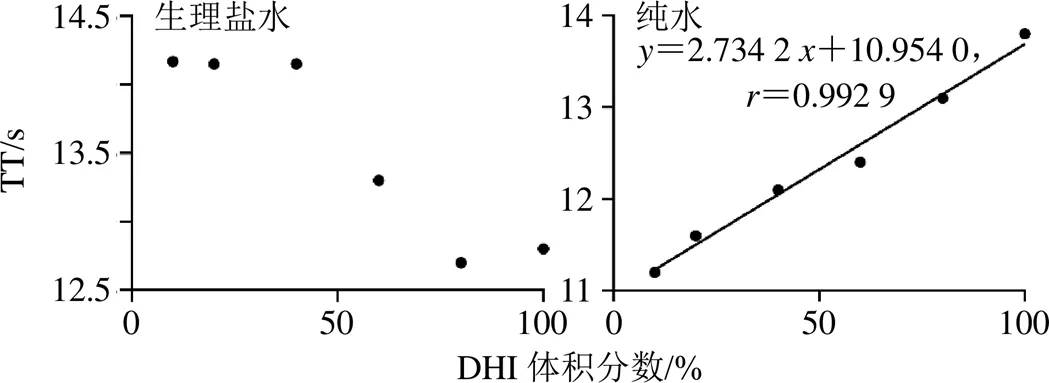
图2 不同溶剂对TT的影响
对DHI的凝血相关指标APTT、PT、TT进行考察,结果(图3)表明,TT对DHI体积分数变化更灵敏,线性关系更可靠(=2.734 2,=0.992 9),故最终选择TT为DHI抗凝血活性测定指标。
2.2.3 工作参照物的制备 工作参照物是本研究中测量供试样品生物效价的基准,是控制供试样品质量必不可少的工具。生物效价检测用工作参照物应符合同质性、代表性、均一性、稳定性、可延性的原则[19-21]。依据上述原则经单因素考察,选择丹酚酸B和羟基红花黄色素A为活性成分,甘露醇为药用辅料(经考察甘露醇性质稳定,加入后可使工作参照物更易称量和保存且不影响测定结果),制备成工作参照物。
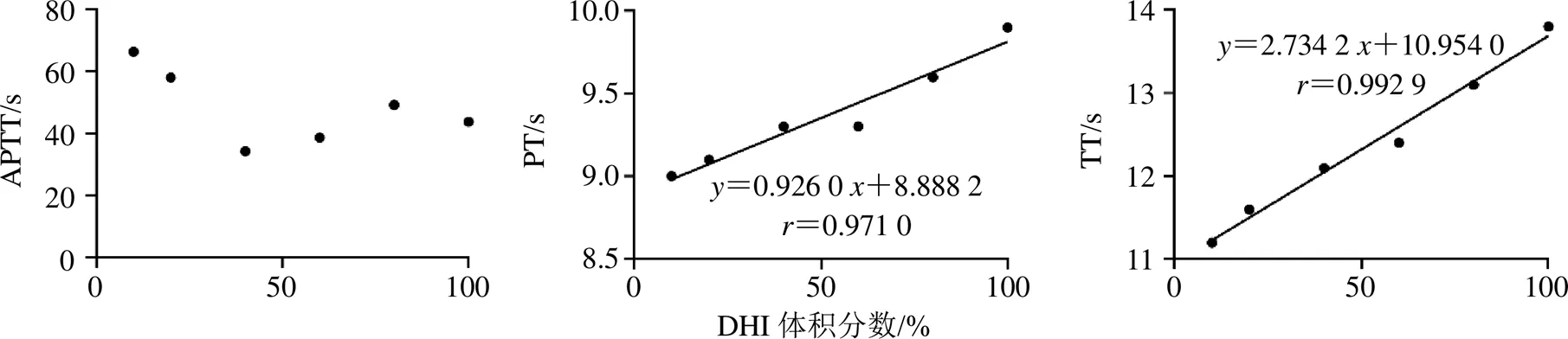
图3 DHI对APTT、PT、TT的影响(纯水)
精确称取丹酚酸B、羟基红花黄色素A对照品各4 mg,精确称取甘露醇32 mg,溶解于1 mL纯水中,摇匀,得质量浓度为40 mg/mL的工作参照物溶液,经前期预实验,此质量浓度下工作参照物与DHI所产生的生物效应相当。为方便计算,定义每毫克工作参照物效价为100 U。
2.2.4 DHI供试品溶液的配制 取各批次正常及光照、高温、暴露DHI,以纯水为溶剂,按照1∶0.8的剂间距配制成3个连续的不同质量浓度的DHI供试样品[22]。
2.2.5 血浆的制备 取健康家兔,取血前禁食12 h,兔耳缘静脉取血,加枸橼酸钠溶液与血液以1∶9抗凝,上下轻轻颠倒混匀,使抗凝剂与血液充分混合均匀,于冰上静置至少30 min,4 ℃,3000×离心10 min,取上层血浆即得。经考察使用等比混合血浆更易于测定且结果误差小、稳定性高。
2.3 样品生物效价测定
2.3.1 线性关系考察 取20031004批次DHI,使用纯水分别稀释成40、32、24、16、8、4 mg/mL的DHI溶液;取工作参照物溶液,使用纯水分别稀释至40、35、30、25、20 mg/mL,按照“2.2.1”项中TT测定方法测定每个质量浓度的TT值。
结果如图4,以工作参照物的质量浓度为横坐标(),TT值为纵坐标()进行线性回归,得回归方程=0.244+8.02,=0.982 7。结果表明,工作参照物质量浓度在20~40 mg/mL与TT值的线性关系良好;以DHI的质量浓度为横坐标(),所得TT值为纵坐标()进行线性回归,得回归方程=0.104 1+12.336,=0.969 6。结果表明,DHI在4~40 mg/mL与TT值的线性关系良好。
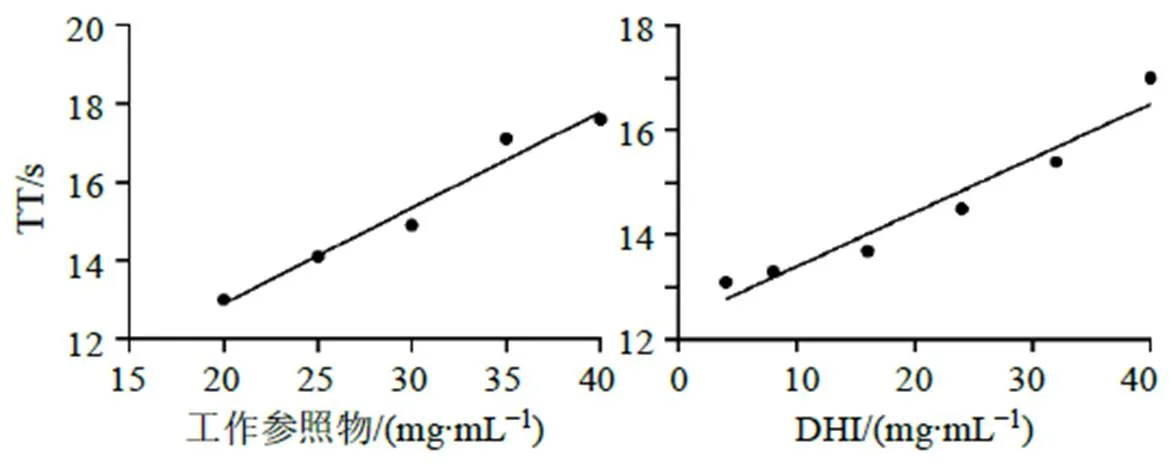
图4 工作参照物与DHI线性关系
2.3.2 可靠性检验 取20031004批次DHI,按照“2.2”项中工作参照物和DHI供试品制备方法制备工作参照物和DHI供试品,检测二者TT,并通过生物统计软件BS2000进行可靠性检验。可靠性检验是检验标准品(S)和供试品(T)的2条直线是否平行的检验,即验证S和T的剂量反应关系是否显著偏离直线、平行,对不是显著偏离直线、平行的结果,认为可靠性成立,方可计算T的效价和可信限[24]。根据《中国药典》2020年版四部中量反应平行线法可靠性检验结果成立的判别要求,量反应平行线(3.3)法可靠性测验的结果,回归项应非常显著(<0.01),偏离平行、二次曲线、反向二次曲线各项均应不显著(>0.05)。DHI抗凝血活性可靠性检验中回归项和二次曲线项用来检验S和T是直线还是二次曲线关系,结果中回归项极显著(<0.01),说明随着工作参照物S和DHI T的给药剂量的增加,TT也逐渐有规律的增加,即量效呈直线关系。偏离平行项和反向二次曲线用来检验S和T的平行性,回归项极显著,偏离平行以下各项都不显著,则S和T为平行直线。结果中偏离平行、二次曲线、反向二次曲线均不显著(>0.05),说明S和T 2条直线是平行关系(表1)。说明本方法能通过可靠性检验,可认为S和T具有同质性,所以T的生物效价可看作为稀释或浓缩一定倍数的S的生物效价。
2.3.3 精密度考察 取20031004批次DHI,按照“2.2”项中DHI供试品制备方法制作DHI供试品溶液,检测TT,并通过BS2000进行效价测定,连续测定6次。结果,连续6次测定均能够通过可靠性检验,求得效价值的RSD值为5.19%,说明仪器的精密度良好。
表1 DHI抗凝血活性可靠性检验结果
Table 1 Reliability test results of DHI anticoagulant activity
变异来源自由度差方和方差F值P值 试品间10.0420.042<1.000>0.05 回归115.01615.01620.814<0.01 偏离平行11.8911.8912.621>0.05 二次曲线10.0350.035<1.000>0.05 反向二次曲线10.0050.005<1.000>0.05 剂间516.9893.3984.710<0.01 误差1812.9860.721
2.3.4 重复性考察 取20031004批次DHI,按照“2.2”项中DHI供试品制备方法平行制备6份DHI供试品溶液,检测TT,并通过BS2000进行效价测定。结果,供试品溶液均通过可靠性检验,效价值的RSD值为4.91%,表明所用方法重复性良好。
2.3.5 稳定性考察 取20031004批次DHI,按照“2.2”项中DHI供试品溶液制备方法制作DHI供试品溶液,分别于制备好后的0、1、2、3、4 h检测TT,并通过BS2000进行效价测定。结果,5次测定的效价值RSD为8.06%。这说明为了保证结果的准确可靠,供试品最好现配现用。
2.3.6 DHI抗凝血活性生物效价测定 按照“2.2.3”和“2.2.4”项下方法分别制备工作参照物和供试品溶液,按照“2.2.1”项下TT检测方法测定。以工作参照物溶液为S组,各DHI供试品溶液为T组,按照《中国药典》2020年版四部和《药品生物检定》中量反应平行线(3.3)法[9,23],将各剂量组所得的TT时间填入BS2000,设定相邻剂量间比值为0.8,并估计DHI效价值4000 U/mL,采用完全随机设计实验,并通过可靠性检验的结果判断S和T是否平行,计算DHI的效价(Pt)及可信限率(FL)。结果表明(表2),10批次合格样品均可以通过可靠性检验,平均效价值为3 998.5 U/mL与估计效价值4000 U/mL相近,说明对DHI的估计效价值准确。正常DHI效价值为3700~4300 U/mL。
表2 10批次正常DHI可靠性检验及生物效价结果
Table 2 Reliability test and biological potency results of 10 batches of normal DHI
批号P值效价值/(mg∙mL−1)平均效价/(mg∙mL−1)可信限率/% 回归偏离平行二次曲线反向二次曲线 20061020<0.01>0.05>0.05>0.054 018.03 998.514.3 19101025<0.01>0.05>0.05>0.053 711.9 17.6 20031019<0.01>0.05>0.05>0.053 863.4 11.0 20071020<0.01>0.05>0.05>0.053 833.9 14.7 20111019<0.01>0.05>0.05>0.054 100.0 15.9 20011002<0.01>0.05>0.05>0.054 268.6 15.6 20031004<0.01>0.05>0.05>0.053 733.7 11.5 20061007<0.01>0.05>0.05>0.053 843.6 18.1 20041004<0.01>0.05>0.05>0.054 120.2 12.2 20101005<0.01>0.05>0.05>0.054 284.2 13.6
2.3.7 光照、高温、暴露处理DHI抗凝血活性生物效价测定结果 光照、高温、暴露处理的DHI样品的可靠性结果和效价的结果如表3。结果表明,光照处理的DHI样品8个批次的可靠性检验偏离平行项、二次曲线项或反向二次曲线项均有出现极显著差异(<0.01)或显著差异者(<0.05),说明这些批次的S和T 2直线不能平行,即不能通过可靠性检验,不符合《中国药典》2020年版对量反应平行线(3.3)法可靠性检验的规定。而通过可靠性检验的L20011002、L19101025 2个批次效价值较合格样品有显著降低,均低于正常DHI效价范围。造成这种结果的原因可能是因为光照使得其中活性成分发生变化有关。比如酚酸类成分多含有酯键、呋喃环、羧基、邻二酚羟基、羟基、双键和酚羟基结构,光照条件下易产生自由基,进而引发链反应,促进C-C或C=C断裂[25],或酚酸类成分中,酯键、不饱和键、酚羟基等因光照发生氧化缩合反应[26]。上述原因均可破坏DHI的原本物质内涵,改变其化学成分组成,并在生物效价中得以体现。
表3 光照、高温、暴露DHI可靠性检验与生物效价结果
Table 3 Reliability test and biological potency results of DHI exposed to illumination, high temperature and exposure
处理因素批号P值效价值/(mg∙mL−1)平均效价/(mg∙mL−1)可信限率/% 回归偏离平行二次曲线反向二次曲线 光照样品L20111019<0.01>0.05<0.05<0.05−3 529.1− L20101005<0.01<0.01>0.05>0.05− − L20061020<0.01<0.01>0.05>0.05− − L20071020<0.01>0.05<0.01>0.05− − L20031019<0.01>0.05<0.05>0.05− − L20061007<0.01<0.01<0.05<0.01− − L20041004<0.01<0.01>0.05<0.01− − L20031004<0.01<0.05<0.01>0.05− − L20011002<0.01>0.05>0.05>0.053 406.1 16.0 L19101025<0.01>0.05>0.05>0.053 652.0 15.4 高温样品T20111019<0.01<0.05>0.05>0.05−4 106.6− T20101005<0.01>0.05>0.05>0.054 138.2 9.6 T20061020<0.01>0.05<0.01<0.05− − T20071020<0.01<0.05<0.05<0.05− − T20031019<0.01<0.01<0.05<0.05− − T20061007<0.01<0.05<0.01<0.01− − T20041004<0.01<0.01<0.05<0.05− − T20031004<0.01<0.01>0.05<0.01− − T20011002<0.01>0.05>0.05<0.05− − T19101025<0.01>0.05>0.05>0.054 075.0 14.0 暴露样品E20111019<0.01<0.05<0.01<0.01−−− E20101005<0.01<0.01>0.05>0.05− − E20061020<0.01<0.01>0.05>0.05− − E20071020<0.01<0.05<0.05<0.05− − E20031019<0.01>0.05<0.01<0.05− − E20061007<0.01>0.05<0.05>0.05− − E20041004<0.01<0.01<0.01>0.05− − E20031004<0.01>0.05<0.05>0.05− − E20011002<0.01>0.05>0.05<0.05− − E19101025<0.01>0.05<0.05<0.05− −
“−”表示样品未通过可靠性检验,故不做生物效价及可信限率计算
“−” it indicated that the sample failed the reliability test, so the biological potency and credible limit rate were not calculated
高温处理的DHI样品8个批次的可靠性检验偏离平行项、二次曲线项或反向二次曲线项均有出现极显著差异(<0.01)或显著差异者(<0.05),说明这些批次的S和T 2直线不能平行,即不能通过可靠性检验,不符合《中国药典》2020年版对量反应平行线(3.3)法可靠性检验的规定。而通过可靠性检验的T20101005、T19101025 2个批次DHI样品效价值与正常DHI相比无明显差异。造成这种结果的原因可能是由于成分受温度变化较小引起,比如多糖在超过80 ℃会发生降解;丹酚酸B的含量在超过60 ℃时会大大降低,而丹参素、原儿茶醛的含量会相应增加,使得最终酚酸类成分没有显著变化甚至可能有些提高[27]。或者红花中的成分可能在高温的情况下发生降解,生成较多的对香豆酸产物,香豆酸的积累使得总的生物效应没有显著变化[28]。
暴露处理的10批DHI可靠性检验中回归项、偏离平行项、二次曲线项和反向二次曲线项均有出现极显著(<0.01)或显著(<0.05)的情况,说明这些暴露处理的DHI均不能通过可靠性检验。这可能是由于长期暴露于空气中,注射液中的多糖等成分使得微生物滋生,微生物或空气中的氧气使丹参中酚酸类成分发生氧化、开环等反应造成的。
3 讨论
生物检定的方法有量反应平行线和质反应平行线的方法,本实验检测的TT属于量反应,适合使用量反应平行线的方法进行效价的测定。《中国药典》2020年版量反应检定主要有(2.2)法、(3.3)法、(4.4)法[9,23]。(2.2)法中,因为S和T均是两个剂量,而2点间又总是直线,因此当S和T实际上是二次曲线的关系时,(2.2)法便不能准确的反应受检药物的量效关系。本实验选用的(3.3)法反应点较(2.2)法更多,比(2.2)法更能准确的反应受检药物的量效关系,一旦剂量超出回归的剂量范围,就可能出现偏离直线、偏离平行、二次曲线、反向二次曲线等不符合可靠性检验的结果,由此可见(3.3)法更能反映出因剂量安排不当所存在的问题,所得结果更为可靠[23]。量反应平行线(4.4)法反应点更多,但是条件苛刻,步骤繁琐,未被广泛采用,而(3.3)法应用广泛。
生物效价测定要与其功效密切相关,DHI抗凝活性的测定与其活血化瘀的功效直接相关,经上述条件测定和方法条件优化,本研究以TT为DHI抗凝血活性评价指标,并配置工作参照物标定了其抗凝血活性,通过对条件的探索与优化,建立了量反应平行线(3.3)法测定DHI抗凝血活性的方法。分别对10批正常DHI及光照、高温、暴露处理的DHI进行效价测定,发现所使用的方法可用于正常DHI生物效价测定,DHI的效价值为3700~4300 U/mL;与正常DHI相比,可将光照及暴露处理的DHI全部检出,对高温处理的DHI检出率为80%。
同时,本课题组对上述样品同步开展了化学指纹图谱测定,结果为经光照、高温处理的样品化学指纹图谱与正常样品相似度均>0.90,但多数特征峰的峰面积有所下降,而暴露处理的样品化学指纹图谱与正常样品存在较大差异(相似度<0.90)。进一步研究发现样品指纹图谱与效价结果存在较强的关联性:光照处理样品中的某些成分如丹酚酸类易发生水解、开环等反应,药物化学成分的改变是导致指纹图谱改变和效价值降低的重要原因。另据报道在较高温度下(一般为80 ℃以上)可使丹酚酸类成分降解为丹参素、咖啡酸等小分子酚酸类活性成分[25,29],而本研究测定的高温处理的样品与正常样品的化学指纹图谱相似度在0.90以上,可能的原因为本实验高温加速条件按有关要求设定为60 ℃,同时高温造成的酚酸类降解过程中存在逆反应过程[25]。
尽管如此,生物效价测定仍能检出80%的高温加速处理样品。暴露处理的样品化学指纹图谱中丹酚酸A缺失,由于该成分是重要活性成分之一,因此这些样品在指纹图谱相似度及效价方面均与正常样品有较大差异。以上表明生物效价的质量评控方法可提高加速处理样品的检出率,并且所得结果与DHI的活血化瘀的功效更相关。
综上,本实验以TT值为抗凝血活性评价指标,通过量反应平行线(3.3)法建立了DHI抗凝血生物效价测定方法,该方法精密度、重复性好,结果可靠。然而,生物效价检测用工作对照品的制备有待规范,所建立的测定条件和方法的稳定性还有待进一步提高,本课题组将进一步深入研究,最终将建立规范的基于生物效价检测的DHI质量评价方法。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄婷. 昆山市中药注射剂不良反应回顾性分析 [J]. 现代医药卫生, 2019, 35(11): 1643-1646.
[2] 董子洵, 冯佳佳, 林丽开. 中药注射剂在呼吸系统疾病的应用研究 [J]. 中国研究型医院, 2019, 6(6): 20-25.
[3] 董子洵, 冯佳佳, 林丽开. 中药注射剂在心血管疾病的应用研究 [J]. 中国研究型医院, 2019, 6(6): 25-32.
[4] 张培, 陈晓双, 李静, 等. 《新型冠状病毒肺炎诊疗方案》推荐的中药注射剂应用解析 [J]. 中国药业, 2020, 29(10): 12-15.
[5] 项丽玲, 苗明三. 中药质量生物学评价的思考 [J]. 时珍国医国药, 2020, 31(6): 1437-1439.
[6] 肖小河. 走向精准的中药质量评价与控制 [J]. 药学学报, 2019, 54(12): 2139-2140.
[7] 李寒冰, 吴宿慧, 牛明, 等. 中药品质生物评价的历史与发展 [J]. 中草药, 2017, 48(14): 2809-2816.
[8] 肖小河, 王伽伯, 鄢丹. 生物评价在中药质量标准化中的研究与应用 [J]. 世界科学技术—中医药现代化, 2014, 16(3): 514-518.
[9] 中国药典[S]. 四部. 2020: 208-212, 457-459, 488-489.
[10] 李寒冰, 鄢丹, 武彦舒, 等. 基于抗病毒活性检测的板蓝根质量生物评价方法及优化研究 [J]. 中草药, 2011, 42(8): 1560-1565.
[11] 王玄, 甘奇超, 史景彦, 等. 水蛭抗血小板聚集生物效价检测方法研究 [J]. 药学学报, 2019, 54(12): 2178-2183.
[12] 谭鹏, 张海珠, 李洋, 等. 基于活血生物效价检测大黄中10个蒽醌类成分抗血小板聚集作用初步研究 [J]. 中草药, 2018, 49(4): 859-865.
[13] 陈二林, 李喜香, 伍珊娜, 等. 基于活血生物效价的当归质量评价研究 [J]. 中药材, 2019, 42(4): 818-821.
[14] 赵小梅, 浦仕彪, 赵庆国, 等. 基于谱-效相关分析的雷公藤致肝毒性物质基础的初步研究 [J]. 中国中药杂志, 2016, 41(15): 2915-2921.
[15] 万学红, 卢雪峰. 诊断学 [M]. 第8版. 北京: 人民卫生出版社, 2013: 294.
[16] 冯五文. 基于化学指纹图谱与生物评价联用的红花注射液质量一致性研究 [D]. 成都: 成都中医药大学, 2016.
[17] 华芳, 赵玉玲, 李莞, 等. 川芎及其中成药抗凝血作用测定方法的研究 [J]. 中草药, 2019, 50(7): 1698-1702.
[18] 陈广云, 吴启南, 王新胜, 等. 生物效价测定法用于活血化瘀中药三棱品质评价的研究 [J]. 中国中药杂志, 2012, 37(19): 2913-2916.
[19] 梁萌萌. 红花注射液生产过程羟基红花黄色素A迁移转化及活性研究 [D]. 太原: 山西大学, 2019.
[20] 李寒冰. 板蓝根质量生物评价与控制方法的研究及应用 [D].成都: 成都中医药大学, 2009.
[21] 李亚, 高文慧, 唐民科. 丹参配方颗粒及丹参超细粉抗脑缺血再灌注损伤作用的比较研究 [J]. 北京中医药大学学报, 2018, 41(4): 294-300.
[22] 刘星星, 董莉, 张晓红, 等. 止血生物效价用于白及品质评价的研究 [J]. 中国中药杂志, 2014, 39(19): 3764-3767.
[23] 周海钧. 药品生物检定 [M].北京: 人民卫生出版社, 2005: 93-126.
[24] 张贵君, 李晓波, 李仁伟, 等. 常用中药生物鉴定 [M]. 北京: 化学工业出版社, 2006: 161-193.
[25] 李思谦, 章顺楠, 周立红, 等. 丹参中酚酸类成分及在水溶液中降解转化研究进展 [J]. 辽宁中医药大学学报, 2020, 22(4): 109-117.
[26] 付军伟, 赵育, 任娜梅, 等. 番茄醋发酵阶段产物抗氧化成分和色泽变化研究 [J]. 西北农业学报, 2018, 27(12): 1844-1854.
[27] 喻芬, 万娜, 李远辉, 等. 中药材干燥过程中的理化性质变化规律与机制分析 [J]. 中草药, 2021, 52(7): 2144-2153.
[28] Fan L, Pu R, Zhao H Y,. Stability and degradation of hydroxysafflor yellow A and anhydrosafflor yellow B in the Safflower injection studied by HPLC-DAD-ESI-MSn[J]., 2011, 20(1): 47-56.
[29] 曹雪晓, 王蕾, 任晓亮, 等. 注射用丹参多酚酸稳定性研究及其稳定性指示性分析方法的建立 [J]. 中国实验方剂学杂志, 2020, 26(2): 129-134.
Quality evaluation of Danhong Injection based on anticoagulant biological potency
ZHANG Yu-hang1, YANG Jing1, WU Su-hui1, LI Han-bing1, TANG Jin-fa2
1. Henan Health-Aging Engineering Research Center, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Henan Province Engineering Research Center for Clinical Application, Evaluation and Transformation of Traditional Chinese Medicine, The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, China
To establish a method for determining the anticoagulant biological potency of Danhong Injection (DHI) with thrombin time (TT) as an index, so as to evaluate its quality.Ten batches of qualified DHI were collected and subjected to stability acceleration under illumination, high temperature and exposure, yielding 40 batches of samples. The working reference substances were prepared by mixing salvianolic acid B, hydroxysafflor yellow A and excipients (1:1:8), and preparing to a concentration of 40 mg/mL. According to the “quantitative reaction parallel line (3.3) method” to design anticoagulant activity determination experiment, the plasma used was the plasma of four rabbits mixed in an equal ratio, the interval between drugs was 1:0.8, and the TT value was measured by a-automatic coagulation analyzer. The linear relationship, reliability, precision, repeatability and stability were investigated, and the detection conditions were optimized and determined. That is, the reaction system was 100 μL plasma + working reference substances or sample solution 50 μL + 100 μL thrombin reagent, and the biological potency of the samples was detected.The linear relationship with TT was good when the working reference substance and DHI were in the range of 20—40 mg/mL, with thevalues being 0.982 7 and 0.969 6. The biological activity test results showed that the working reference and qualified DHI had significant anticoagulant activity, and the results could pass the reliability test. The biological potency values of 10 batches of DHI were in the range of 3700—4300 U/mL. Compared with the results of biological potency of samples after accelerated treatment, the samples treated with exposure and light could be detected completely, and the detection rate of high temperature treatment of DHI was 80%.The established biological potency method can be used for the determination of biological potency and quality evaluation of DHI. The method has high precision, good repeatability and reliable result.
biological potency; Danhong Injection; quantity reaction parallel lines; thrombin time; quality evaluation
R283.6
A
0253 - 2670(2022)08 - 2348 - 08
10.7501/j.issn.0253-2670.2022.08.011
2021-11-16
河南省中医药科学研究专项(20-21ZY1001)
张宇航,男,硕士研究生,研究方向为中药药效物质基础及机制。E-mail: 1159861886@qq.com
吴宿慧,女,博士,硕士研究生导师,研究方向为中药药理学。E-mail: wusuhui@hactcm.edu.cn
唐进法,男,主任药师,研究方向为中药质量评价及合理应用。E-mail: a0519@163.com
[责任编辑 郑礼胜]
