光核桃AmUsp A蛋白的表达特性及功能研究
2022-04-19任梓齐毕雪奇张力文罗秋香
任梓齐,毕雪奇,张力文,陈 宇,罗秋香
(东北林业大学东北盐碱植被恢复与重建教育部重点实验室/生命科学学院,哈尔滨,150040)
普遍胁迫蛋白(universal stress proteins,Usps)是由不同胁迫条件诱导产生的一系列蛋白质,普遍存在于细菌和其他生物体中,在非生物胁迫应答反应中起重要作用。研究表明,该蛋白几乎与所有胁迫和饥饿应答有关。Usp蛋白属于自磷酸化丝氨酸和苏氨酸的磷酸化蛋白,可以使用GTP或ATP作为磷酸供体。C端存在UspA结构域,UspA结构域是一段长度为140~160aa的高度保守序列,该结构域在物质运输、信号转导、细胞防御和抗氧化应激反应中发挥重要的作用。
大肠杆菌的UspA是最先被发现的Usp蛋白。根据Usp蛋白的结构和氨基酸序列,来自大肠杆菌的Usps被分为4类:第1类(UspA、UspC、UspD)命名为UspA亚家族;第2类(UspF和UspG)命名为UspFG亚家族;以及第3类和第4类(UspE的两个结构域)。同一类Usp蛋白除了形成同源二聚体外,还可能形成异源二聚体,并且二者之间可以相互转化,这可能是Usp具有多种生物学功能的原因。UspA亚家族也可分为两大类:一类包含ATP结合位点,可能具有ATP酶或ATP介导分子开关的生化功能,如詹氏甲烷球菌的MJ-0577(1MJH);另一类不包含ATP结合位点,如流感嗜血杆菌的1JMV和大肠杆菌的UspA家族蛋白。MJ-0577类Usp蛋白ATP结合保守结构域的特征序列是G-2X-G-9X-G[S/T](ATP-binding Motif)。UspA结构域的差异提示它们可能具有不同的细胞功能,所以有必要对具体蛋白功能进行具体分析。
近年来,由于土壤盐碱化加剧以及水资源稀缺,非生物胁迫如盐碱、干旱、氧化等严重影响了植物的生长发育,逐渐成为我国农林业发展的重要限制因素。Usp
基因作为胁迫响应基因之一,在非生物胁迫防御反应中发挥了关键的作用。目前,植物中只有少数Usp
基因被克隆和分离出来,如在亚洲棉中,GUsp1
与GUsp2
被发现在干旱胁迫后植物的根、茎、叶中表达量均上调,并且转GUsp1
基因植株相比对照植株在干旱胁迫下生长状况更好;过表达新疆野苹果MsUspA
能够显著提高转基因拟南芥在极端干旱条件下的生存能力;过表达番茄SpUsp
基因明显提高了番茄苗期和成熟期的抗旱性;海篷子SbUsp
基因的表达受盐、干旱、冷和热胁迫的诱导,在烟草中过表达SbUsp
可以缓解盐或渗透胁迫;此外,过表达野苜蓿MfUsp1
基因提高了转基因烟草对低温、盐分、渗透和氧化胁迫的耐受性。光核桃(Amygdalusmira
Koehne)为蔷薇科(Rosaceae)桃属(Amygdalus
)落叶乔木,主产于西藏,其树体高大,生长迅速且寿命长,是我国II级保护植物。此外,光核桃还具有较强的固持土壤功能,并且拥有如耐寒、耐旱、耐贫瘠等多种优良特性,具有较高的生态、经济、药用价值,是西藏野生果树分布最广的种质资源之一,同时也是国内外罕见的桃种质资源的“活化石群”。在促进桃属资源进化、增强抗性和培育新品种等方面发挥重要的作用。尽管Usp蛋白在植物中广泛存在,但是在光核桃中有关Usp
基因的研究仍未见报道。因此,本试验从团队前期对干旱胁迫下光核桃叶片与根部蛋白质组进行研究时,筛选到的一批表达量受干旱胁迫诱导骤升、而复水后骤降的功能蛋白基因中,选择了上调表达比较明显的AmUspA
基因,进一步研究其分子作用机制以及该蛋白与逆境的应答关系并对其进行功能解析,致力于为探究光核桃抗逆性分子机制奠定基础,同时为今后优化植物抗逆性品种提供科学依据,具有重要的理论与现实意义。1 材料和方法
1.1 材料与试剂
植物材料为新鲜幼嫩的西藏光核桃叶片;大肠杆菌菌株(E.coli
)DH5α、JM109(DE3)、BL21、原核表达载体pET-21a保存于本实验室;植物RNA提取试剂盒、质粒小提试剂盒、胶回收试剂盒购自Omega Bio-tek公司;反转录试剂盒购自康为世纪;pMD-18Tvector、Ex-Taq DNA Polymerase、限制性内切酶、T4 DNA Ligase购自TaKa⁃Ra;双色预染蛋白分子量Marker(PPM15015)购自REBIO;His-Tag纯化树脂(Ni-NTA HISBIND RESIN)购自NO⁃VAGEN;其他试剂均为国产分析纯。1.2 AmUspA基因的克隆及融合表达载体的构建
由于光核桃与碧桃(Prunus persica
)同科同属,亲缘关系较近,因此推测光核桃与碧桃的UspA
基因序列应具有较高的同源性。根据NCBI数据库上检索获得的碧桃(PpUspA
)的基因序列,利用Primer 5.0设计一对编码区特异性引物(AmUspA
-F:5’-ATGGGGGGTGAGCCAACT-3’,AmUspA
-R:5’-TCAGTCATCAACAGGATCCT⁃GA-3’)。使用植物RNA提取试剂盒提取光核桃叶片总RNA,用反转录试剂盒对所提取的浓度质量较高的RNA进行反转录,获得光核桃cDNA。以cDNA为模板进行PCR扩增,回收片段连接到PMD-18T载体上,连接产物转入大肠杆菌DH5α感受态细胞中,菌液涂布于含Amp的LB固体培养基上培养过夜,挑取单克隆进行菌落PCR鉴定,并将阳性单克隆菌落培养后送库美公司测序,结果表明AmUspA
基因序列全长为528bp。使用pET-21a作为AmUspA重组蛋白的融合表达载体,引物序列为(PET21a-AmUspA-F:5’-GAATTCAT⁃GGGGGGTGAGCC-3’,PET21a-AmUspA-R:5’-CTCGAGGTCATCAACAGGATCCTG-3’,下划线处分别为Eco
RΙ和Xho
Ι酶切位点),载体构建成功后提质粒与pET-21a质粒分别用Eco
RΙ和Xho
Ι双酶切,在T4连接酶作用下于16°C过夜连接,连接产物转化蛋白表达菌株BL21后进行菌落PCR鉴定并提取质粒DNA。质粒DNA进行双酶切鉴定后送样测序比对。1.3 生物信息学分析
对克隆成功的光核桃AmUspA
基因进行生物信息学分析:利用在线网站NCBI对光核桃AmUspA
基因进行ORF查找、进而对其氨基酸序列等进行分析。利用ExPASy-ProtParam分析蛋白质的基本理化性质、ExPasy-ProtScale分析蛋白质的亲疏水性、Pfam 3.1/InterPro预测蛋白质的功能域、TMHMM v2.0对蛋白质跨膜区进行预测分析、NetPhos 3.0分析蛋白质的磷酸化位点、使用SWISS-MODEL软件分析蛋白质的三级结构。在NCBI的Genebank数据库中下载AmUspA相关物种的同源序列,使用DNAMAN软件对氨基酸序列进行同源性比对,利用MEGA7软件以邻接法(Neighbor-Joining,NJ;bootstrap=2000)构建系统发育树:GeneMANIA对蛋白互作网络进行预测、STRING对蛋白互作网络进行功能富集分析、MEME对蛋白的motif进行分析。1.4 重组蛋白p ET21a-AmUsp A的小量诱导与表达条件优化
菌液活化至OD达到0.5~0.6时,对诱导时间(0,0.5,1,2,4,8h)、诱导温度(15,20,25,30,37°C)、IPTG浓度(0,0.1,0.5,1,1.5mmol·L)等条件进行探索,以优化重组蛋白的诱导条件。诱导表达结束后,收集菌体用pH值7.4的PBS缓冲液(140mmol·LNaCl,2.7mmol·LKCl,10mmol·LNaHPO,1.8mmol·LKHPO)重悬,超声破碎细胞。取20μL蛋白样品加入20μL 2×SDS上样缓冲液,沸水浴10min变性后冰浴5min;4°C、13000r·min离心1min;取20μL上清进行12%SDS-PAGE凝胶电泳,凝胶染色、脱色过夜后用扫描仪进行图像检测。
1.5 p ET21a-AmUsp A重组蛋白的大量诱导与纯化
将2mL过夜培养的菌液加入到1LLB液体培养基,37°C培养至OD达到0.5~0.6后,加IPTG至浓度为0.1mmol·L,37°C诱导8h后于4°C、7000r·min离心5 min,收集菌体沉淀。加入pH值8.0的Binding buffer(50mmol·LNaHPO,300mmol·LNaCl,10mmol·L咪唑)重悬菌体后低温超声裂解破碎,将超声裂解物于4℃、13000r·min离心20min,取上清进行重组蛋白纯化。
采用Novagen公司的Ni-NTA HISBIND RESIN纯化pET21a-AmUspA重组蛋白。加入5倍柱体积的Bind⁃ing buffer平衡纯化柱,上样后加入2倍柱体积的Binding buffer洗去纯化柱中未结合的蛋白。再依次加入5倍体积20mmol·L咪唑的Washing buffer、4倍体积50mmol·L咪唑的Washing buffer分别进行柱清洗,最后加入3倍体积100mmol·L咪唑的Elution buffer进行洗脱。Elution buffer流出液全取样,Washing buffer各取样1mL。分别取20uL样品和10μL的2xloading buffer混匀,沸水浴5min后,SDS-PAGE检测纯化结果。采用透析法去除纯化蛋白中的盐分,将透析袋中的蛋白样品置于100×体积透析液(0.075mol·L磷酸缓冲液,0.15mol·LNaCl,0.002mol·LEDTA)4°C透析除盐48h,其间更换透析液2~3次。透析结束后采用Bradford’s测定纯化蛋白浓度,以牛血清白蛋白(BSA)为标准蛋白。
1.6 多种胁迫条件下p ET21a-AmUsp A蛋白在大肠杆菌中的表达
对照菌株pET21a和表达质粒pET21a-AmUspA的转化菌株分别在37°C的LB液体培养基中生长,直至在600nm处的吸光度为0.5,保证菌株生长密度一致后用0.1mmol·LIPTG诱导pET21a-AmUspA蛋白表达。将不同浓度(10,10,10,10,10)的培养液分别滴入含有400mmol·LNaCl、40mmol·LNaHCO、10μmol·LHO、2mmol·LCuSO、1mmol·L2-4D、1mmol·LZnSO、1.5mmol·LMnSO、1.5mmol·LFeSO、2mmol·LMgSO、10μmol·LNAA、10μmol·L6BA、100mmol·L甘露醇的LB琼脂平板上(浓度的选择是基于先前的大量试验中获得的信息,所有菌株在选定的浓度下都生长良好),在37°C条件下过夜培养,试验重复3次。
2 结果与分析
2.1 AmUspA基因的克隆及融合表达载体的构建
以光核桃叶片cDNA为模板扩增AmUspA
基因,结果如图1a。在约500bp位置得到一条亮度较高的单一条带,测序结果为528bp,与碧桃中的UspA
基因大小一致,说明成功克隆光核桃AmUspA
基因。在AmUspA
基因上下游分别添加Eco
RΙ和Xho
Ι酶切位点,为提高连接效率,首先将其构建到PMD18-T载体上,双酶切鉴定正确后再与原核表达载体pET-21a连接,将pET21a-AmUspA重组质粒转化至大肠杆菌菌株JM109(DE3),筛选阳性单克隆进行菌液PCR验证片段大小,提质粒后进行双酶切反应再次验证。电泳结果显示,酶切片段大小正确(图1b)。测序结果进一步表明原核表达重组质粒pET21a-AmUspA构建成功。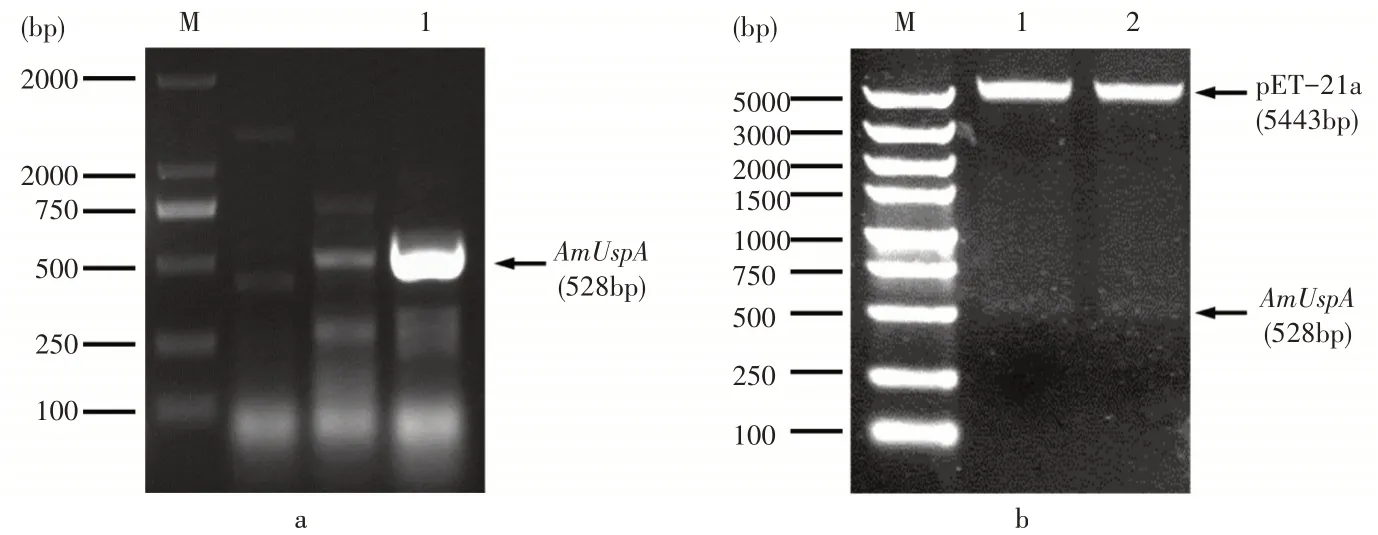
图1 AmUspA基因克隆及p ET21a-AmUsp A融合表达载体的构建Figure 1 Cloning of AmUspA gene and construction of p ET21a-AmUsp A fusion expression vector
2.2 生物信息学分析
通过ProtParam软件在线分析AmUspA蛋白质的理化性质得出其分子式为CHNOS,总原子数为2755,理论等电点(pI)为6.16,是酸性蛋白质,同时含有26个带负电荷氨基酸残基总数(Asp+Glu)和23个带正电荷残基总数(Arg+Lys),脂肪系数为79.54,亲水性指数(GRAVY)为-0.289,不稳定系数(II)为38.27,因此推测该蛋白属于亲水性的稳定蛋白。此外,在光核桃AmUspA
基因所编码的整个多肽链中氨基酸的亲疏水性整体分布为负值面积较大,推测该蛋白可能是亲水性蛋白,与理化性质分析结果相同(图2)。使用TMHMMv2.0对AmUspA蛋白进行在线分析发现其没有明显的跨膜区,即为非生物膜上的功能蛋白(图3)。利用NetPhos 3.0工具在线分析AmUspA蛋白的磷酸化位点,得出该蛋白含有的丝氨酸、苏氨酸和酪氨酸磷酸化位点数目分别为7,4,1(图4)。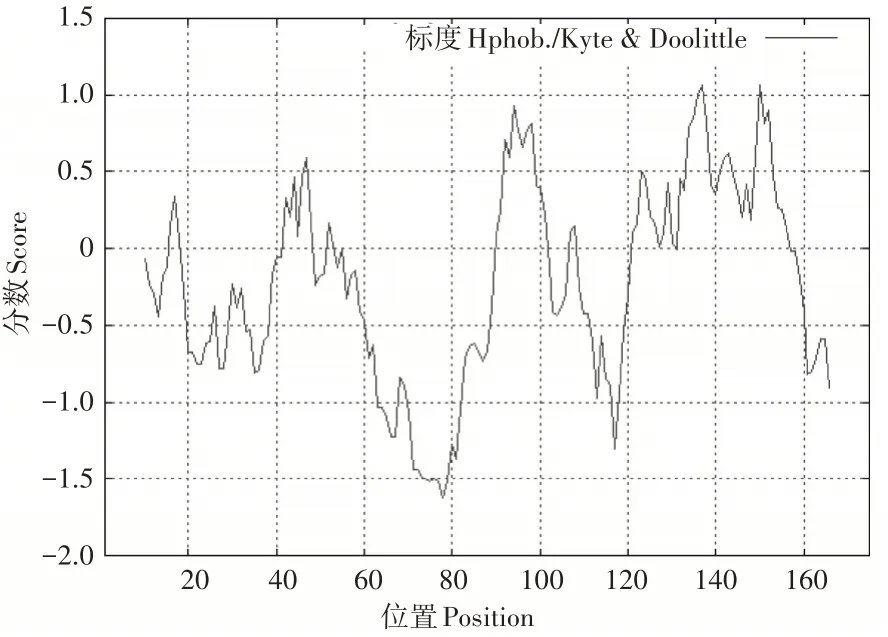
图2 AmUsp A蛋白的亲/疏水性分析Figure 2 Hydrophobic/hydrophilic analysis of AmUsp A
图3 AmUsp A蛋白的跨膜预测Figure 3 Transmembrane prediction of AmUsp A
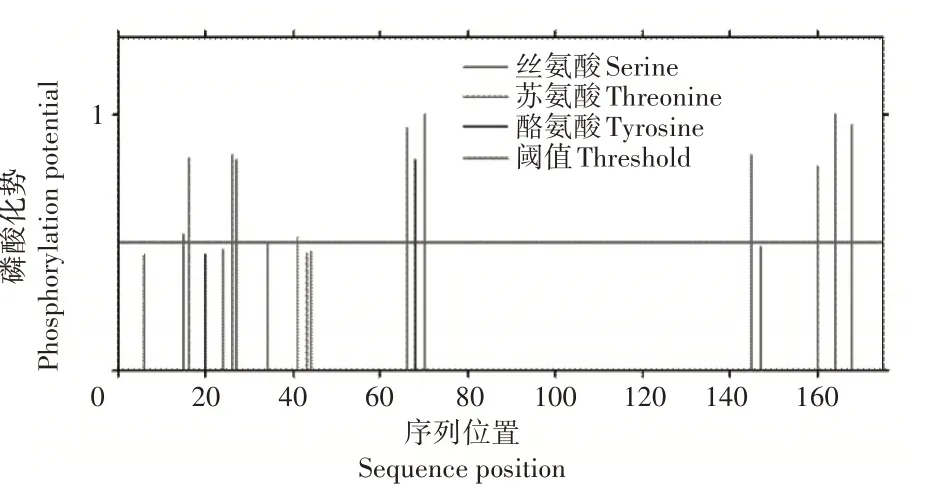
图4 AmUsp A蛋白的磷酸化位点预测Figure 4 Phosphorylation site prediction of AmUsp A
利用SWISS-MODEL在线软件分析AmUspA蛋白的三级结构并构建蛋白质三级结构模型,与二级结构预测结果相符合(图5)。

图5 AmUspA蛋白的三级结构预测Figure 5 Tertiary structure prediction of AmUsp A
利用DNA Man软件将光核桃AmUspA和其他物种UspA如:碧桃Prunus persica
XP_007215065.1;扁桃Prunus dulcis
XP_034209686.1;东京樱花Prunus yedoensis
PQQ15787.1;欧洲甜樱桃Prunus avium
XP_021824237.1;梅花Prunus mume
XP_008230589.1;苹果Malus domestica
XP_008341451.3;白梨Pyrus x bretschneideri
XP_009334088.1;月季花Rosa chinensis
XP_024179493.1;野草莓Fragaria vesca subsp.vesca
XP_004304628.1;东方苔草Trema orientale
PON33153.1;马铃薯Solanum tuberosum
XP006364005.1;醉蝶花Tarenaya hassleriana
XP_010550138.1;毛果杨Populus trichocarpa
XP_002324004.1;橡胶树Hevea brasiliensis
XP_021636308.1;枣树Ziziphus jujuba
XP_015879073.1;木槿Hibiscus syriacus
XP_039009901.1;潘那利番茄Solanum pennellii
XP_015059339.1;麻 风 树Jatropha curcas
XP_012081403.1;芝 麻Sesamum indicum
XP_011097436.1;陆地棉Gossypium hirsutum
XP_016751506.1;雷公藤Tripterygium wilfordii
XP_038704552.1;大麻Cannabis sativa
XP_030483917.1;哥伦比亚锦葵Herrania umbratica
XP_021298953.1;黄麻Corchorus capsularis
OMO59164.1;芥菜Capsella rubella
XP_006288772.1;胡桃Juglans regia
XP_018823017.2;大桉Eucalyptus grandis
XP_010033285.2;可可树Theobroma cacao
XP_007031491.2;澳洲棉Gossypium australe
KAA3464326.1;克莱门柚Citrus clementina
XP_006446520.1;欧洲栓皮栎Quercus suber
XP_023891789.1;松蒿Phtheirospermum japonicum
GFP99726.1;藜麦Chenopodium quinoa
XP_021769797.1;榴莲Durio zibethinus
XP_022739558.1;甜菜Beta vulgaris
XP_010675296.1;石榴Punica granatum
XP_031405237.1;林烟草Nicotiana sylvestris
XP_009759783.1;欧洲甜菜Brassica napus
XP_013714934.1;苦瓜Momordica charantia
XP_022134070.1;木薯Manihot esculenta
XP021595359.1;葡萄Vitis vinifera
XP010660904.1;辣椒Capsicum annuum
XP016569904.1的氨基酸序列进行对比,发现该蛋白的氨基酸序列与其他植物的UspA具有较高的同源性以及相似的保守区(图6)。利用MEGA3.1在线软件应用最大邻近法构建系统发育树后发现,光核桃AmUspA蛋白与碧桃、扁桃等植物的Usp蛋白亲缘关系较近(图7)。利用MEME在线软件分析光核桃AmUspA与其他植物Usp蛋白序列排名前3的motif(图8),可以看出它们具有相似的motif并且位置数目接近,表明光核桃AmUspA蛋白与其他植物的Usp蛋白具有相似的基序,可以进一步证明系统发育分析的可靠性。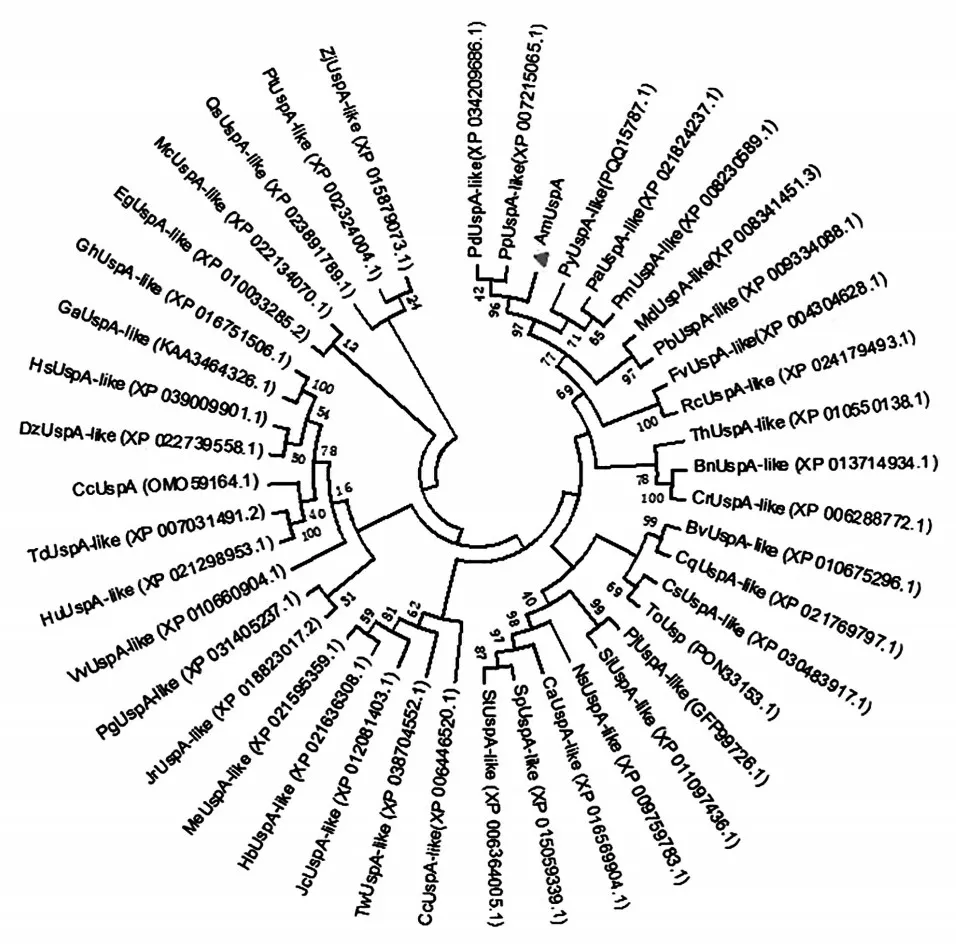
图7 AmUsp A蛋白与其他植物Usp蛋白的系统进化分析Figure 7 Phylogentic analysis of AmUsp A and other plant Usp proteins
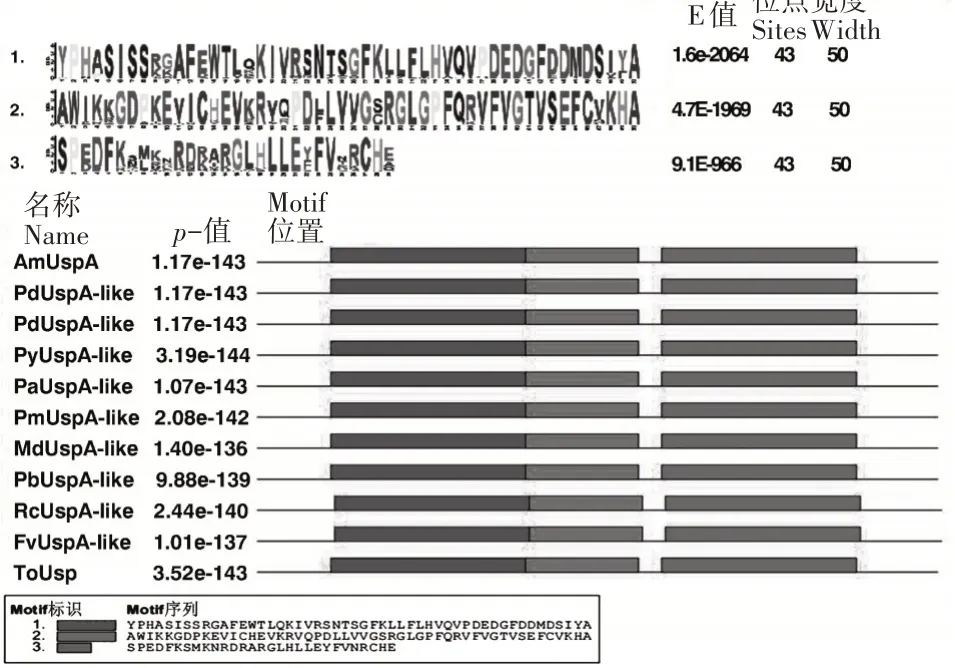
图8 AmUsp A蛋白与其他植物Usp蛋白的MEME聚类分析Figure 8 MEME cluster analysis of AmUsp A with other plant Usp proteins
使用GENEMANIA网站以大肠杆菌的UspA蛋白为中心,预测可能与其相关的互作蛋白(图9)。推测Us⁃pA、UspC、miaA、dinD、yhgF、ibpA、dglC这几个蛋白之间可能存在基因互作(绿色线);UspA、UspG、miaA、fucR、glgX、ompA蛋白之间可能存在共表达(紫色线);UspA、ibpA、yhgF、dinD、glgX、fucR蛋白之间可能存在共享蛋白质结构域(黄色线);UspA、UspD、ibpA、yhgF、dinD、glgX、yecE、fucR蛋白之间可能存在物理互作(粉色线)。
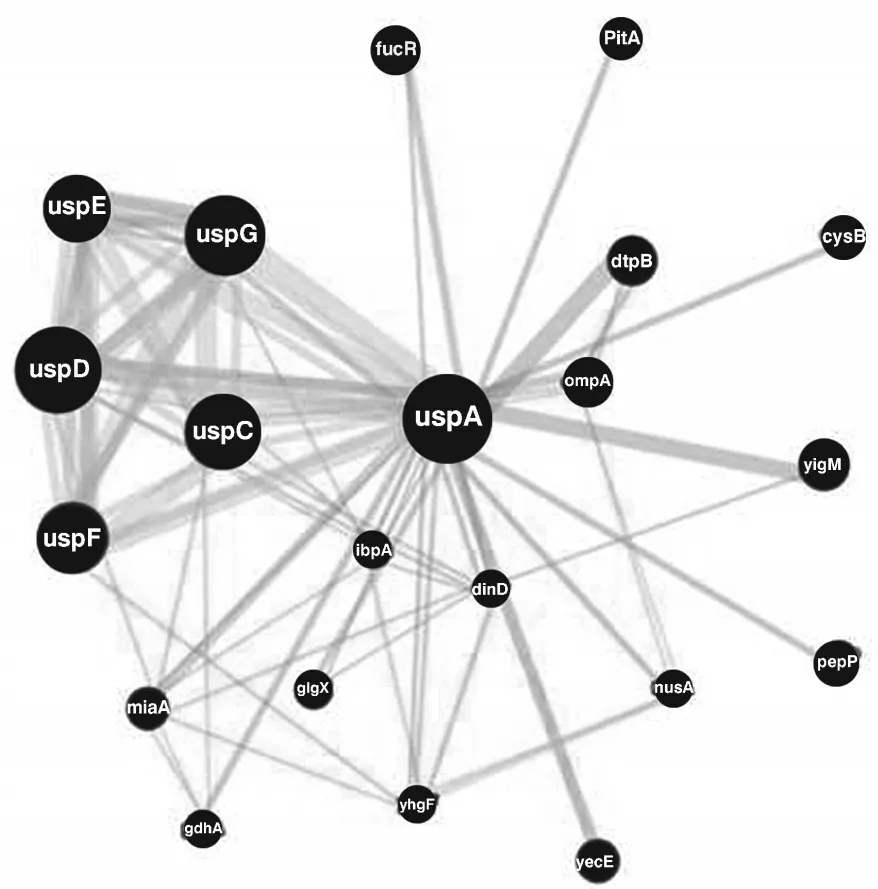
图9 AmUsp A蛋白的互作网络预测Figure 9 Protein interaction network prediction of AmUsp A
2.3 重组蛋白p ET21a-AmUsp A的小量诱导与表达条件优化
菌液活化后,加入诱导剂IPTG进行蛋白的小量诱导,进而优化重组蛋白的表达条件。首先,保持诱导温度为37°C,IPTG浓度为1mmol·L不变,改变诱导时间,分别诱导0,0.5,1,2,4,8h后收集菌体,结果显示,重组蛋白的表达量随时间的增加而升高,诱导8h达到最高(图10a)。其次,筛选诱导剂浓度,保持诱导时间8h,诱导温度37°C,改变IPTG浓度分别分0,0.1,0.5,1,1.5mmol·L。诱导结束后收集菌体,结果显示,蛋白在0.1mmol·LIPTG诱导条件下表达量达到最大(图10b)。最终筛选诱导温度,保持IPTG浓度为0.1mmol·L不变,诱导时间8h,改变诱导温度分别为15,20,25,30,37℃。诱导后收集菌体,结果显示,重组蛋白的表达量随诱导温度的增加而升高,在37℃时表达量最高(图10c)。筛选结果表明最优诱导条件为OD=0.5时,在37℃条件下加入0.1mmol·LIPTG诱导8h。
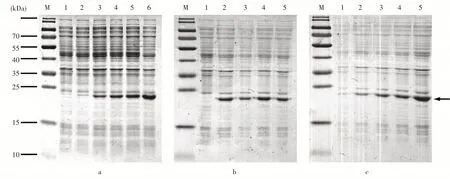
图10 重组蛋白p ET21a-AmUsp A的小量诱导Figure 10 Small volume induction of recombinant protein p ET21a-AmUspA
2.4 p ET21a-AmUsp A重组蛋白的大量诱导与纯化
对小量诱导蛋白粗提液进行纯化发现洗脱液中咪唑的浓度增加至50mmol·L时可以洗脱一部分目的蛋白,但是并不能完全洗脱下来,在咪唑浓度达到100mmol·L时可成功洗脱目的蛋白。将大量诱导得到的蛋白通过Ni-NTA纯化柱进行纯化,取每个阶段相对应的样品进行SDS-PAGE。样品通过纯化柱流出的液体标记为Ft(sample flowing through),50,100mmol·L咪唑冲洗流出的液体取样标记为W和W。蛋白纯化结果如图11。通过样品和流出液的对比可以发现在100mmol·L咪唑洗脱液中含大量单一目的蛋白条带,即纯度较高的融合蛋白。透析结束后采用Bradford’s测定纯化蛋白浓度为0.91mg·mL,共获得25mg纯化蛋白,加入终浓度为10%的甘油,-20°C保存,以备后续的抗体制备与蛋白活性分析。
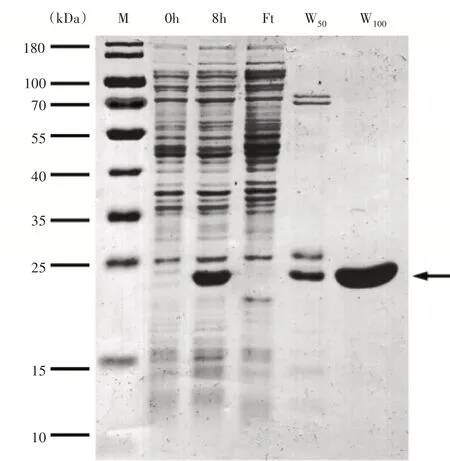
图11 重组蛋白p ET21a-AmUsp A大量诱导与纯化Figure 11 Bulk induction and purification of recombinant protein p ET21a-AmUsp A
2.5 多种胁迫条件下p ET21a-AmUsp A蛋白在大肠杆菌中的表达
为研究逆境胁迫下pET21a-AmUspA蛋白在大肠杆菌中的表达情况,比较了pET21a载体和pET21a-AmUs⁃pA转化子在大肠杆菌中的生长情况。可以看出在各种胁迫条件下转AmUspA
的菌株抗逆性均优于空载体,并且在400mmol·LNaCl、40mmol·LNaHCO、10μmol·LHO、100mmol·L甘露醇条件下优势显著(图12)。进一步证明了光核桃普遍胁迫蛋白基因UspA
具有对于多种环境胁迫的响应。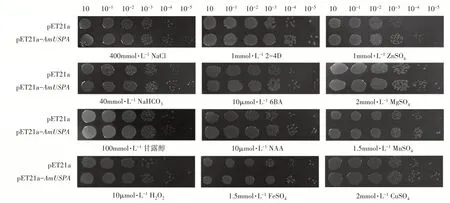
图12 多种胁迫条件下pET21a-AmUsp A蛋白在大肠杆菌中的表达Figure 12 Expression of p ET21a-AmUsp A protein in Escherichia coli under multiple stress conditions
3 讨论与结论
普遍胁迫蛋白Usps是一个保守的蛋白家族,在自然界中分布广泛,参与大量逆境胁迫应答反应。一般存在于细胞质中,可以由一个Usp结构域、两个串联的Usp结构域、一个或两个Usp结构域与其他功能结构域结合所组成,被认为是外界胁迫的生物传感器以及环境调节器,具有广泛的生物学功能。研究表明,当植物受到外界胁迫时Usp
基因表达量会明显上调,增强植物的抗逆性。在细菌中,UspA是唯一与特定生物学活性相关的Usp家族蛋白,并且UspA结构域具有DNA结合特性,推测其可能具有保护DNA的功能。KERK等在拟南芥中鉴定了44个编码含UspA结构域基因的序列和结构,并进行了系统发育分析,结果表明,它们都是从一个类似1MJH的祖先进化而来的。在此之后,一些Usp蛋白相继被报道在各种植物的抗逆性响应中发挥重要作用。ARABIA等报道了水稻基因组中的44个Usp
基因,证实与双子叶植物相比OsUsp
成员具有更高的保守性并具有多种胁迫响应性。在双子叶模式植物拟南芥中,编码普遍胁迫蛋白AtUsp(At3g58450)的基因受植物激素调控并参与拟南芥种子萌发,另外,拟南芥AtUsp
(At3g53990)启动子受植物激素和非生物胁迫的共同调控,并且AtUsp
的伴侣功能在保护植物免受热激、氧化和冷害胁迫方面起着至关重要的作用。WANG等从丹参中克隆了3个Usp
基因(SmUsp1
、SmUsp8
、SmUsp27
),并在大肠杆菌中鉴定其功能,与对照细胞相比,表达SmUsps
的细胞对盐、热以及两者结合的耐受性增强。CUI等用大肠杆菌验证了葡萄VvUspA蛋白的异源表达能提高大肠杆菌的对干旱胁迫的抗性。本研究在克隆出光核桃AmUspA
基因并对其进行详细的生物信息学分析的基础上,探索了不同诱导条件下pET21a-AmUspA重组蛋白的表达条件并对其进行优化,获得了大量纯度较高的AmUspA蛋白并制备抗体,为今后研究光核桃普遍胁迫蛋白的功能与特性奠定了基础。模拟多种胁迫条件下对照菌株pET21a和表达质粒pET21a-AmUspA的转化菌株在大肠杆菌中的表达,得出结论AmUspA
基因受多种胁迫诱导均有响应且表达上调,各种胁迫条件下转AmUspA
的菌株抗逆性均优于空载体,并且在400mmol·LNaCl、40mmol·LNaHCO、10μmol·LHO、100mmol·L甘露醇条件下优势显著,进一步证明了AmUspA
基因具有对于多种环境胁迫的响应,推测该基因有可能在光核桃逆境防御反应中发挥作用。这一研究可以为丰富光核桃中逆境基因的相关作用机制提供理论基础,同时为提高非生物胁迫抗性提供了重要的遗传资源。