基于表面自聚合的多功能纳米探针制备及性能研究
2022-04-19汤雯边静
汤雯 边静
摘 要:针对传统纳米探针无法实现核磁共振成型和光热稳定性较差的问题,提出用表面自聚合方法,用PDA包覆Bi2S3,然后与具有MRI性能的Gd3+离子进行螯合,合成钆离子修饰的硫化铋@聚多巴胺(Bi2S3@PDA-Gd3+)复合纳米探针。通过光学成像仪、磁共振成像仪和动物试验对其性能进行表征。结果表明:体外光声信号强度和体外T1磁共振强度与Bi2S3@PDA-Gd3+浓度表现出良好的线性关系;小鼠尾部静脉注射Bi2S3@PDA-Gd3+8 h后,光声强度值最高为490.424 a.u,随时间的增加,仍表现出良好的光声成像性能;在T1状态下磁共振成像发现,注射4 h后,Bi2S3@PDA-Gd3+在肿瘤处富集,增加肿瘤明亮度。随时间改变,成像效果改变不明显。证实Bi2S3@PDA-Gd3+纳米探针能够为肿瘤诊断及治疗都提供了更精准的技术手段。
关键词:纳米探针;磁共振;光声成像;肿瘤治疗;硫化铋@聚多巴胺(Bi2S3@PDA-Gd3+)
中图分类号:TQ323
文献标识码:A文章编号:1001-5922(2022)03-0022-05
Preparation and properties of multifunctional nanoprobesbased on surface self-polymerization
TANG Wen, BIAN Jing
(Sichuan Kexuecheng Hospital, Chengdu 610000, China)
Abstract:
In order to solve the problem that the traditional nano probe could not achieve NMR molding and poor photothermal stability, surface self-polymerization method was proposed to synthesize gadolinium ion modified bismuth sulfide polydopamine by coating Bi2S3 with PDA and chelating with Gd3+ ion with MRI performance (Bi2S3@PDA-Gd3+) composite nanoprobe. Its performance was characterized by optical imager, magnetic resonance imager and animal experiment. The results showed that the intensity of photoacoustic signal in vitro and T1 magnetic resonance intensity in vitro were significantly different from that in vitro Bi2S3@PDA-Gd3+. The concentration showed a good linear relationship; Intravenous injection in the tail of mice Bi2S3@PDA-Gd3+ 8 h resulted the highest photoacoustic intensity of 490.424 a.u.. With the increase of time, it still shows good photoacoustic imaging performance; In T1 state, MRI showed that after 4 h of injection, Bi2S3@PDA-Gd3+ enrichment in the tumor, increase the brightness of the tumor. With the change of time, the imaging effect did not change significantly. confirm Bi2S3@PDA-Gd3+ nanoprobes can provide more accurate technical means for tumor diagnosis and treatment.
Key words:
nano probe; magnetic resonance imaging; photoacoustic imaging; cancer treatment; Bi2S3@PDA-Gd3+
光熱治疗是目前治疗肿瘤最有效的一种医学手段,通过光热探针产生局部高温,杀死病灶处肿瘤细胞。在光热治疗中引入成像技术可以有效提高治疗的精准性。但传统常用纳米探针无法实现核磁共振成型,因此多模式成像功能的纳米光热探针的合成是目前研究的重点。对此,我国很多学者也作出了一些研究,针对TME响应的19F-MR纳米分子成像探针进行深入研究,证实19F-MR纳米探针在特定条件下,可在分子水平早期可视化TME中的恶性生物学行为,为实现肿瘤早期诊断及精准治疗提供有利支持[1];用线粒体作为线粒体靶向AIE探针区分癌细胞与正常细胞的靶标,使得聚集诱导发光探针能对癌症细胞进行准确诊断[2];通过水热法合成荧光生物质碳点BCDs,并将其应用到细胞成像中[3];以上专家的研究为纳米探针的合成作出了贡献,但在纳米探针成像方面还存在不足。基于此,本文用表面自聚合方法合成钆离子修饰的硫化铋@聚多巴胺(Bi2S3@PDA-Gd3+)复合纳米探针。设计试验证实Bi2S3@PDA-Gd3+纳米探针能够为肿瘤诊断及治疗都提供了更精准的技术手段。
1 材料与方法
1.1 材料与设备
本试验主要材料:聚乙烯吡咯烷酮(PVP,山东豪顺化工有限公司,AR)、硫代乙酰胺(TAA,山东豪顺化工有限公司,AR)、甘露醇 (AR,山东富禾生物科技有限公司)、硫代乙酰胺 (AR,山东豪顺化工有限公司)、三(羟甲基)氨基甲烷 (BR,济南汇锦川化工有限公司)、六水合氯化铁(AR,山东力昂新材料科技有限公司)、盐酸多巴胺 (98%,西安泽朗生物科技有限公司)、六水合氯化钆(99.9%,山东力昂新材料科技有限公司)、超纯水(18 MΩ/cm,上海景纯水处理技术有限公司)。
本试验主要设备:精密电子天平(H0503,河北德科机械科技有限公司)、高速离心机(TG16KR,上海继谱电子科技有限公司)、紫外/可见光分光光度计(U-T6,屹谱仪器制造(上海)有限公司)、激光粒度仪(LS-POP(9),珠海市欧美克仪器有限公司)、光学成像仪(Nexus 128,广州云星科学仪器有限公司)、临床前紧凑型磁共振成像仪(uMR 560,上海联影医疗科技有限公司)。
1.2 试验方法
1.2.1 Bi2S3纳米颗粒的合成
(1)在25 mL纯水中溶入1 g PVP,搅拌均匀后加入甘露醇0.227 5 g和Bi(NO3)3·5H2O,充分搅拌使其完全溶解;
(2)用H0503型精密电子天平精准称取TAA 0.028 g,放入10 mL超纯水中,充分搅拌溶液;
(3)将以上步骤溶液混合,缓慢提升反应温度使其充分反应,反应温度和时间分别为100 ℃和1 h;
(4)取出反应产物,然后置于TG16KR型高速离心机中洗涤3次,离心转速和每次清洗时间分别为10 000 r/min和10 min。然后将洗涤后产物放入体积一定的超纯水中,搅拌使其充分溶解,配制成质量浓度为1 mg/mL的Bi2S3溶液备用。
1.2.2 Bi2S3@PDA钠米颗粒的合成
(1)用H0503型精密电子天平分别精准称取4.5 mg盐酸多巴胺、6.2 mg FeCl3·6H2O4,然后依次放入130 mL超纯水中,搅拌使其充分溶解。然后加入6 mL“1.2.1”配制的1 mg/mL Bi2S3溶液,搅拌使其充分反应,搅拌时间为1 h;
(2)用电子天平金精准称取450 mg三氨基甲烷,放入20 mL超纯水中,搅拌使其充分溶解。配制成为pH值为9.6左右的Tris缓冲液;
(3)将以上两个步骤溶液混合,在室温条件下充分搅拌,搅拌时间为2 h;
(4)将反应产物置于高速离心机中,在107 r/min转速下离心洗涤3次,每次洗涤时间为10 min。然后溶解于体积一定的超纯水中,配制成1 mg/mL的 Bi2S3@PDA溶液备用。
1.2.3 Bi2S3@PDA-Gd3+钠米颗粒的合成
(1)将浓度为0.1 mol/L的GdCl3溶液100 μL,倒入10 mL质量浓度为1 mg/mL的 Bi2S3@PDA溶液中,搅拌使其混合均匀,搅拌时间为1 h;
(2)将产物置于高速离心机中,在107 r/min转速下离心洗涤2次,然后溶于体积一定的超纯水中备用。
1.3 Bi2S3@PDA-Gd3+表征
1.3.1 紫外-可见光吸收
用U-T6型紫外/可见光分光光度计测定Bi2S3和Bi2S3@PDA的紫外-可见光吸收[4]。
1.3.2 Zeta 电位
用LS-POP(9)型激光粒度仪测定 Bi2S3@PDA和Bi2S3@PDA-Gd3+的Zeta 电位和水合粒径分布。
1.4 Bi2S3@PDA-Gd3+应用
1.4.1 体外光生成像试验
(1)分别取质量浓度为1、0.5、0.25、0.125和0.062 5 mg/mL的Bi2S3@PDA-Gd3+溶液各200 μL,将其放入200 μL的PCR管中,超纯水为空白对照组;
(2)用Nexus 128学成像仪,在800 nm 近红外脉冲激光条件下进行光生信号测试。
1.4.2 体外磁共振T1成像试验
(1)分别取质量浓度为400、200、100、50、25、12.5和6.25 mg/mL的Bi2S3@PDA-Gd3+溶液各200 μL。放入200 μL的PCR管中,超纯水为空白对照组;
(2)用uMR 560型临床前紧凑型磁共振成像仪进行磁共振成像试验。
1.5 动物试验
1.5.1 体内光学成像
在Hela 荷瘤裸鼠的尾部注射质量浓度为10 mg/mL的Bi2S3@PDA-Gd3+的PBS溶液200 μL。然后分别在注射0、2、4、8、24 h后,对Hela 荷瘤裸鼠用800 nm 近红外脉冲激光进行光声成像[5]。
1.5.2 体内磁共振T1成像
在Hela 荷瘤裸鼠的尾部注射質量浓度为10 mg/mL的Bi2S3@PDA-Gd3+的PBS溶液200 μL。然后分别在注射0、4、8、24 h后,对Hela 荷瘤裸鼠在T1磁场中进行磁共振成像试验。试验时,TR和TE分别为446 ms和15 ms。
2 结果与讨论
2.1 Bi2S3@PDA-Gd3+表征分析
2.1.1 紫外-可见光吸收表征
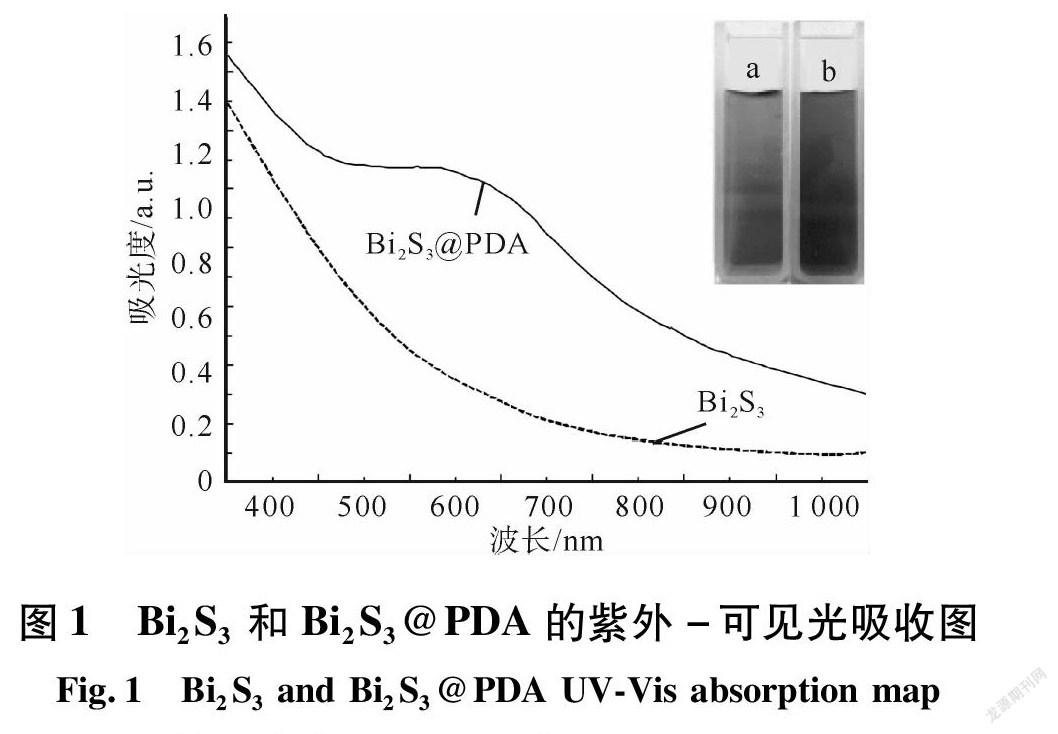
图1为Bi2S3和Bi2S3@PDA的紫外-可见光吸收图,插图a、b分别为Bi2S3和Bi2S3@PDA的水溶液图。
由图1可知,Bi2S3溶液表现为棕黄色;而Bi2S3@PDA的颜色则表现蓝黑色。观察图中曲线可知,Bi2S3在近红外区域吸收较弱;Bi2S3@PDA在近红外区域吸收明显的增加,且在650 nm左右出现明显吸收峰。研究发现,碱性条件下, 用Fe3+合成的PDA会在710 nm左右出现吸收峰[7-8]。因此初步判定,Bi2S3和PDA成功复合,且Bi2S3对PDA吸收峰产生影响,使其出现蓝移的现象。
2.1.2 粒径分布和Zeta电位
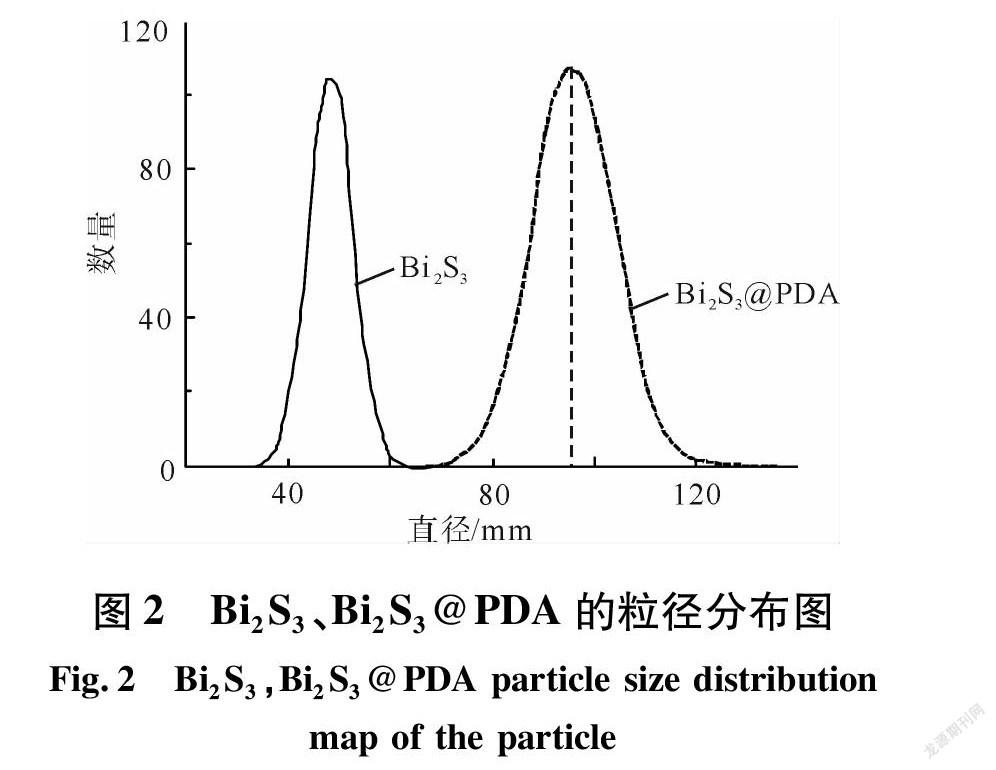
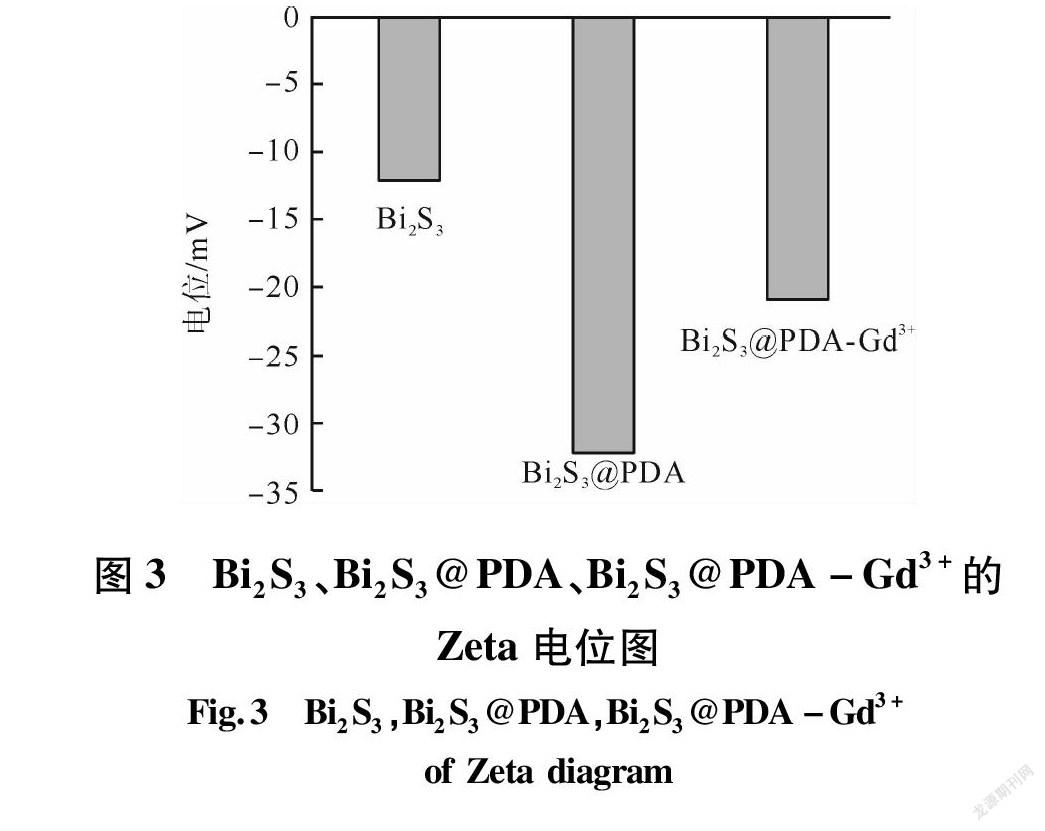
图2、图3分别为Bi2S3、Bi2S3@PDA的粒径分布图和Bi2S3、Bi2S3@PDA、Bi2S3@PDA-Gd3+的Zeta电位图。
由图2、图3可知,Bi2S3的平均粒径比Bi2S3@PDA的平均粒径低40 nm左右。Bi2S3NPs的Zeta电位为-11.65 mV;Bi2S3@PDANPs的Zeta电位为-31.89 mV、Bi2S3@PDA-Gd3+NPs的Zeta电位为-19.54 mV;Bi2S3@PDANPs的Zeta电位远高于Bi2S3NPs的Zeta电位。这是因为在 Bi2S3外包覆着一层PDA,PDA表面具有丰富的—OH,使得Bi2S3@PDANPs表现出较强负电[9]。而Bi2S3@PDA-Gd3+的Zeta电位低于Bi2S3@PDA,这是因为和Gd3+螯合的过程中,PDA表面的—OH被消耗掉一部分,因此Bi2S3@PDA-Gd3+Zeta电位相对降低。这也就说明了Bi2S3 NPs,PDA 层和 Gd3+成功复合。
2.2 Bi2S3@PDA-Gd3+应用
2.2.1 体外光生成像
不同质量浓度的Bi2S3@PDA-Gd3+光学信号强度及其关系,具体如图4所示。
由图4可知,光学信号随Bi2S3@PDA-Gd3+纳米材料质量浓度的增加逐渐增加,证实Bi2S3@PDA-Gd3+纳米材料与光学强度间表现出线性关系。同时,也说明了该复合材料的分散性较好,能够用于体内光生成像。
2.2.2 体外T1磁共振成像
不同浓度的Bi2S3@PDA-Gd3+ T1磁共振成像及其关系,结果如图5所示。
由图5可知,Bi2S3@PDA-Gd3+纳米材料在T1模式下表现出优良成像效果,且成像亮度随Bi2S3@PDA-Gd3+浓度的增加而逐渐增强;弛豫效率r1=12.04(mmol/L)·s-1。这就证实了Gd3+离子成功螯合在PDA层上,使其成为了优秀的T1造影剂。
2.3 动物试验
2.3.1 体内光声成像
图6为注射Bi2S3@PDA-Gd3+的PBS溶液后,不同时间肿瘤位置的光声成像结果。
由图6可知,在2 h时,肿瘤部位有光生信号,光声强度大概为330.369 a.u.;在8 h时,光声信号达到最高,此时强度值大概为490.424 a.u.。随注射时间的增加,肿瘤部位的光声信号虽然有所减弱,但仍旧具备良好的光声信号。当注射时间为24 h时,光声强度值为412.059 a.u;这就说明,Bi2S3@PDA-Gd3+纳米材料在体内光声成像仍旧表现良好,可用于体内光声成像[10]。
2.3.2 体内T1磁共振成像
图7为在T1模式下,注射Bi2S3@PDA-Gd3+的PBS溶液后不同时间肿瘤位置的磁共振图像。
由图7可知,T1模式下,注射Bi2S3@PDA-Gd3+的PBS溶液4 h后,体内循环使得Bi2S3@PDA-Gd3+在肿瘤位置处富集,使得该处亮度明显增加,进而帮助确定肿瘤的位置;当注射时间超过4 h,成像效果基本未发生改变。这就说明Bi2S3@PDA-Gd3+纳米材料能够通过小鼠自身循环系统在肿瘤位置富集,且成像较为明显,能够成为新一代T1模式磁共振造影剂。
综合光声成像和T1磁共振成像结果,证实Bi2S3@PDA-Gd3+纳米探针能够为肿瘤诊断及治疗都提供了更精准的技术手段。
3 结语
本文以表面自聚合方法,通过PDA的表面聚合,使其包覆Bi2S3,得到Bi2S3@PDA纳米材料。然后利用PDA表面的—OH,与具有MRI性能的Gd3+金属离子进行螯合,得到Bi2S3@PDA-Gd3+复合纳米探针。通过体内外光声试验和T1磁共振试验对其性能进行表征,得到具体结论。
(1)UV-vis和Zeta电位结果表明,Bi2S3@PDA比Bi2S3的近红外区域吸收更强,且在650 nm左右出现了明显吸收峰。Bi2S3@PDA的Zeta电位为-31.89 mV,明显高于Bi2S3-11.65 mV,证实Bi2S3 与 PDA复合成功;而Bi2S3@PDA-Gd3+的Zeta电位为-19.54 mV,明显低于Bi2S3@PDA的Zeta电位。说明螯合后,Gd3+离子消耗掉PDA表面—OH,表明Bi2S3、 PDA和Gd3+离子复合成功;
(2)体外光声试验和体外T1磁共振试验结果表明,光声信号强度和T1磁共振强度与Bi2S3@PDA-Gd3+浓度表现出线性关系。这就说明了Bi2S3@PDA-Gd3+纳米材料具有良好的分散性,可成为优秀的T1造影剂;
(3)体内光声试验和体内T1磁共振试验结果表明,小鼠尾部静脉注射Bi2S3@PDA-Gd3+8 h后,光声强度值最高为490.424 a.u.;注射时间为24 h时,Bi2S3@PDA-Gd3+仍具备良好的光声信号。在T1模式下,注射4 h,Bi2S3@PDA-Gd3+在肿瘤处富集,增加肿瘤明亮度,帮助确定肿瘤的位置;超过4 h后,成像效果改变不明显,证实Bi2S3@PDA-Gd3+纳米探针能够成为新一代T1模式磁共振造影剂。
【参考文献】
[1] 胡雪松,卫佳楠,王洪斌,等.肿瘤微环境响应型19F-MR分子成像纳米探针[J].磁共振成像,2021,12(5):121-124.
[2] 彭嘉琪,陈明,秦安军,等.聚集诱导发光探针用于线粒体靶向和癌细胞识别研究进展[J].发光学报,2021,42(3):348-360.
[3] 杨克琴.胡萝卜水热法一步合成荧光生物质碳点用于细胞成像[J].桂林师范高等专科学校学报,2021, 35(1):86-91.
[4] 高贺麒,焦迪,欧翰林,等.高性能聚集诱导发光纳米探针用于肿瘤切除手術导航[J].化学学报,2021,79(3):319-325.
[5] 张高瑞,张玉婷,赵雨萱,等.MnFe2O4@CNS纳米探针在胰腺癌诊疗一体化中的价值[J].山东大学学报(医学版),2021,59(4):48-55.
[6] 朱丽君,张琳雪,周明璋,等.有机荧光探针辅助的近红外荧光成像技术在宫颈癌中的应用[J].生物工程学报.2021(8).2 678-2 687.
[7] 闫娅楠,刘洋,刘竞,等.N,P-CDs用于Al3+和pH的检测及在细胞成像中的应用[J/OL].山西大学学报(自然科学版):1-10[2021-06-07].
[8] 李贞,刘志洪.次氯酸根激活的线粒体靶向上转换荧光纳米探针的构建[J].武汉大学学报(理学版),2021,67(1):1-10.
[9] 杨强强,张广智,吴芳芳,等.基于二氧化锰纳米片实现let-7a向癌细胞的可视化递送及其体外抗癌研究[J].聊城大学学报(自然科学版),2021,34(2):42-48.
[10] 有为,田菲,张倩,等.基于SERS纳米探针的细胞内硝基还原酶检测[J].高等学校化学学报,2020,41(12):2 742-2 748.
