轻重症及转归阶段的COVID-19患者免疫细胞的单细胞转录谱分析
2022-04-16张倩月宋怀东
王 正 张倩月 宋怀东
(上海交通大学医学院附属第九人民医院分子诊断与内分泌科 上海 200011)
新型冠状病毒肺炎(corona virus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒-2(SARS-CoV-2)感染所引起的一系列疾病,患者表现从无明显症状到全身器官衰竭,甚至死亡[1]。尽管和SARS-CoV一样,SARS-CoV-2进入靶细胞的受体为血管紧张素转换酶2(angiotensin I converting enzyme 2,ACE2)[2-3],但这两种病毒的增殖模式却有所不同。SARS-CoV-2在症状发生前,即可在呼吸道中被检测到[4-6],而且在症状发作后,病毒负荷很快达到峰值[7-9]。这些特点导致SARS-CoV-2的传染性极高,由此引发了全球的COVID-19大流行。SARS-CoV-2感染和机体的免疫反应均可以直接或间接破坏患者的呼吸道细胞[2,10],大多数患者表现为轻度至中度的症状,进展为重度肺炎的概率高达15%,并有约5%的患者最终发展为急性呼吸窘迫综合征伴有或不伴有多器官衰竭[2]。老年和免疫功能低下的COVID-19患者病死率较高[11-14]。
由于目前尚无针对SARS-CoV-2的有效药物,因此迫切需要了解疾病期间宿主的免疫反应,以便筛选预后和诊断的指标,为重症患者制定适当的治疗措施提供指导。
急性病毒感染和宿主的免疫反应在体内相互作用,是影响疾病严重程度以及患者临床预后的主要因素[10],因此COVID-19的免疫病理学受到了广泛关注。目前,针对非重症COVID-19患者的免疫反应的研究显示,急性SARS-CoV-2感染可引起强烈的细胞免疫和体液免疫反应,但是尚不清楚先天性和适应性免疫反应是如何导致肺部损伤的[15];而重症患者则表现出明显的淋巴细胞减少和血清促炎因子升高[16-17]。有报道称,在一个死亡病例的双肺中存在明显的间质淋巴细胞浸润,并在该病例外周血中发现T细胞过度活化[18]。此外,在重症COVID-19患者的支气管肺泡灌洗液中发现炎症性FCN1+巨噬细胞取代了FABP4+巨噬细胞,而在非重症SARS-CoV-2感染患者支气管肺泡灌洗液中观察到大量扩增的组织驻留性CD8+T细胞[19]。这些发现部分揭示了COVID-19发生发展的免疫病理学机制,但对于不同病情下的抗病毒或致病性免疫反应的理解仍不够充分。
在这项研究中,我们通过整合重症、轻症、恢复早期以及恢复晚期的COVID-19患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的单细胞转录组(single-cell RNA sequence,scRNAseq)数据[20-21]并进行分析,进而构建出轻重症及转归阶段的COVID-19患者外周血免疫细胞的高分辨率转录组图谱,从而研究SARS-CoV-2感染不同时期的转录变化,以便更好地了解该疾病进展和恢复过程中人体的免疫反应改变。
材料和方法
数据集从ENA(European Nucleotide Archive)数据库中获得已公开的来自COVID-19重症患者、轻症患者和健康对照PBMCs的单细胞RNA-seq数据(https://www.ebi.ac.uk/ena/browser),登录号为SRP259912[20];已公开的恢复期患者数据来自GSA(Genome Sequence Archive)数据 库(https://bigd.big.ac.cn/gsa/browse),登 录 号 为CRA 002497[21]。数据格式均为fastq。COVID-19患者SARS-CoV-2核酸检测均为阳性。其中,正在使用机械通气或体外膜氧合等呼吸支持疗法的COVID-19患者为重症患者,不需要呼吸支持疗法者为轻度患者。SARSCoV-2核酸检测转阴者为恢复期患者,早期恢复患者核酸检测转阴天数<7天,晚期恢复患者核酸检测转阴>14天。
scRNA-seq数据处理通过CellRanger v.4.0.0(https://support.10xgenomics.com/)软 件,使 用GRCh38版本的人类参考基因组,为每个样本生成初始基因表达矩阵。通过R软件v.3.6.4(http://satijalab.org/seurat/)和Seurat包v.3.1.0[22]分析初始的基因表达矩阵。首先,选择表达基因的细胞数目(min.cells)>10的基因,并选择表达基因数(min.features)>200的细胞进行进一步分析。如果细胞符合以下条件,则将其删除:(1)表达基因数>4 500个;(2)表达基因数<200个;(3)来自线粒体基因组的UMI>15%。去除低质量细胞后,使用Seurat软件包标准流程对数据进行非线性降维和聚类。
样本数据整合为了比较不同条件下的细胞类型和比例,我们采用Seurat[23]教程中所述的整合方法通过Seurat软件包(v.3.1.0)将来自不同样本的scRNA-seq数据集整合成一个数据集,从而将来自不同样本的细胞进行整合分析。
细胞的再聚类从PBMCs中提取B细胞、T细胞、NK细胞和先天免疫细胞(除外NK细胞)。分别对这几种主要的细胞类型再次进行归一化、主成分分析和聚类,以便生成更加精细的亚群。
细胞类型注释在通过UMAP进行非线性降维并将所有细胞投影到二维空间后,细胞会因为表达谱相近而在二维空间中聚集在一起。Seurat中的Find AllMarkers函数用于查找每个已识别聚类的特异表达基因。然后将特异表达基因对照特征性细胞标志物对聚类进行分类和注释。表达两个或多个特征性细胞标志物的聚类被分类为双峰细胞,并从进一步的分析中排除。
差异表达基因识别和富集分析使用Seurat中的Find Markers函数进行差异表达基因(differential expression genes,DEG)分析,并且使用Benjamini-Hochberg方法估计错误发现率(false discovery rate,FDR)。使用log2(fold change)>1和FDR<0.01过滤DEG。使用Metascape网络工具(www.metascape.org)对DEG的功能进行富集分析。富集基因集为GO Biological Process Ontology。
其他统计分析使用Kruskal-Wallis检验细胞亚群的比例在不同分组之间的差异。使用经Bonferroni法校正的Dunn’s检验进行细胞亚群比例两两配对检验。
结 果
PBMCs的单细胞转录谱为了分析COVID-19患者外周血的免疫学特征,我们对20名患者和5名健康对照(HC)的PBMCs的单细胞转录组数据进行分析。根据数据库所提供的临床表现,将20例COVID-19患者分为4类:重度(severe;n=5;使用呼吸支持治疗)、轻度(mild,n=5,未使用呼吸支持治疗)、恢复早期(ERS,n=5,核酸转阴<7天)、恢复晚期(LRS,n=5,核酸转阴>14天)。经过质控后,共计115 334个高质量细胞及6.5亿个独特的转录本纳入下游分析。在这些细胞中,10 744个细胞(9.3%)来自重度患者,19 210个细胞(16.7%)来自轻度患者,31 647个细胞(27.4%)来自恢复早期患者,27 994个细胞(24.2%)来自恢复晚期患者,25 739个细胞(22.3%)来自正常对照。将所有高质量细胞整合在一起,并校正测序深度和线粒体转录本比例后,对所有细胞的转录组数据进行主成分分析(图1A)。我们使用UMAP方法根据已知细胞标志物分离出10种主要的细胞类型和22种细胞亚型(图1A、1B)。主要的细胞类型包括CD14+单核细胞(CD14+mono,LYZ+CD14+)、CD16+单核细胞(CD16+mono,LYZ+FCGR3A+)、2型经典型树突细胞(cDC2,CD1C+)、浆细胞样树突状细胞(pDC,LILRA 4+)、自然杀伤细胞(NK,KLRF1+)、幼稚状态T细胞(naïve T,CD3E+CCR7+)、活化状态T细胞(activated T,CD3E+PRF1+)、增殖性T细胞(proliferative T,CD3E+ MKI67+)、B细 胞(MS4A 1+)、浆细胞或浆母细胞(plasma/plasmablast,MZB1+)。
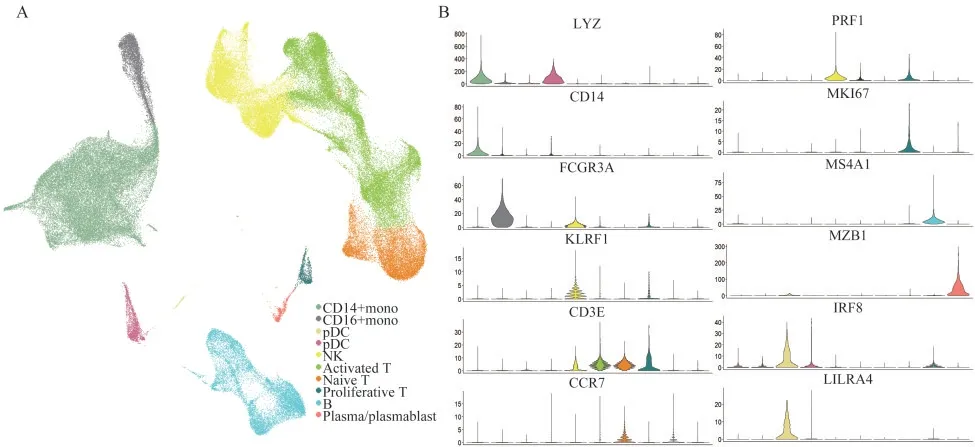
图1 健康对照和COVID-19患者的PBMCs单细胞转录谱Fig 1 Single-cell transcriptional landscape of PBMCs in HC and COVID-19 patients
轻重症及转归阶段的COVID-19患者PBMCs的组成差异为了揭示重症、轻症、恢复早期和恢复晚期的COVID-19患者PBMCs的细胞组成差异并与健康对照进行比较(图2A),我们根据scRNAseq数据计算了每个人PBMCs中10种主要细胞类型占其所有PBMCs的百分比(图2B),发现p DC、cDC2、NK细胞、增殖性T细胞、B细胞、浆细胞的外周血占比在疾病的不同阶段均有变化(图2C):其中,重症患者PBMCs中pDC的比例明显低于恢复早期患者和健康对照,而cDC2的比例明显低于恢复晚期患者,提示这两种DC可能对于疾病康复有独特的作用。与健康对照相比,重症患者PBMCs中NK细胞的比例明显降低,且随着病情的恢复,NK细胞的比例有上升的趋势。与NK细胞变化趋势相反,重症患者外周血增殖性T细胞在PBMCs中占比明显高于恢复早期和恢复晚期患者,且随着病情的恢复,增殖性T细胞的比例呈下降趋势,提示NK细胞和增殖性T细胞可以作为病情严重程度的指标衡量患者的临床状态。此外,恢复早期患者PBMCs中B细胞的比例在所有分组中最低,且显著低于轻症及重症患者。而令人意外的是,恢复早期患者的PBMCs中浆细胞的比例和重症患者相近,均明显高于健康对照,也均明显高于轻症患者。以上结果表明,DC、NK细胞、增殖性T细胞、B细胞和浆细胞在不同状态的COVID-19患者,尤其是重症患者中变化较为明显,其中参与先天免疫的DC和NK细胞显著降低,而参与适应性免疫的增殖性T细胞、B细胞和浆细胞显著增高,提示过高的获得性免疫反应可能为重症患者多器官功能破坏的潜在原因。
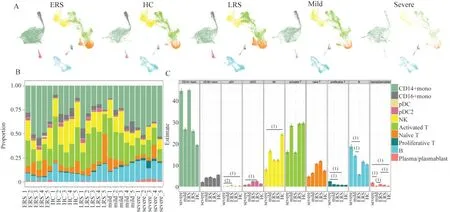
图2 轻重症及转归阶段的COVID-19患者PBMCs的细胞组成差异Fig 2 Differences in cell composition of PBMCsin COVID-19 patients with mild and severeand prognosis states
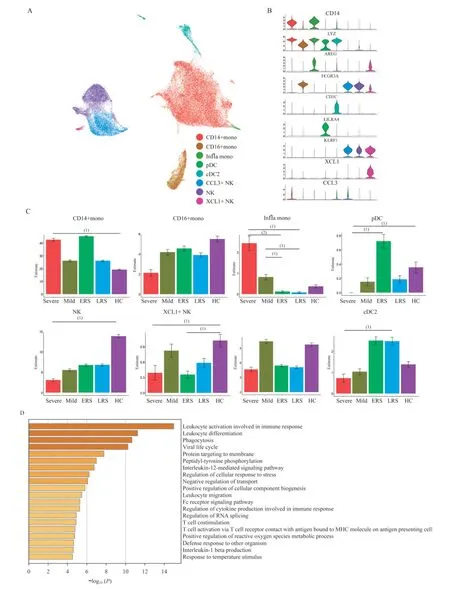
COVID-19患者先天免疫细胞亚群的特征从单核细胞、NK细胞中提取亚群,并根据细胞标志物的表达和分布定义细胞亚群类型。共得到8个更加精细的先天性免疫细胞亚群(图3A、B),分别是CD14+单核细胞(CD14+mono)、CD16+单核细胞(CD16+mono)、来源于CD14+单核细胞的炎症性单核细胞(infla mono,CD14+AREG+CCL 5+)、浆细胞样树突状细胞(p DC)、2型经典型树突细胞(cDC2)、NK细 胞、XCL 1+NK细 胞(KLRF1+XCL 1+)和CCL 3+NK细胞(KLRF1+CCL 3+)。
分析先天免疫细胞中各亚群在PBMCs中的比例(图3C),发现CD14+单核细胞、炎症性单核细胞、pDC细胞、cDC2细胞、NK细胞和XCL 1+NK细胞在轻重症及转归阶段的COVID-19患者PBMCs中的占比发生了变化。其中,与健康对照相比,CD14+单核细胞的PBMCs占比只在重症患者中有明显升高,约为健康对照的2倍;而炎症性单核细胞的比例在轻重症患者,尤其是重症患者PBMCs中,相比恢复期患者有显著升高,是恢复早期患者的20倍以上,说明炎症性单核细胞与COVID-19的严重程度密切相关,可能在介导多器官损害中发挥重要作用;在重症患者PBMCs中几乎不存在1型干扰素IFNα的主要分泌细胞p DC,明显低于健康对照和早期恢复患者,而其在早期恢复患者中比例最高,提示p DC及其分泌的IFNα可能有助于机体的抗病毒免疫反应;除了CCL 3+NK细胞比例在轻症患者中相比于健康对照无明显变化外,不同NK细胞亚群和cDC2在重症患者PBMCs中的占比相比于恢复患者和健康对照均呈下降趋势,与前面的结果一致。
为了进一步研究SARS-CoV-2感染后先天免疫细胞的转录组变化,我们将重症患者和轻症患者合并为感染期患者组,并比较了感染期患者的单核细胞、NK细胞、DC细胞与健康对照相比在表达模式上的差异(图3D~F)。我们发现,COVID-19感染期患者先天免疫细胞中上调的差异表达基因(DEG)可以富集到免疫反应调节、IL-12相关免疫反应、髓系细胞分化、白细胞活化、细胞因子产生等通路上。

图3 先天性免疫细胞亚群比例及转录组特征分析Fig 3 Proportion and transcriptome characteristicsof congenital immunecell subsets
COVID-19患者T细胞亚群的特征为了分析在不同疾病条件下,COVID-19患者T细胞亚群的变化,我们按照表达谱,对T细胞进行分群,并根据T细胞标志物的表达和分布获得了4个CD4+T细胞亚型(CD3E+CD4+),以及5个CD8+T细胞的亚型(CD3E+CD8A+)(图4A、4B)。
在4个CD4+T细胞亚型中,我们定义出CD4+初 始T(naïve T)细 胞(CD4+CCR7+SELL+)、CD4+细胞毒性T(cytotoxic T lymphocyte,CTL)细胞(CD4+GPR183-GZMA+)、CD4+中央记忆性T(central memory T cell,TCM)细 胞(CD4+GPR183+GZMA-)、调 节 性T(Treg)细 胞(FOXP3+IL 2RA+)。我们发现,CD4+CTL细胞既高表达GNLY,又高表达TBX21,表明它是1型辅助性T(TH1)细胞,并高表达细胞毒性相关基因,如NKG7、GZMA、GZMB;CD4+TCM细 胞 高 表 达GATA 3,具有2型辅助T(TH 2)细胞特征,且低表达上述细胞毒性相关基因。CD8+T细胞中包括1个CD8+初 始(CD8+naïve)T细胞 亚 群(CD8+CCR7+SELL+)、1个CD8+细 胞 毒 性T(CD8+CTL)细胞亚群(CD8+GNLY+)、2个效应记忆性T(effector memory T)细胞亚群(CD8+GZMK+TEM和CD8+GZMK-TEM),两者都具有高表达GZMA和NKG7,但CD8+GZMK+TEM特征性表达GZMK,而CD8+GZMK-TEM则高表达GZMB和TBX21。还有一个增殖性CD8+T/NK(proliferative CD8+T/NK)细胞亚群(CD8+STMN 1+),由于都高表达增殖性细胞标志物STMN1和MKI67,聚类非常接近。
在分析了不同疾病条件下各个T细胞亚群在总T细胞中的占比后,我们发现仅有GZMK+CD8+TEM细胞和增殖性CD8+T/NK细胞在疾病不同时期的占比发生了明显变化(图4C)。我们发现,在T细胞中增殖性CD8+T/NK细胞的比例在重症患者中显著高于其他组,且与恢复晚期患者和健康对照相比差异有统计学意义,提示重症患者中CD8+T/NK细胞显著增殖和激活,与在其他感染中观察到的抗病毒反应一致。而GZMK+CD8+TEM细胞的T细胞占比仅在轻症患者中明显高于恢复期患者。CD8+naïve T细胞占比在各组间的差异虽然没达到统计学意义,但恢复组占比为其他组的2~3倍。
为了进一步研究SARS-CoV-2感染后T细胞转录组的变化,我们对成熟T细胞(CTL、TEM、TCM)进行了评估。与健康对照相比,疾病期和康复期患者的成熟T细胞中上调的DEG所富集到的通路既有相似的通路,又有不同的通路。与健康对照相比,在疾病期和康复期患者的成熟T细胞具有高表达基因的功能(图4D、4E),与T细胞活化、淋巴细胞增殖、白细胞激活以及先天免疫反应调节的相关基因表达均有上调。但在疾病期患者的成熟T细胞中,与IL-12、IL-7和IFN-γ信号通路相关的基因表达上调;而在康复期患者中,与免疫系统负调控相关的基因表达有所上调。提示在疾病进展到康复期后,机体的免疫强度逐步下调。
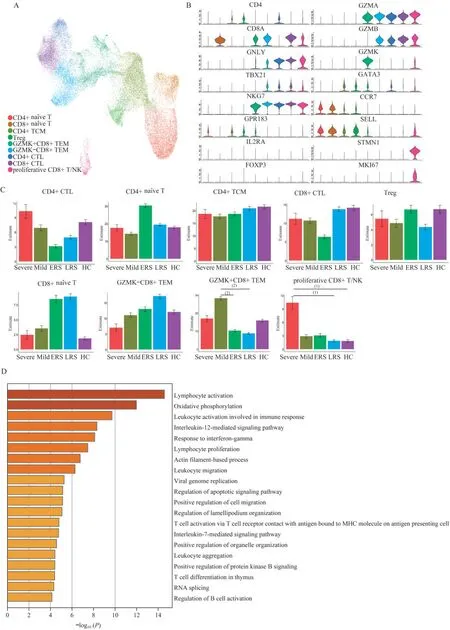

图4 T细胞各亚群占比和转录组特征分析Fig 4 Proportion and transcriptome characteristics of T cell subsets
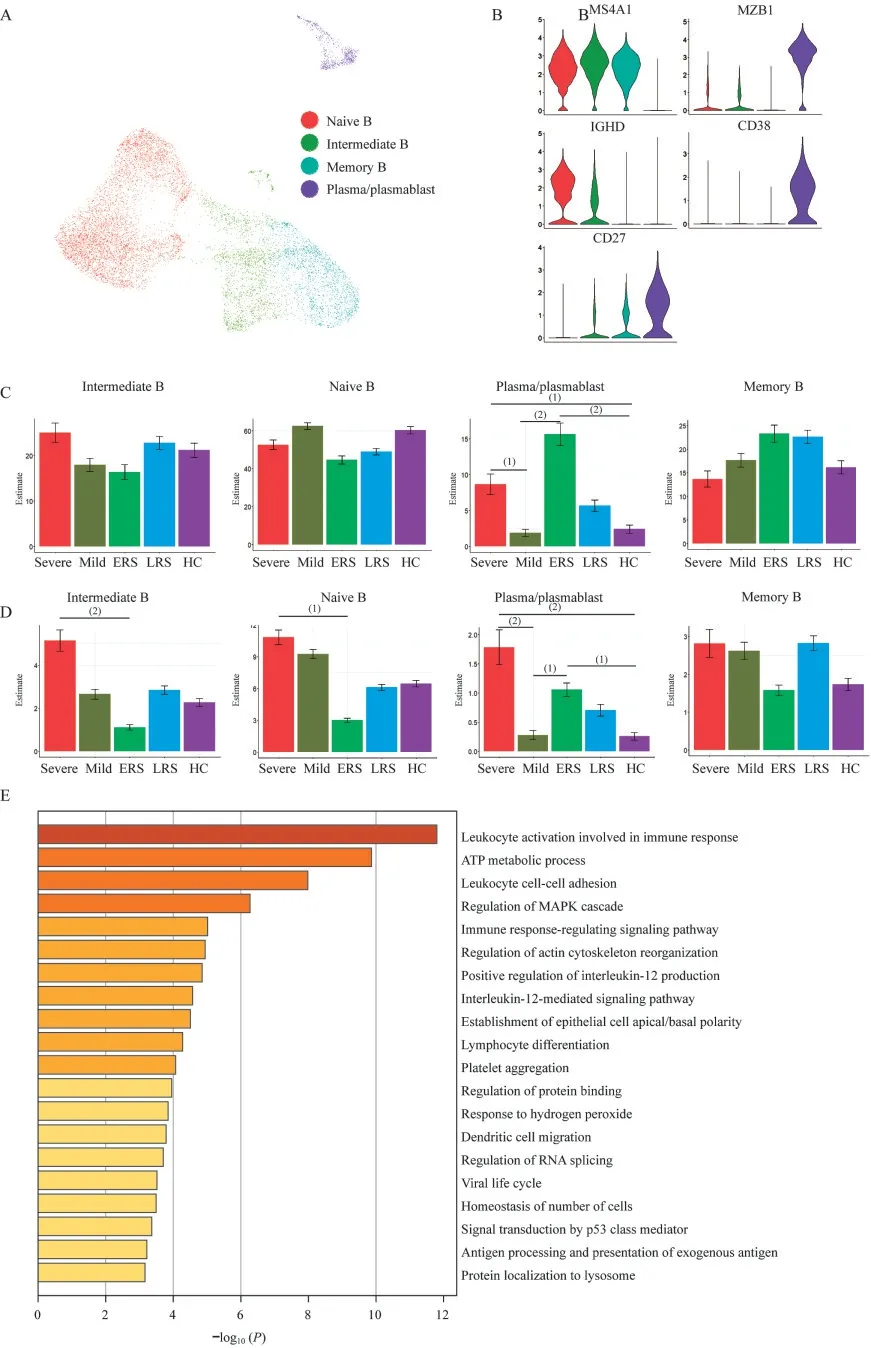
COVID-19患者B细胞亚群的特征我们根据B细胞标志物的表达和分布将B细胞分为4个亚群,包括1个初始B(naïve B)细胞亚群(MS4A 1+IGHD+CD27-)、1个记忆B细胞(memory B)亚群(MS4A 1+CD27+IGHD-)、1个 中 间 记 忆B(intermediate B)细胞亚群(IGHD+CD27+)和1个浆细胞和浆母细胞(plasma/plasmablast)亚群(MZB1+CD38+)(图5A、B)。
在分析了不同疾病状态下各个B细胞亚群的PBMCs占比(图5C)和B细胞占比后(图5D),我们发现,重症患者的naïve B细胞和中间记忆B细胞亚群的PBMCs占比明显高于恢复早期患者,但这两个亚群的B细胞占比在不同疾病状态下没有明显差异。重症患者的浆细胞和浆母细胞亚群的PBMCs占比最高,次高为早期恢复患者,均明显高于轻症患者和健康对照;在B细胞中,早期恢复患者的浆细胞和浆母细胞亚群的B细胞占比最高,次高为重症患者,均明显高于轻症患者和健康对照。提示重症患者在B细胞数目上升的同时,B细胞各亚群的比例保持稳定,推测SARS-CoV-2感染对体液免疫的影响有限,体液免疫的正常激活使得naïve B细胞源源不断分化成浆细胞和记忆B细胞等效应细胞,促进疾病向康复方向进展。
为了进一步研究SARS-CoV-2感染后B细胞中转录组发生的变化,我们分析了疾病期和康复期患者的B细胞与正常对照之间的表达谱变化(图5E、F)。我们发现,在疾病期、康复期均有和白细胞活化、白细胞黏附、免疫反应调节、外源性肽抗原的处理和呈递、蛋白质合成等生物学过程相关的基因发生了上调,表明B细胞的功能在疾病期有所增强,且直至康复期都未恢复正常水平。在疾病期,B细胞中与正向调节IL-12生成相关的基因被富集,说明疾病期的B细胞可以显著增强NK细胞和细胞毒性T细胞的功能。在康复期,B细胞中与凋亡信号相关的基因被富集,这可能是康复期患者外周血中B细胞比例降低的原因之一。

图5 B细胞各亚群占比及转录组特征分析Fig 5 The proportion and transcriptomecharacteristics of subsets of B cell
讨 论
尽管尚不清楚SARS-CoV-2感染是否会导致无症状携带者的后遗症,但COVID-19通常被认为是一种急性自限性疾病[24]。虽然宿主对急性SARS-CoV-2感染的免疫应答可以清除机体中的病毒,然而不受控制的炎症反应可能导致COVID-19患者器官和组织的损伤,从而决定了疾病的严重程度、进展和结局[2]。已有研究报道了SARS-CoV-2感染导致的先天性和适应性免疫反应的特点[12,16,25],这有助于我们了解疾病的潜在发病机制。然而,SARS-CoV-2感染后免疫反应的综合情况难以获得。为了解决这一问题,我们构建了轻重症及转归阶段的COVID-19患者单细胞免疫图谱,分析了在疾病进展过程中细胞反应的动态变化,揭示了机体抗病毒免疫反应和COVID-19发病机制的关键因素。
我们的研究为COVID-19患者的免疫学研究提供了无偏倚的补充。首先,COVID-19患者IL-12相关免疫反应、急性炎症反应和免疫细胞迁移能力均有所增强。其次,在COVID-19患者中观察到广泛的免疫激活,这可以通过增殖性T细胞、浆细胞和炎症性单核细胞的比例增加以及cDC2、pDC和NK细胞的比例降低来证明。再次,CD8+GZMK+TEM细胞亚群的比例在感染期患者中明显升高,且轻症患者的CD8+GZMK+TEM比例高于重症患者,可能说明该亚群的衰竭会加重病情进展。最后,尽管大多数患者的临床参数在恢复早期就到了正常范围,但免疫系统的状态并未完全恢复,例如NK细胞和XCL 1+NK细胞在恢复晚期仍未正常。我们发现,恢复期患者PBMCs中免疫激活相关的基因仍然上调,或可解释部分患者在出院后产生的后遗症。因此,需要进行长期随访研究,以确定COVID-19患者免疫完全恢复需要的时间。
之前发现COVID-19重症患者的支气管肺泡灌洗液中有大量巨噬细胞[19],且主要是由外周血中的炎症性单核细胞分化而来,而不是已有的肺泡巨噬细胞。这类炎症性单核细胞不仅高表达CD14、FCN1等外周单核细胞标记物,且高表达CCL5、NFKB、AREG等炎症细胞标志物,具有经典M 1巨噬细胞的基因表达特征。这与我们在外周血中的发现相符,我们在PBMCs中发现,重症患者CD14+单核细胞显著扩增,疾病期患者PBMC中炎症性单核细胞比例也明显增加,这可以很好地解释COVID-19患者肺组织中巨噬细胞增多。TLR/IL-1R信号刺激会激活炎症单核细胞和巨噬细胞[26]。最近的研究表明,抑制TLR/IL-1R信号级联反映可减轻重症COVID-19患者的高炎症状态[27]。
我们发现,在重症COVID-19患者中,外周血中NK细胞耗竭,这与已知研究相一致[28]。之前有研究发现,重症COVID-19患者的NK细胞中NKG2A表达升高,从而抑制CLT细胞的细胞毒性,而外周血中NKG2A降低、NK细胞衰竭逆转则与COVID-19的恢复成正相关[29]。NK细胞耗竭可能是重症患者多器官损伤的重要原因。在我们的研究中,还发现了一类高表达XCL1+的NK细胞在重症患者PBMCs中显著升高。cDC1表达XCR1,这是XCL 1的唯一受体[30],NK细胞通过表达XCL 1,进而招募cDC1进入相应组织。cDC1可介导有效识别病毒和细胞内抗原,有抗原递呈和产生Ⅲ型干扰素的作用,针对病毒感染发挥先天性免疫的作用[31]。因此,重症患者XCL 1+的NK细胞减少,将严重影响cDC1的抗病毒作用,从而影响COVID-19预后。
cDC2不仅是高效的抗原提呈细胞,而且还分泌IL-1、IL-8、IL-10、IL-12、IL-23和肿瘤坏死因子α(TNF-α),因此,cDC2细胞可以激活Th1、Th2、Th17和CD8+T细胞[32];而p DC细胞通过分泌大量Ⅰ型和Ⅲ型干扰素以及细胞因子,特异性应对病毒性感染。然而,我们发现cDC2细胞和pDC细胞在重症患者PBMCs中比例较低,而在恢复期有升高趋势,其中cDC2细胞在恢复晚期而pDC细胞在恢复早期,在PBMCs中的比例明显超过重症患者。推测是由于重症患者cDC2细胞和p DC细胞的分化受限,患者对SARS-CoV-2感染的先天免疫力产生缺陷,并导致这两种细胞在恢复期反跳性升高。
我们发现,在T细胞中,轻症患者GZMK+CD8+TEM细胞比例明显高于恢复期患者。此外我们发现,和GZMK-CD8+TEM相比,GZMK+CD8+TEM低表达NKG7、GZMA、GZMB、GNLY等细胞毒性相关基因,因此,轻症患者扩增的CD8+TEM亚群细胞毒性较低。这可能是轻症患者的免疫系统得以在抗病毒的同时避免免疫损伤的原因。增殖性CD8+T/NK细胞的T细胞占比在重症患者中显著上升,明显高于正常对照。在其余T细胞亚群中,我们并未发现重症患者T细胞中占比升高的细胞亚群。有报道[16]称,在重症患者PBMCs中CD4+T细胞和CD8+T细胞的绝对数目均有降低,因此可以推测,重症患者T细胞的减少是由于破坏或凋亡增加所引起,并导致T细胞增殖加快。
我们注意到,与恢复早期患者相比,重症患者PBMCs中初始B细胞和中间型B细胞的比例明显升高,据此推测重症患者的免疫系统加快了B细胞的生成和转化,从而增强机体抗病毒的能力。因此,我们也能看到重症患者PBMCs中浆细胞/浆母细胞的扩增。尽管早期恢复患者PBMCs中初始B细胞和中间型B细胞的比例较低,但其浆细胞/浆母细胞的比例却高于健康对照和轻症患者,仅次于重症患者PBMCs。我们推断,轻症患者由于病毒负荷较低,抗原递呈不足,导致体液免疫激活延迟,在恢复早期才有一定的浆细胞;而重症患者体液免疫持续激活,在恢复早期仍保持足够多的浆细胞。
本研究存在局限性:样本量相对较小,且来自不同的实验室。因此,批次效应难以控制,需要对更多COVID-19患者的数据进行研究,以便确定不同细胞类型的免疫特征与疾病结局之间的因果关系。
综上所述,本研究中综合性高分辨率的分析结果为研究COVID-19发生发展的复杂动态免疫反应提供了基础,为深入了解COVID-19患者的外周血淋巴细胞提供了资源,并为设计减轻COVID-19损伤的疗法提供了帮助。
作者贡献声明王正 论文构思、撰写和修订,数据统计和分析。张倩月 数据采集和分析,论文修订。宋怀东 论文构思和修订,数据分析指导。
利益冲突声明所有作者均声明不存在利益冲突。
