基于斑马鱼模型的茶多酚及儿茶素单体降糖作用研究
2022-04-15谭蓉刘均李强
谭蓉 ,刘均 ,李强 *
(1.中华全国供销合作总社杭州茶叶研究院,浙江杭州 310016;2 浙江省茶资源跨界应用技术重点实验室,浙江杭州 310016)
茶是一种天然绿色饮料, 自古以来被称为百病之药,饮茶不仅可以防老、养生,还能够增强神经兴奋、消食利尿。 随着科学技术的发展,医学研究已经步入了整体和系统医学时代, 向世界介绍茶叶的功效,需要开展现代科学基础研究,促进茶叶疗效具象化辨析论证。 当前研究已经证实茶叶中含有丰富的功能活性物质, 如茶多酚(Tea polyphenols,TP)、茶多糖、茶色素等,这些功能活性成分摄入后对身体健康有益。 TP 在肠道内可以抑制淀粉酶活性[1-2]。 表没食子儿茶素没食子酸酯(EGCG)进入肠道内可以抑制脂质消化吸收[3],进入体内可以促进脂肪氧化利用[4]、抑制糖异生[5],降低胰岛素拮抗[3,6];除多酚类外,咖啡碱、茶黄素等也具有健康干预效应。 咖啡碱摄入可以促进脂肪消耗、降低脂肪沉积[7],茶黄素降低HepG2 细胞中脂质沉积、促进脂肪酸氧化等[8-9]。
糖尿病是一种世界性疾病, 可以分为胰岛素分泌缺陷和胰岛素作用障碍型两种糖尿病类型,但两者的共同特点是持续高血糖可造成多种脏器衰竭,严重损害眼、肾、心血管及神经系统。 目前,在糖尿病基础研究和药物研发主要是以大小鼠为对象构建病理模型为主, 但以大小鼠为对象开展的实验研究,普遍存在试验周期长、试验费用高等特点, 较难满足当前对于高通量药物筛选及评价的实验需求。 斑马鱼(Zebrafish)生物模型因而正式进入了科研视野, 并已成为生命科学研究的新宠。斑马鱼是一种脊椎模式生物,与人类基因具有高度相似性。利用斑马鱼构建的人类疾病模型,如构建糖尿病[10-11]、高血脂[12-13]、高尿酸症[14-15]、失眠[16-17]等,不仅具有试验周期短、成本低等显著优势,而且可以有效开展靶向药物筛选以及药物安全与毒理评价研究。 此外,通过斑马鱼在体实验研究,还可以有效弥补体外细胞试验和大小鼠哺乳类动物实验之间的生物学断层, 完善现有药物研发及评价体系。在糖尿病斑马鱼模型研究方面,采用的建模方式与糖尿病大小鼠的建模方式相近, 方法如下:腹腔注射四氧嘧啶或链脲佐菌素[18-19]溶液;四氧嘧啶与葡萄糖溶液联用诱导[20];采用过度饲喂法建立胰岛素抵抗型糖尿病[21],但这些模型主要是以斑马鱼成鱼为对象构建, 以斑马鱼幼鱼为对象开展的糖尿病模型建设较为鲜见。 研究团队经过前期研究,以斑马鱼幼鱼为对象,采用葡萄糖与四氧嘧啶联用成功构建了胰岛素依赖型糖尿病(Insulin-dependent diabetes mellitus, IDDM)斑马鱼模型[22],为糖尿病病理研究和药物筛选提供了多方案参考。
当前细胞和大小鼠实验表明茶可能具有降糖效应[23-24],研究以茶叶提取物及其主要功能成分为主,如TP 和EGCG 等。TP 是茶叶中多酚类物质的总称,包括黄烷醇类、花色苷、黄酮类、黄酮醇类和酚酸类等,以黄烷醇(儿茶素)类为主,其主要单体包括 EGCG、表没食子儿茶素(EGC)、表儿茶素(EC)、表儿茶素没食子酸酯(ECG)。文章采用研究团队自建的IDDM 斑马鱼模型为基础[22],重点关注并开展了TP 及其四种主要儿茶素单体的降糖效应评估与比较研究,为科学茶饮、茶叶健康知识普及, 以及为茶及代用茶健康功效评价提供新的策略与视野。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器及试剂
(1)主要仪器:水浴锅(上海精宏实验设备有限公司);酶标仪(Multiskan SkyHigh,赛默飞世尔科技(中国)有限公司);手持式高速匀浆机(MY-20,上海净信实业发展有限公司);全自动智能型生化(霉菌)培养箱(天津市宏诺仪器有限公司);精密电子天平(AL-204,梅特勒-托利多国际贸易(上海)有限公司);离心机(3K1S,德国 sigma 离心机公司)。
(2)试验试剂:TP 及儿茶素单体(浙江省茶资源跨界应用技术重点实验室自制),葡萄糖(国药集团化学试剂有限公司), 四氧嘧啶 (CAS 号:2244-11-3,纯度≥98.0%,合肥博美生物科技有限责任公司),阿卡波糖(Acarbose,ACA,拜耳医药保健有限公司),三卡因甲磺酸(CAS 号:886-86-2,上海阿拉丁生化科技股份有限公司);磷酸缓冲盐溶液(pH 7.02,南京建成生物工程研究所)。 葡萄糖检测试剂盒(葡萄糖氧化酶法,南京建成生物工程研究所)。
(3) 储备液制备:5 mg/mL TP 及儿茶素单体储备液(以生药量计)制备:称取0.5 g TP 及儿茶素单体分别用蒸馏水溶解定容至100 mL,于4 ℃冷藏备用。 按照GB/T 8313—2018 规定的检测方法检测,TP 纯度为 83.70%, 含 33.45% EGCG、7.73% ECG、3.55% EGC、2.80% EC 和 0.88%咖啡碱;EGCG 纯度为 77.89%;EC 纯度为 86.29%;EGC 纯度为 77.75%;ECG 纯度为 84.32%。
220 mg/mL 葡萄糖储备液制备: 称取44 g 葡萄糖于烧杯中, 用蒸馏水溶解定容至200 mL,冷藏备用。 1 mmol/L 四氧嘧啶储备液制备: 称量0.0144 g 四氧嘧啶于烧杯中, 加入蒸馏水搅拌溶解并定容于100 mL,冷藏备用。50 mg/mL ACA(以生药量计)储备液制备:称取5 g ACA 于烧杯中,加入蒸馏水搅拌溶解过滤后定容至100 mL,于4 ℃冷藏备用。
1.1.2 实验动物
斑马鱼(3 月龄,AB 型,上海费曦生物科技有限公司)。 斑马鱼胚胎的繁殖以自然交配方式进行。 每个产卵盒中按 1∶1 放入公鱼和母鱼, 放入28.5 ℃恒温培养箱中。光周期设置为:14 h 光照与10 h 黑暗,于第二天上午收集胚胎,去除死卵和粪便, 清洗后换孵育水 (60 μg/mL 海盐水), 置于28.5 ℃恒温培养箱中恒温孵育, 隔24 h 换液一次,并去掉卵膜和死卵。 处理结束时,采用三卡因甲磺酸对斑马鱼进行麻醉处死。
1.2 实验方法
1.2.1 儿茶素降糖效应评估
基于前期研究[22], 将 5 dpf (5 days post fertilization) 野生型 AB 系斑马鱼给予22 mg/mL葡萄糖+0.02 mmol/L 四氧嘧啶联合孵育24 h 以诱导糖尿病模型[22],然后将已建立的糖尿病斑马鱼随机分组,每组3 个重复,每个重复20 条,分别给予 22 mg/mL 葡萄 糖与 0、15、30 和 45 μg/mL TP 或 EGCG 或 EGC 或 EC 或 ECG 或 ACA 联合孵育 48 h,分别记为 MC、T-15/30/45 TP 或 EGCG或 EGC 或 EC 或 ECG 或 ACA。 正常生理斑马鱼用 0 和 22 mg/mL 葡萄糖孵育 72 h (隔 24 h 换液一次),设置为NC1 和NC2 对照组。治疗结束后取样用于测定葡萄糖含量。
1.2.2 TP 及儿茶素降糖效应比较研究
将5 dpf 野生型AB 系斑马鱼在22 mg/mL 葡萄糖+0.02 mmol/L 四氧嘧啶联合孵育条件下孵育24 h 以诱导糖尿病模型[22],然后将已建立的糖尿病斑马鱼随机分为8 组,每组3 个重复,每个重复30 条,分别给予 22 mg/mL 葡萄糖、22 mg/mL 葡萄糖+30 μg/mL TP 或 EGCG 或 EGC 或 EC 或 ECG或 ACA 联合孵育 48 h,分别记为 MC、T-30 TP 或EGCG 或 EGC 或 EC 或 ECG 或 ACA。正常生理斑马鱼用 0 和 22 mg/mL 葡萄糖孵育 72 h (隔 24 h换液一次),设置为NC1 和NC2 对照组。治疗24 h和48 h 后分别取样用于测定葡萄糖含量。
1.3 检测方法
试验结束时,每个重复取10 条鱼用于测定葡萄糖含量, 葡萄糖含量检测按如下步骤进行:取100 μL 磷酸缓冲盐溶液于装鱼的1.5 mL 离心管中,采用高速手持式匀浆机匀浆1 min,直至鱼体组织裂解充分, 然后于4 ℃下以2500 转/秒离心10 min, 结束后取上清样2.5 μL 采用葡萄糖检测试剂盒(葡萄糖氧化酶法)测定葡萄糖浓度,其测定程序和方法按照试剂盒说明书规定的步骤进行。
1.4 统计分析
所有试验数据经Excel 2016 初步处理后,用Graphpad Prism 6.0 绘图,并用 SPSS Statistics 17.0进行单因素方差分析(One-way ANOVA),所有数据均以平均值±标准差呈现, 差异显著性采用Duncan 分析并将进行多重比较,p<0.05 表示组间差异显著。
2 结果与分析
2.1 基于IDDM 斑马鱼的 TP 和 EGCG 降糖作用评估
基于IDDM 斑马鱼的TP 和EGCG 降糖效应结果见图1。 相比NC1 组,NC2 组斑马鱼葡萄糖值水平增加了 1.98 倍(p<0.05),MC 组增加了 2.28 倍(p<0.05)。 相比 MC 组,T-15 TP、T-30 TP 和 T-45 TP 组斑马鱼葡萄糖值水平分别减少了58.22%、50.08%和 54.20%, 差异均显著 (p<0.05);T-15 EGCG、T-30 EGCG 和 T-45 EGCG 组斑马鱼葡萄糖值水平分别减少了55.47%、33.20%和26.71%,差异均显著 (p<0.05);T-15 ACA、T-30 ACA 和 T-45 ACA 组斑马鱼葡萄糖值水平分别减少了60.56%、72.59%和 70.55%,差异均显著(p<0.05)
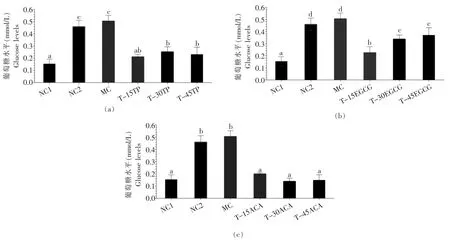
图1 基于 IDDM 斑马鱼的 TP(a)、EGCG(b)和 ACA(c)降糖作用评估Fig. 1 Effects of TP (a), EGCG (b) and ACA (c) on the hypoglycemic effects in zebrafish with IDDM
2.2 基于 IDDM 斑马鱼的 EGC、EC 和 ECG 降糖作用评估
基于 IDDM 斑马鱼的 EGC、EC 和 ECG 降糖效应结果见图2。相比NC1 组,NC2 组斑马鱼葡萄糖值水平增加了 3.85倍 (p<0.05),MC 组增加了4.38 倍 (p<0.05)。 相比 MC 组,T-15 ECG、T-30 ECG 和T-45 ECG 组斑马鱼葡萄糖值水平分别减少了 38.94%、46.41%和48.13%,差异均显著(p<0.05);T-30 EC 和 T-45 EC 组斑马鱼葡萄糖值水平分别减少了25.06%、28.13%和29.01%,差异均显 著 (p <0.05);T-15 EGC、T-30 EGC 和 T-45 EGC 组斑马鱼葡萄糖值水平分别减少了42.89%、33.85%和 31.58%,差异均显著(p<0.05)。
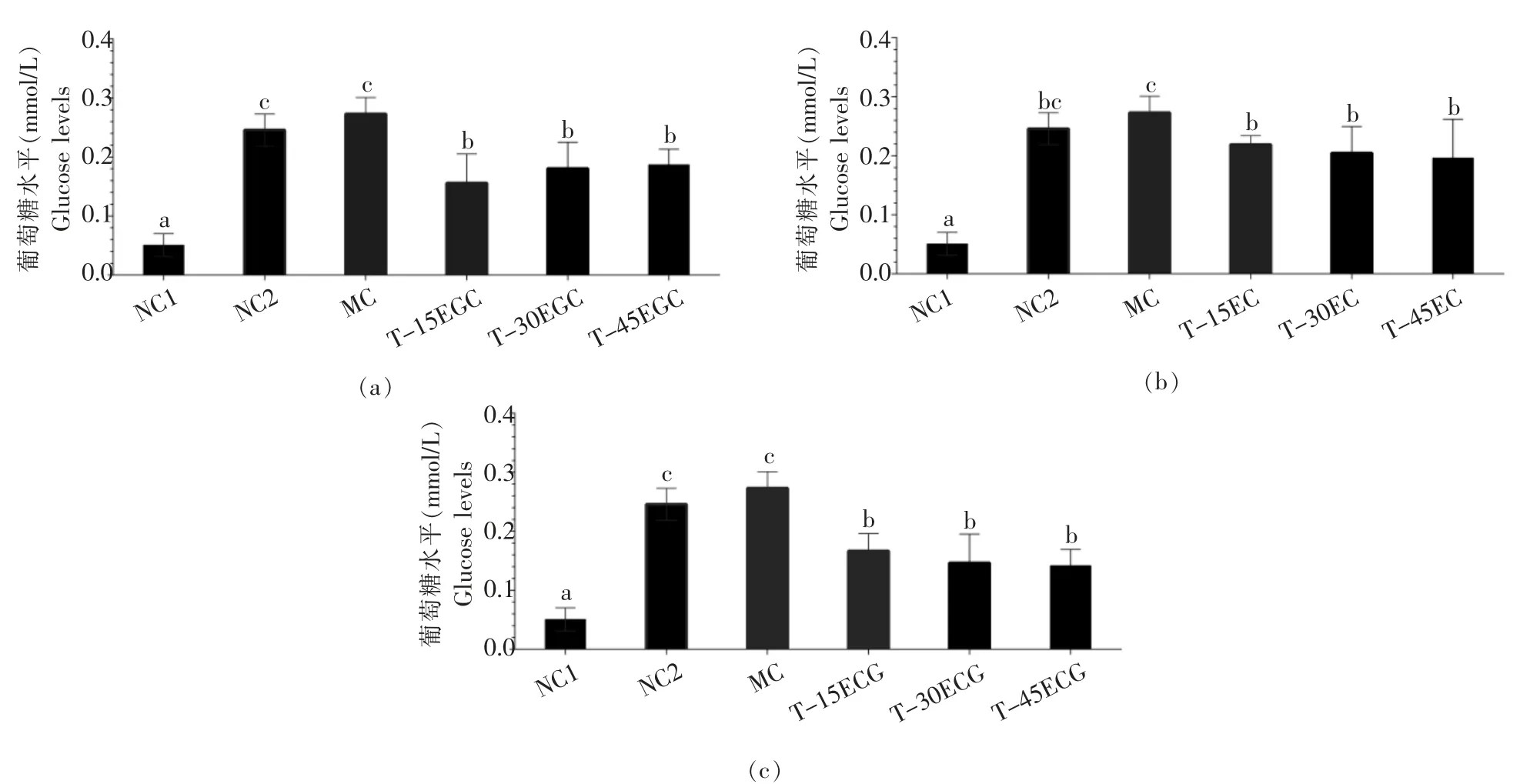
图2 基于 IDDM 斑马鱼的 EGC(a)、EC(b)和 ECG(c)降糖作用评估Fig. 2 Effects of EGC (a), EC (b) and ECG (c) on the hypoglycemic effects in zebrafish with IDDM
2.3 基于IDDM 斑马鱼的儿茶素降糖作用比较
基于IDDM 斑马鱼的儿茶素降糖效应比较研究结果见图 3。 治疗 24 h 后,相比 NC1 组,NC2 组斑马鱼葡萄糖值水平增加了1.73 倍 (p<0.05),MC组增加了 1.91 倍(p<0.05)。 相比 MC 组,T-30 TP、T-30 EGCG、T-30 EGC、T-30 EC、T-30 ECG 和 T-30 ACA 组斑马鱼葡萄糖值水平均不同程度降低,其中以T-30 ACA 组降低幅度最大, 达到55.54%(p<0.05), 然后依次是 EC (28.88%,p<0.05)、EGC(22.45% ,p <0.05)、ECG (17.87% ,p >0.05)、TP(10.57%,p>0.05)、EGCG(6.57%,p>0.05)。

图3 基于IDDM 斑马鱼的儿茶素降糖作用比较Fig. 3 Comparison of hypoglycemic effects of catechins in zebrafish with IDDM
治疗 48 h 后, 相比 NC1 组,NC2 组斑马鱼葡萄糖值水平增加了 2.21 倍 (p<0.05),MC 组增加了 2.40 倍 (p<0.05)。 相比 MC 组,T-30 TP、T-30 EGCG、T-30 EGC、T-30 EC、T-30 ECG 和 T-30 ACA 组斑马鱼葡萄糖值水平均显著降低 (p<0.05), 其中以 ACA 组降低幅度最大, 达到了63.53% , 然 后 依 次 是 ECG (50.55% )、EGCG(45.51%)、EC(41.92%)、TP(39.86%),降低幅度最低是 EGC(37.19%)。
3 讨论
我国有着悠久的茶文化, 茶已经与我们的生活深度融合,茶的健康功效记载可远溯至《神农本草经》。 随着当代科学的发展,茶叶的健康功效逐步被科学实验证实。 经动物[25-27]和人群[28-31]试验表明, 茶叶提取物或儿茶素类物质可以在肠道内与脂质、脂肪酶形成复合体抑制脂质吸收,通过抑制淀粉酶活性减少葡萄糖吸收, 通过改善胰岛素敏感性增强葡萄糖生物利用等改善高血糖症。
研究发现,在15~45 μg/mL(以生药量计)浓度范围内,EGCG 和EGC 的降糖效应并不存在明显的剂量浓度依赖效应, 均表现为随着剂量浓度的增加降糖效应略有下降, 这可能与药物致死效应有关,斑马鱼幼鱼体质弱,虽然基于前期研究药物剂量设置在安全剂量浓度范围内, 但随着EGCG 和EGC 药物剂量浓度逐渐靠近临界值,可能对斑马鱼机体健康状态或代谢状态有临界点效应影响, 故采用斑马鱼幼鱼开展功能评价前需要开展药物耐受性分析研究, 而后指导开展功能评价。 同时研究发现,EC 和ECG 均表现为随着剂量浓度的增加降糖效应在增强, 推测斑马鱼对EC和ECG 的药物耐受性强于EGCG 和EGC,具体的结论还需后续继续研究。 另外从孵育液中儿茶素作用浓度(以生药量计)与降糖效应(%)的相关关系上看,包括糖尿病治疗药物ACA 在内的6 个治疗组治疗48 h 后,ACA 的降糖效应最强, 在茶多酚及儿茶素单体中降糖表现由强到弱的依次是ECG>EGCG>EC>TP>EGC。
斑马鱼属于新兴模式生物,采用斑马鱼幼鱼开展功能评价有其自身的特殊性,因此为科学开展功能评价需在开展药物耐受性的基础上筛选宜用的剂量效应浓度。 TP 和EGCG 是比较知名的茶叶功能活性成分, 其降糖作用研究已有诸多报道[25,28]。研究中的斑马鱼除可以直接从水中摄取葡萄糖作为能源物质外, 还可以直接消耗体内的卵黄囊维持自身生存生长需要。 蛋白质和脂肪作为卵黄囊内源营养的主要营养成分, 其代谢对斑马鱼十分重要。研究表明TP 和儿茶素进入肠道内对肠道内的营养成分消化吸收有重要调节作用, 对斑马鱼的降糖作用可能与对这些营养成分的消化调节作用有关。TP 可以抑制胰脂肪酶活性[32]、降低胆固醇重吸收[33],促进粪便脂质排泄[34]等减少脂源性能量吸收。EGCG 可以抑制胰脂肪酶和淀粉酶活性[35-36],下调钠依赖的葡萄糖共转运蛋白1 的表达减少葡萄糖吸收[37]等改善糖脂代谢平衡。 尤其是EGCG,研究发现EGCG 在动物肠道内可以特异性吸附胆汁酸盐,抑制胆酸盐重吸收。以考来烯胺与胆汁酸盐的结合率作为100%,EGCG 对6 种胆汁酸盐的吸附结合率平均高达60%以上[38],其中牛磺胆酸钠(78.99%)、甘氨胆酸铵(90.14%)、牛黄石胆酸(82.00%)、牛磺脱氧胆酸(93.48%)。 多酚类物质属于大分子物质难以直接越过肠壁, 其主要阻滞在肠腔中, 但是在肠道微生物的作用下可以被降解为小分子酚类物质, 这些物质同样具有较强的抗氧化活性和清除自由基作用[39-41]。当茶叶和儿茶素进入机体后对体内糖脂代谢存在重要调控作用。 TP 及EGCG 和ECG 可以促进胰岛细胞分泌胰岛素,促进葡萄糖利用[42-44]。 EGCG 可以通过保护胰岛细胞[45],促进骨骼肌葡萄糖转运体4 的表达减轻胰岛素信号封锁提高葡萄糖利用[26,44]。 另外,茶叶提取物对斑马鱼脂质代谢有着显著影响,可以显著上调肝脏ACOX1、酰基辅酶A 脱氢酶和PPARA 基因的表达,以及显著下调脂肪细胞因子信号抑制因子3b 基因的表达[46]。
研究发现,除TP 和EGCG 外,其它儿茶素如EGC、EC 和 ECG 也具有明显的降糖效应。 ECG对脂代谢有重要调节作用已有报道,LU 等[47]以HepG2 细胞为对象研究茶叶中多酚物质对脂代谢的影响, 结果发现儿茶素对胆固醇合成代谢有明显的抑制作用,且抑制性强弱顺序依次是:没食子儿茶素没食子酸酯(GCG)>EGCG>ECG>没食子酸(GC)>EGC>杨梅黄素>檞皮素>儿茶酸 (C)>EC,抑制率范围为7%~35%, 综合来看其抑制作用强弱可能与儿茶素没食子酰基上B 环(B ring)或者结构中含有的没食子酸基(galloyl moieties)有关,且酯型强于非酯型。 但是,目前包括ECG 在内的除EGCG 外的儿茶素单体对糖脂代谢的影响研究还比较鲜见。 从研究结果看,ECG 对糖代谢的调控能力可能与EGCG 相近,值得进一步研究关注。
研究重点研究了儿茶素的降糖作用, 但未能拓展研究除多酚类之外的功能活性成分对糖代谢的影响,譬如当前有研究指出咖啡碱[2,7]、茶黄素[8-9]等也具有明显的降糖作用, 因此下一步还将充分利用斑马鱼生物模型的高通量技术优势, 深入研究儿茶素药物耐受性、 毒理影响机制及其对糖代谢调节作用机制, 以及深入研究并挖掘茶叶中可能存在的除儿茶素之外的降糖功能活性成分并开展靶点效应研究, 尤其是需要开展功效成分间协同或拮抗作用研究,为科学饮茶提供基础信息。
4 结论
经 IDDM 斑马鱼试验评价,15~45 μg/mL TP、EGCG、EGC、EC 和 ECG(以生药量计)均能够降低糖尿病斑马鱼葡萄糖值水平, 但其降糖效应弱于糖尿病治疗药物ACA。相同生药量下(30 μg/mL),降糖作用表现依次是 ECG>EGCG>EC>TP>EGC,酯型儿茶素降糖效应稍强于非酯型,因而TP 及其主要儿茶素单体具有明显的降糖效应, 且降糖效应与其浓度和作用时间有关。 通过斑马鱼在体实验研究, 表明茶多酚及主要儿茶素均具有明显的降糖效应。 除EGCG 外,ECG 的降糖效应值得后续深入探讨和研究。
