全豌豆固体制曲的工艺优化
2022-04-13杨文君相欢段杉崔春
杨文君,相欢,段杉,崔春
(1.华南农业大学 食品学院,广州 510642;2.华南理工大学 食品科学与工程学院,广州 510640)
豌豆(PisumsativumL.)是全球范围内主要种植和消费的豆类之一,是碳水化合物(如纤维素、抗性淀粉和低聚糖)、蛋白质、维生素和矿物质的良好来源。豌豆种子含有21%~22%的蛋白质,是一种比较理想的植物蛋白,特别是赖氨酸的含量高达1.5%[1-2],另外还含有丰富的谷氨酸、天冬氨酸、精氨酸、甘氨酸等呈味氨基酸,因此是制备呈味基料的良好来源。
固体制曲是生产中国传统发酵制品如酱油、豆豉等的关键工序,其目的在于使曲霉充分繁殖,产生丰富的酶系(如蛋白酶、淀粉酶、纤维素酶等),这些酶类对发酵制品的风味和品质有重要作用[3]。米曲霉是我国传统酿造业使用的菌种,被美国FDA认可为GRAS级别,已被广泛运用到多种传统调味品、新型呈味基料及酶制剂的开发中。制曲的目的是使米曲霉在原料上充分生长,分泌发酵所需各种酶类,在后续的发酵中将原料中的蛋白质、淀粉等分解成多肽、游离氨基酸、糖类等小分子物质[4]。
蛋白酶活和淀粉酶活是评价成曲质量的重要指标,在米曲霉分泌的复合酶系的作用下,大分子的蛋白质以及淀粉等物质被降解成小分子多肽和葡萄糖等小分子物质,对呈味起到关键性作用。本实验以豌豆和面粉比、豌豆蒸料时间、接种量以及制曲时间等指标,研究了米曲霉对固体全豌豆制曲的影响[5],以期为豌豆蛋白的开发利用提供理论基础。
1 材料与方法
1.1 原料与试剂
豌豆:市售;曲精:沪酿3.042米曲霉孢子粉,佛山市海天调味食品股份有限公司;面粉:山东鲁王集团有限公司;氢氧化钠、盐酸、碳酸钠、三氯乙酸等常用化学试剂:均为分析纯,天津市大茂化学试剂厂;酪蛋白、可溶性淀粉:北京奥博星生物科技有限公司;乙腈:色谱纯,科密欧化学试剂有限公司;三氟乙酸:色谱纯,上海阿拉丁公司。
1.2 仪器与设备
Climace 11404人工气候箱 广州市科启生物科技有限公司;SW-CJ-1FDA型超净工作台 苏州安净净化技术有限公司;LDZX-40B型立式自控电热蒸汽灭菌器 上海申安医疗器械厂;THZ-C台式恒温振荡器 太仓市华美生化仪器厂;Scientz-18N冷冻干燥机 宁波新芝生物科技有限公司;雷磁PHS-3E pH计 上海仪电科学仪器股份有限公司;GL-21M型高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.3 米曲霉全豌豆固体制曲工艺优化
1.3.1 成曲的制备流程
全豌豆固体→浸泡→蒸料→冷却→混合面粉→接种→制曲→翻曲→出曲→测定酶活。
1.3.2 豌豆面粉比对成曲酶活力的影响
称取固体全豌豆各100 g,分别置于烧杯中室温下浸泡3 h,倒干水后连同纱布放入灭菌锅中121 ℃蒸料15 min,然后分别按照100∶1、100∶5、100∶10、100∶15、100∶20的豌豆和面粉比加入面粉并混匀,同时接种1.0‰(以干豌豆质量计)的米曲霉,在温度30 ℃、湿度90%的条件下培养48 h,于制曲的24 h后进行第一次翻曲、36 h后第二次翻曲,出曲后分别测定中性蛋白酶活和淀粉酶活。
1.3.3 豌豆浸泡时间对成曲酶活力的影响
称取固体全豌豆各100 g,分别置于烧杯中室温下浸泡1,2,3,4 h,倒干水后连同纱布放入灭菌锅中121 ℃蒸料15 min,然后按照100∶10的豌豆和面粉比加入面粉并混匀,同时接种1.0‰(以干豌豆质量计)的米曲霉,在温度30 ℃、湿度90%的条件下培养48 h,于制曲的24 h后进行第一次翻曲、36 h后第二次翻曲,出曲后分别测定中性蛋白酶活和淀粉酶活。
1.3.4 蒸料时间对成曲酶活力的影响
称取固体全豌豆各100 g,分别置于烧杯中室温下浸泡4 h,倒干水后连同纱布放入灭菌锅中121 ℃分别蒸料5,10,15,20,25 min,然后按照100∶10的豌豆和面粉比加入面粉并混匀,同时接种1.0‰(以干豌豆质量计)的米曲霉,在温度30 ℃、湿度90%的条件下培养48 h,于制曲的24 h后进行第一次翻曲、36 h后第二次翻曲,出曲后分别测定中性蛋白酶活和淀粉酶活。
1.3.5 米曲霉接种量对成曲酶活力的影响
称取固体全豌豆各100 g,分别置于烧杯中室温下浸泡4 h,倒干水后连同纱布放入灭菌锅中121 ℃蒸料15 min,然后按照100∶10的豌豆和面粉比加入面粉并混匀,同时分别接种0.4‰、0.6‰、0.8‰、1.0‰(以干豌豆质量计)的米曲霉,在温度30 ℃、湿度90%的条件下培养48 h,于制曲的24 h后进行第一次翻曲、36 h后第二次翻曲,出曲后分别测定中性蛋白酶活和淀粉酶活。
1.3.6 制曲时间对成曲酶活力的影响
称取固体全豌豆各100 g,分别置于烧杯中室温下浸泡4 h,倒干水后连同纱布放入灭菌锅中121 ℃蒸料15 min,然后按照100∶10的豌豆和面粉比加入面粉并混匀,同时接种0.8‰(以干豌豆质量计)的米曲霉,在温度30 ℃、湿度90%的条件下分别培养36,40,44,48,52,56 h,于制曲的24 h后进行第一次翻曲、36 h后第二次翻曲,出曲后分别测定中性蛋白酶活和淀粉酶活。
1.4 成曲发酵液呈味规律探究
将全豌豆成曲磨碎,称取15 g加水置于锥形瓶中(料液比1∶5),于pH 5.5、45 ℃条件下发酵24 h,发酵液离心取上清液备用。测定发酵上清液中的蛋白质、氨基酸态氮、总糖、总酸含量以及肽分子量分布,并对发酵产物进行感官评定,探究豌豆成曲发酵过程中呈味物质的释放规律。
1.5 分析与测定方法
1.5.1 中性蛋白酶活、淀粉酶活的测定
参照QB/T 1803-1993。
1.5.2 水解度和蛋白质回收率的计算[6]


1.5.3 还原糖、总酸的测定
还原糖的测定采用DNS法,总酸的测定参照GB/T 12456-1990中的NaOH滴定法。
1.5.4 成曲发酵产物感官评定
参照GB/T 19547-2004[7]和相欢等[8]的方法并稍加调整,采用SPME-DSE联用法分析不同固形物浓度发酵对酱油香气物质的影响,感官评价小组包括5男5女,年龄在16~25岁,感官评价室的温度为(24±1)℃。感官评定员在感官评定之前都经过基本滋味培训,熟悉豌豆成曲发酵产物的风味特征和感官强度,滋味培训的标准品分别为1%蔗糖(甜味)、0.35%食用盐(咸味)、0.2%味精(鲜味)、0.02 g/L盐酸奎宁(苦味)、0.04%柠檬酸(酸味)。取10 mL样品溶液置于烧杯中,评定员将样品溶液全部倒入口中,并保持10 s左右,随后将其吐出。使用评分法,0~9分制(0~1表示无感觉,2~3表示阈值感觉,4~5感觉微弱,6~7感觉中等,8~9感觉强烈),用雷达图表示定量描述分析结果[9]。
1.5.5 发酵产物肽分子量分布的测定
参照陈嘉辉[10]的方法稍作调整:将豌豆成曲发酵液冻干样品加水稀释至蛋白浓度为10 mg/mL,采用HPLC法过凝胶柱(TSK gel G2000 SWXL)测定发酵液中的肽分子量分布,流动相比例为乙腈∶水∶TFA为25∶75∶0.1,流速为0.5 mL/min,检测波长为220 nm。以保留时间x为横坐标,相对分子质量的对数y为纵坐标,绘制相对分子质量校正曲线并得到方程:y=-0.288x+8.1408,R2=0.985。
1.5.6 数据处理
本研究所有实验结果均重复进行3次,使用OriginPro 2019、SPSS 14.0软件对数据进行图表绘制和ANOVA-单因素方差分析。
2 结果与分析
2.1 全豌豆固体制曲工艺优化
2.1.1 豌豆和面粉比对成曲酶活力的影响
面粉中的主要成分为淀粉,且来源广泛,价格低廉,其合适的C/N以及曲料疏松度能为米曲霉生长代谢提供良好的碳源[11]。同时蛋白质以麸胶蛋白和麦谷蛋白为主,谷氨酸含量高,是产生鲜味的重要来源[12]。碳源和氮源作为米曲霉分泌酶系的主要限制性底物,其添加量和比例对成曲的酶活力有着极其重要的影响[13]。
由图1可知,随着面粉添加量的增加,中性蛋白酶活力和淀粉酶活力均呈现先上升后下降的趋势,在面粉添加量为10%时,中性蛋白酶活达到最大值1363.2 U/g,面粉添加量为15%时淀粉酶活力达到最大值128.7 U/g,两种情况下米曲霉生长情况较好,成曲表面孢子浓密,均匀丛生,呈黄绿色,且曲香浓郁。这说明适当的面粉添加量有利于米曲霉的生长利用,过量的面粉添加量可能使豌豆外部包裹一层过于严密的面粉层进而导致空气流动不畅通,从而抑制米曲霉的生理活动而降低酶活[14]。考虑到中性蛋白酶是影响发酵产物呈味的最主要因素以及成本问题,最后选择10%作为最佳面粉添加量。

图1 豌豆和面粉比对成曲酶活力的影响Fig.1 Effect of the ratio of peas to flour on enzyme activity of finished koji
2.1.2 蒸料时间对成曲酶活力的影响
由图2可知,随着蒸料时间的不断延长,豌豆成曲的中性蛋白酶活力和淀粉酶活力呈现出先上升后下降的趋势,在蒸料时间为15 min时达到最大值,分别为1189.5 U/g和85.2 U/g。在蒸料的过程中,适当的高温热处理使得大分子蛋白质伸展,同时又能够杀灭豌豆曲料中其他微生物,更有利于米曲霉的生长繁殖,提高成曲的质量,若蒸料时间过长,导致蛋白质分子过度变性,分子结构松散紊乱,降低发酵利用度和蛋白质的溶解度,微生物利用率低[15]。因此,最终选择15 min为最佳蒸料时间。

图2 蒸料时间对成曲酶活力的影响Fig.2 Effect of steaming time on enzyme activity of finished koji
2.1.3 米曲霉接种量对成曲酶活力的影响
由图3可知,接种量对中性蛋白酶活力的影响有显著性差异(P<0.05)。随着接种量的不断增加,中性蛋白酶活力先上升后下降,在0.8‰时达到最大值1213 U/g;淀粉酶活力呈现先增长后趋于平缓的趋势,最大值为86.8 U/g,不同接种量之间无显著性差异。当接种量过小时,米曲霉生长总量不足,蛋白酶活力和淀粉酶活力相对较低;当接种量过大时,菌体初始数量增大,造成了菌体间利用营养物质竞争过大,从而影响孢子的成熟,最终影响酶活力[16],这与刘超等[17]研究接种量对成曲酶活的影响趋势一致。因此综合考虑,选择0.8‰作为最佳接种量。

图3 接种量对成曲酶活力的影响Fig.3 Effect of inoculation amount on enzyme activity of finished koji
2.1.4 制曲时间对成曲酶活力的影响
米曲霉的生长可分为4个阶段:孢子发芽期、菌丝生长期、菌丝繁殖期、孢子着生期,酶系的分泌主要在菌丝繁殖期[18],见图4。

图4 制曲时间对成曲酶活力的影响Fig.4 Effect of koji making time on enzyme activity of finished koji
由图4可知,在24~36 h时,米曲霉生长处于菌丝生长期,曲料呈白色,中性蛋白酶及淀粉酶活力均较低。在36~48 h时,菌丝迅速繁殖,分泌大量酶系,中性蛋白酶活力在48 h时达到最大值1221.6 U/g,淀粉酶活力在44 h时达到最大值85.2 U/g,此阶段曲料变成淡黄色,直至最后呈黄绿色。44 h以后米曲霉孢子进入生长后期,处于过生长阶段,中性蛋白酶活力显著降低(P<0.05),因此选取44 h为最佳制曲时间。
2.2 豌豆成曲发酵液呈味规律探究
2.2.1 豌豆成曲发酵液制备
称取15 g粉碎后的豌豆成曲加一定量的水(料液比为1∶5)于锥形瓶中,调节pH至6.0,在45 ℃的条件下置于空气摇床中发酵24 h,每隔3 h取一次样备用。
2.2.2 豌豆成曲在发酵过程中水解度、蛋白回收率的变化趋势
水解度和蛋白回收率是衡量蛋白质发酵效率的重要指标,由图5可知,随着发酵时间的不断延长,水解度和蛋白回收率均呈现出先增大后趋于平缓的趋势,在24 h时分别达到33.5%和47.8%,这说明米曲霉分泌的蛋白酶能够较好地发酵豌豆中的蛋白质,将蛋白质、糖类等大分子物质分解成一系列易于吸收的小分子物质。
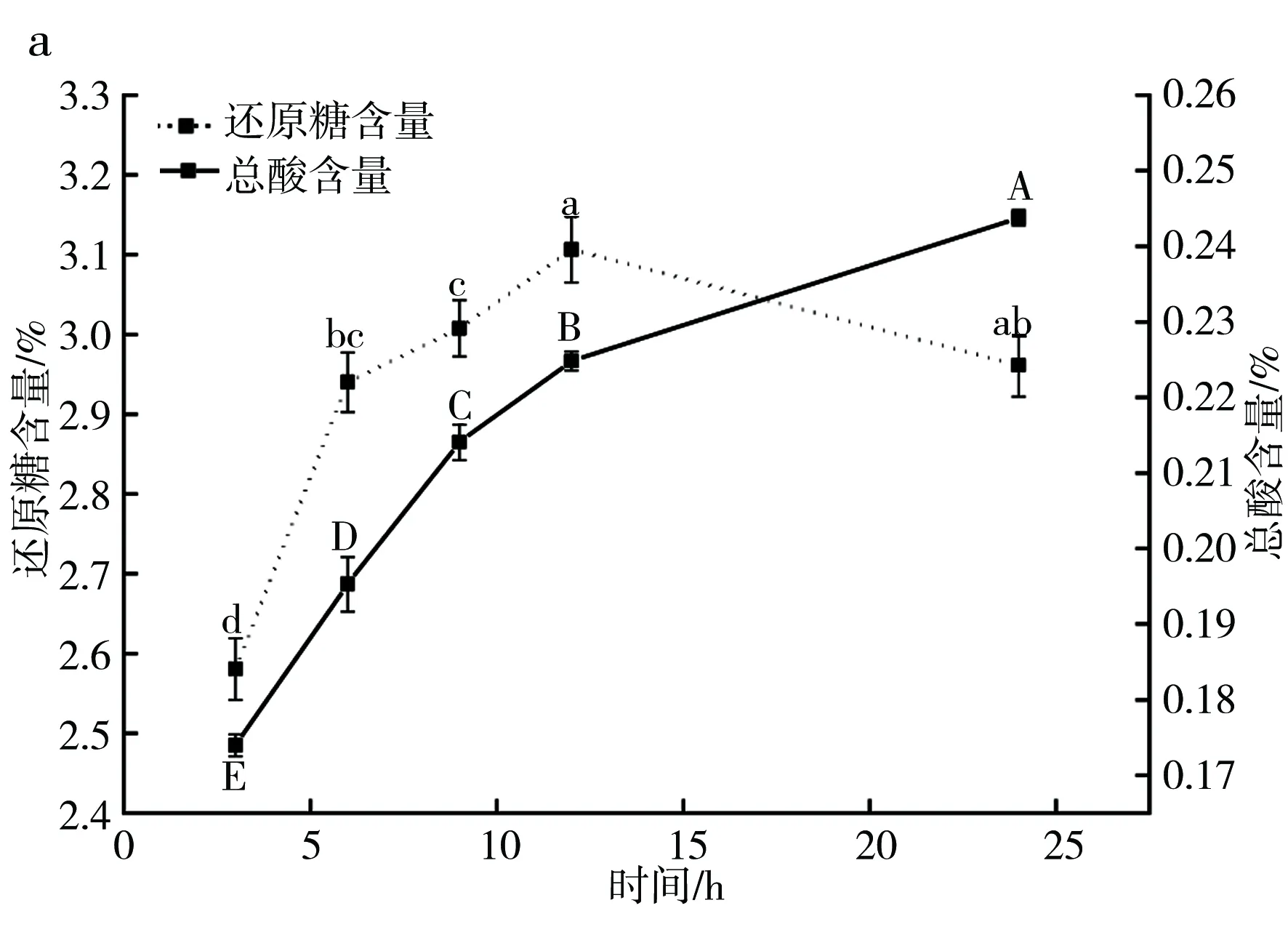
2.2.3 豌豆成曲在发酵过程中还原糖、总酸的变化趋势
由图5可知,随着发酵时间的不断延长,还原糖的含量呈现先上升后下降的趋势,在发酵12 h时达到最大值3.1 g/dL,前期快速增长的原因是曲料中的糖类物质在淀粉酶的作用下降解为葡萄糖等还原糖,后期由于还原糖的生成速率与利用速率相接近使还原糖含量逐渐保持稳定[19]。总酸含量在1~12 h内快速增长,在12~24 h增长逐渐缓慢,这可能是因为前期发酵液中产酸率微生物生长繁殖产生酸性物质进而导致总酸含量升高,到酶解后期,酒精和乳酸等中间产物的积累又会对产酸微生物有一定的抑制作用,故到后期总酸含量逐渐趋于平稳[20]。
2.2.4 豌豆成曲发酵产物肽分子量分布
采用凝胶色谱法测定发酵产物的肽分子量分布,结果见表1。

表1 豌豆成曲发酵产物肽分子量分布Table 1 The molecular weight distribution of peptides from the fermented products of pea finished koji
由表1可知,在豌豆成曲发酵3~24 h的过程中,产物的相对分子质量主要集中在5000 Da以下,并且随着发酵时间的延长,大分子量的肽段(>1000 Da)逐渐减少,小分子量肽段(<500 Da)逐渐增加,在发酵24 h后的组分中100~500 Da肽段达到了75.09%,有研究证明此肽段分子量在食品的呈味和增味中发挥着极其重要的作用[21]。这说明在米曲霉分泌的复合酶系的作用下,豌豆成曲中的大分子蛋白质得到了深度的分解,产生了丰富的呈味肽以及游离氨基酸。
3 结论
通过测定中性蛋白酶活、淀粉酶活等指标来探究不同因素对全豌豆固体制曲的影响,最终确定了豌豆和面粉比100∶10、豌豆蒸料时间15 min、接种量0.8‰、制曲时间44 h、制曲温度30 ℃、湿度90%的最佳制曲工艺。在此条件下,中性蛋白酶活和淀粉酶活分别高达1221.6 U/g和85.2 U/g。
在最佳制曲工艺下对成曲进行发酵实验,在料液比1∶5、pH 6、45 ℃的条件下发酵24 h,得到的发酵液的水解度和蛋白回收率分别为33.5%和47.8%。呈味感官评价显示发酵液具有显著的咸味和鲜味,且随着还原糖和总酸含量的显著升高,甜味和酸味的协调感明显上升,发酵液的风味逐渐走向饱满,是制备呈味基料的良好来源,也为豌豆的高值化利用提供了理论基础。
