希氏-浦肯野系统起搏动物实验研究的现况与展望
2022-04-13胡奕然金汉华伟
胡奕然 金汉 华伟
(1.中国医学科学院 北京协和医学院 国家心血管病中心 心血管疾病国家重点实验室 阜外医院心律失常中心,北京100037; 2.首都医科大学附属北京天坛医院心脏及大血管病中心,北京 100071; 3.北京大学第一医院心内科,北京100034)
希氏-浦肯野(希浦)系统起搏能夺获心脏固有的传导系统,保证正常的心室肌电激动顺序,是目前公认最为生理性的起搏方式[1]。最新指南明确了希浦起搏主要包括希氏束起搏(His-bundle pacing,HBP)和左束支起搏(left bundle branch pacing,LBBP)这两种起搏方式,相比于传统右心室起搏方式,能获得更优的心室电学和机械同步性[2]。近年来公布的临床研究结果发现,希浦起搏能改善有起搏适应证患者的临床预后[3-4]。
尽管作为新技术,希浦系统起搏仍处在起步阶段,相关基础和临床研究的证据仍需不断夯实[2]。动物实验研究是生命科学研究和发展重要的基础和支撑条件,对深入认识希浦系统起搏,明确起搏治疗背后的相关分子和细胞学机制尤为关键。因此,现就希浦系统解剖学及电传导特点,以及希浦起搏动物实验研究的现状做一综述。
1 希浦系统解剖及电传导特点
解剖上看,希氏束分为穿行段和分支段,长为15~20 mm,起自房室结远端,穿过中央纤维体后走行在三尖瓣环室间隔膜部下方,在室间隔肌部上缘分为左、右束支成分[5]。日本学者通过对105例老年人的心脏传导系统进行解剖,发现希氏束的走行大致分为3型:Ⅰ型(46.7%),最常见,希氏束走行于室间隔膜部下缘,由薄层心肌组织覆盖,易与周围心肌组织区分;Ⅱ型(32.3%),希氏束与室间隔膜部分离,由较厚的心肌组织覆盖,难与周围心肌组织区分;Ⅲ型(21.0%),希氏束裸露,走行于心内膜下[6]。左束支作为希氏束向下在左心室面发出的重要传导束,大多数情况下以带状结构出现于主动脉无冠状窦和右冠状窦之间的膜部间隔下方,其主干短粗,随后分为左前分支及左后分支,走行于室间隔左侧心内膜下,呈扇形分布在左心室心内膜面形成复杂的浦肯野纤维网[7]。人和哺乳动物在希浦系统解剖和走行方面大致相似(见表1[5-8]和图1)。从心脏电传导角度而言,正常房室结下传的电激动直接激动希氏束成分,沿左右束支成分快速下传,最终到达心内膜下广泛分布的浦肯野纤维网,保证了左右心室电激动的同步性,因此,希浦系统起搏是理论上最为生理性的起搏方式[1,9]。

表1 对比人和哺乳动物的希浦系统解剖及走行特点
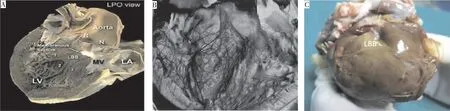
注:图A为1例人尸检心脏标本显示的左束支及分支[5],图B为1例犬心脏的左束支及分支病理染色标本[9],图C为作者团队实验室提供的1例利用卢戈氏碘液染色法显示猪心脏的左束支及分支。Aorta为主动脉,R为右冠状窦,N为无冠状窦,LA为左心房,MV为二尖瓣,LBB为左束支,Membranous septum为膜部室间隔,LV为左心室。
2 起搏和电学参数研究
自1967年Scherlag等[10]报道了如何记录犬希氏束电位的方法学,HBP一直备受关注。由于当时理论和实践认识上的局限性,加上植入工具有限,早期动物实验仅限于利用标测导管记录希氏束电位,并进行临时起搏以观察HBP的急性期电学参数等情况[11-12]。
随着技术的快速发展和成熟,Amitani等[13]首次开展了希氏束区域植入主动起搏导线并完成短期随访观察的动物实验。研究人员选取了6只成年比格犬,利用11 F递送鞘管塑成J型弯形状,经右颈内静脉途径送入希氏束区域,然后借助5 F双极标测导管寻找到希氏束电位,将主动螺旋导线(型号4068,美国美敦力公司)成功旋入该指定部位完成犬的HBP。术中测得急性期平均起搏阈值为(1.15±0.69)V/0.5 ms,R波感知为(7.28±2.04)mV。随访实验犬2个月发现,R波感知保持稳定,为(5.63±1.62)mV,但起搏阈值升高至(2.83±1.06)V/0.5 ms。随后将实验犬安乐死后进行组织病理学分析,显示导线头端仅有轻微的炎性细胞浸润,包括希氏束在内的传导系统均未观察到明显的病理学变化。因此,该动物实验证实了利用主动螺旋导线实施永久性HBP的可行性,并发现了HBP阈值慢性期升高的特点。
针对希氏束区域影像学不明确以及HBP植入困难等问题,Yin等[14]率先尝试应用当时先进的心腔内超声心动图(intracardiac echocardiography,ICE)技术指导犬实施HBP。研究人员选取了6只成年犬,经左颈内静脉途径送入11 F递送鞘管作为血管通路,借助ICE(型号:Acuson Sequoia C256)提供的超声影像学信息,将起搏导线送入三尖瓣环隔叶区域实施HBP,并完成房室结消融。实验结果显示,1只犬完成直接HBP,另外5只犬完成希氏束旁起搏。急性期平均起搏阈值为(3.0±1.0)V/0.5 ms,平均希氏束导线植入时间为(40±28)min。同时,研究人员利用ICE直接观察急性期的血流动力学情况,显示HBP对比右心耳起搏在左心室急性期血流动力学方面并无显著差异。该动物实验为临床开展ICE指导HBP提供了操作技术参考及相关可行性依据。
由于LBBP植入较HBP更为简单,且起搏参数更为理想,是目前更为关注的生理性起搏新技术[15]。为了直接对比LBBP和HBP的电学参数特点,Chen等[16]首次开展了LBBP植入的动物实验。对于3只成年犬,先通过标测希氏束电位的方法植入HBP导线,然后借助HBP导线作为影像学标识,利用现有成熟的Select SecureTM系列鞘管(美国美敦力公司)完成LBBP导线植入。术中测试参数证实,LBBP的起搏阈值[(0.67±0.15)V/0.4 ms vs (2.30±0.66)V/0.4 ms,P=0.014]和R波感知[(11.33±3.06)mV vs(2.67±0.42)mV,P=0.008]均显著优于HBP。另外,LBBP植入犬的左心室达峰时间显著短于HBP植入犬[(39.67±1.53)ms vs (52.33±3.51)ms,P=0.005]。其次,解剖实验犬左右心室肌用5%卢戈氏碘液染色法显示出左束支及其分支结构后,可明确观察到左束支导线头端靠近左束支区域,从解剖病理学角度进一步明确起搏夺获左束支的证据。
3 心电生理及电激动传导特点研究
希氏束解剖上主要分为穿行段和分支段,那么起搏不同希氏束部位在心电方面是否有差异,Mattson等[17]开展了动物实验旨在回答上述问题。研究人员选取了5只实验犬,通过外科手段实施一种“可视化心脏方法”分离出心脏组织并维持正常的心电活动。之后,将4根美敦力3830导线分别植入4个不同的希氏束区域:(1)区域1为冠状静脉窦近端;(2)区域2为前间隔连接处与冠状静脉窦之间的中间部位;(3)区域3为前间隔连接处的近端;(4)区域4为三尖瓣环靠近前间隔的心室侧。这4个区域囊括了希氏束的近端、穿行段和远端部分(图2)。动物实验结果显示,区域1无法夺获希氏束。区域2~4的希氏束夺获阈值并无显著性差异。希氏束近端到远端所记录到的希氏束-心室间期逐渐缩短,且起搏近端能获得更优的起搏QRS波群形态及相对更窄的起搏QRS波群时限。区域2的选择性HBP比例最高(80%),而该比例在区域3和4分别为25%和50%。最后,对这4个区域进行组织病理学染色发现,区域1靠近房室结,该处绝大部分由纤维束成分构成,故起搏该处无法夺获传导系统。而区域2靠近房室结远端和希氏束近端,故起搏该处能直接夺获希氏束,且选择性HBP比例最高。区域3靠近希氏束远端,而区域4邻近右束支起始段。综上,本动物实验揭示了起搏犬不同希氏束区域与起搏QRS波群形态之间的关系,并提示起搏近端希氏束可能获得更优的电激动顺序。
除了观察起搏QRS波群形态及时限等传统指标评价希浦系统起搏的同步性特点,通过三维电解剖标测技术能获得更为准确的电激动顺序和传导时间。最近,Hirahara等[18]通过Langendorff技术分离了7只犬的心脏组织,在高位右心房、希氏束、右心室心尖和左心室游离壁心外膜分别植入起搏导线,利用64极网篮电极和128极袜套电极进行犬心内外膜高密度标测以对比窦性心律、HBP、右心室心尖起搏和双心室起搏的电激动顺序和传导时间。实验结果显示,无论是选择性还是非选择性HBP,在总的激动时间、激动顺序以及起搏QRS波群时限方面均明显优于传统右心室起搏和双心室起搏,且与窦性心律相比并无显著差异。此外,非选择性HBP尽管较选择性HBP有着更宽的起搏QRS波群时限,但心室整体激动顺序和时间对比,二者并无显著性差异。因此,该动物实验从电生理角度进一步证实了HBP能获得正常的心室电激动传导顺序,且优于传统双心室起搏。此外,Qian等[19]运用高密度电解剖标测方法评估了LBBP的生理性特点。研究者对于4只实验猪植入型号为3830的起搏导线完成LBBP,并利用波士顿科学公司的64极标测导管分别在窦性心律和LBBP状态下完成左心室心内膜高密度电激动标测。随后,他们将起搏导线改植入右心室间隔部位,并再次完成标测。结果显示,LBBP在左心室整体激动时间方面与窦性心律相比并无显著性差异[(109.5±9.9)ms vs (100.3±10.1)ms,P=0.070],但显著优于传统右心室间隔部位起搏方式[(109.5±9.9)ms vs (133.0±21.2)ms,P=0.048]。该研究提示,LBBP这项新兴的生理性起搏技术同样能保证左心室正常的电激动和传导性。
4 左心室收缩顺应性研究
通过超声学技术评价起搏对心肌的影响是常用的实验方法。Zhou等[20]通过起搏实验犬心脏的不同部位并观察相应左心室收缩顺应性特点来明确最优的生理性起搏位点。研究人员选取12只成年犬,通过右股动脉和静脉途径送入可控弯电极分别至右心房、希氏束、右心室流出道、右心室心尖处、左心室高位间隔和左心室心尖处,在上述部位至少起搏5 min,每个部位间隔10 min。同时,利用超声二维斑点追踪技术收集上述部位起搏后的左心室旋转、左心室扭转、旋转最高峰时间、扭转最高峰时间和扭转同步性指数等反映左心室收缩顺应性的指标并进行对比。动物实验结果显示,相较于起搏前和起搏右心房,起搏希氏束、右心室流出道、右心室心尖处、左心室高位间隔和左心室心尖处均会显著降低心尖和心底处的旋转和扭转能力,心尖处旋转最高峰时间、扭转最高峰时间和扭转同步性指数值均显著延长。然而,起搏希氏束较心室其他部位能获得相对更优的心底及心尖处心肌旋转和扭转的参数值,并观察到更高的左心室收缩末期压力。因此,该动物实验同样证实了HBP的生理性,起搏希氏束部位较其他心室部位能获得更好的左心室机械顺应性。

注:图A为导线植入区域1~3位于犬的右心房内,区域4位于三类瓣瓣下,图B~E为通过Masson染色法在低倍镜下(1×)观察起搏导线植入上述四个部位(箭头)的组织病理学特点;图F~I为通过Mas-son染色法在高倍镜下(40×)观察相应B~E图组织切片的黄色框区域。RA为右心房,RBB为右束支,HB为希氏束,AVN为房室结,Ao为主动脉,CS为冠状窦,IVC为下腔静脉,LA为左心房,LBB为左束支,LV为左心室,RAA为右心耳,RV为右心室,TV为三尖瓣。
5 小结与展望
生理性起搏是公认的最理想的起搏方式,希浦系统起搏的问世激起了心脏起搏领域研究的热潮[1,8]。就目前而言,所报道的绝大多数为临床研究,而涉及希浦系统起搏的动物实验和基础研究较为匮乏。尽管国内外学者在希浦系统起搏动物实验方面已开展了关于起搏电学参数、电激动和传导特点以及左心室收缩顺应性等研究工作,这种新兴的起搏方式对于心室肌细胞跨膜离子流变化、离子通道及缝隙连接蛋白表达、心肌能量代谢和细胞凋亡等方面的影响尚未明确(图3)。因此,掌握希浦系统的解剖特点,全面了解希浦系统起搏的基础研究现状,并依此合理开展希浦系统起搏动物实验,有望深入认识生理性起搏治疗背后的确切分子细胞学机制,为临床进一步优化希浦系统起搏植入策略、发掘新的植入位点以及明确最优生理性起搏适应证患者提供科学的理论依据。
