自噬与心房颤动关系的研究进展
2022-04-13陈稳叶强
陈稳 叶强
(西南医科大学附属医院心血管内科,四川 泸州 646000)
根据2020年中国心血管健康与疾病报告,心血管疾病死亡占中国城乡居民总死亡原因的首位,心房颤动(房颤)相关并发症如心力衰竭和脑卒中占据不小的比例。数据显示,在中国,年龄≥35岁居民的房颤患病率为0.7%,年龄≥75岁居民患病率为2.4%[1]。房颤的患病人数逐年增加,房颤导致患者生活质量下降、心功能损害以及脑卒中风险增加,是目前危害人类健康和增加社会经济负担的重要疾病。
目前,对于房颤的治疗有药物治疗和消融治疗等多种方式,但易复发,成为治疗的难点。大量研究证明房颤的发生机制是多因素共同参与,心房重构是房颤触发和维持的基石。心肌细胞自噬参与维持正常的心脏代谢与功能,越来越多的研究发现自噬参与心房电重构、结构重构、能量代谢重构和神经重构过程,在房颤的触发与维持中起双重调节作用。目前为止,房颤与自噬之间的关系还未得到充分阐述,现归纳近年来自噬调节心房重构的相关研究,从电重构、结构重构和能量代谢重构等方面阐述自噬与房颤发生和发展之间的关系。
1 自噬与心肌组织
自噬溶酶体降解途径在细胞生理学中起着至关重要的作用,通过清除细胞内衰老、损伤和多余的物质来维持细胞质的稳定和代谢平衡。自噬小体形成是细胞自噬的核心,自噬小体的形成由自噬相关蛋白执行。如图1所示,细胞内物质的自噬溶酶体降解包括起始、延伸、闭合、成熟和降解过程。然而,机体是如何控制和调节自噬囊泡形成仍是一个谜。自噬参与生长发育、脂质代谢、炎症反应、肿瘤发生和神经退变等多种生理病理过程[2]。根据自噬底物运送到溶酶体内的途径不同,自噬被分为三种类型,即巨自噬、微自噬和分子伴侣介导的自噬。其中巨自噬(以下简称“自噬”)在心脏疾病中被广泛研究。此外,还有一些特殊的靶向特定底物的自噬,如线粒体自噬、脂噬、内质网自噬和核糖体自噬等。
在过去的十年里,自噬的分子机制、调控机制以及对病理生理影响等领域的研究取得了重大进展。大量研究认为自噬相关基因的突变与多种心血管疾病有关[3]。自噬是一把双刃剑,即使在同一种细胞,自噬激活或抑制都可能导致细胞损伤。心肌细胞通过自噬清除异常蛋白质和受损细胞器来维持正常的心脏功能,过度自噬激活和完全抑制都会损伤心脏,适度的自噬激活能提高细胞应对不良应激的存活率,过度刺激导致自噬激活亦可导致细胞凋亡,即Ⅱ型程序性死亡[4]。研究表明自噬受损导致的蛋白质平衡脱轨与衰老和心脏疾病的发生有关。然而,过度激活的自噬也会导致心肌细胞结构蛋白的降解和细胞自噬性死亡[5]。
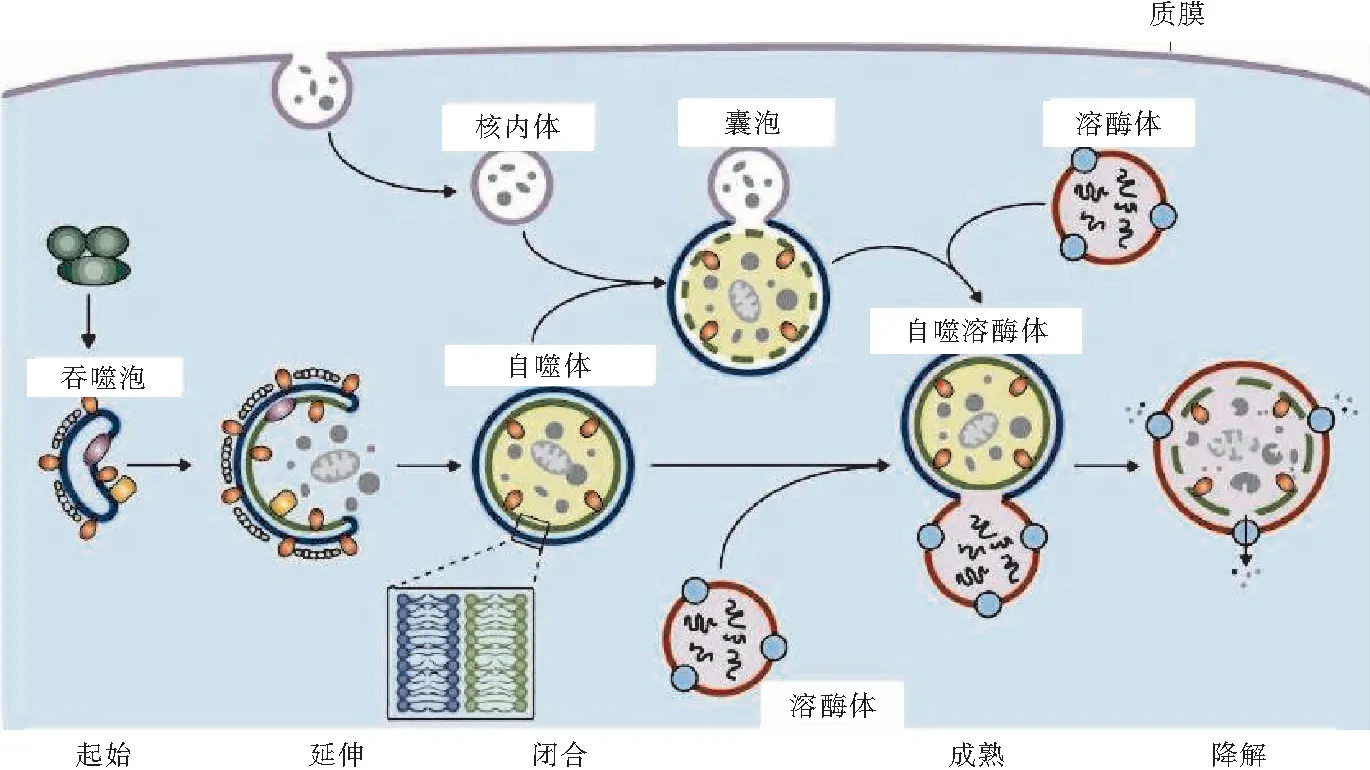
图1 自噬溶酶体降解途径示意图
2 自噬在房颤中的作用
多种心脏疾病可引起心房重构,最终导致房颤。心房重构为房颤的发生和发展提供了基础,尤以电重构和结构重构为主。心房重构导致房颤复律后早期复发、长期持续性房颤的药物抵抗,以及阵发性房颤到持续性房颤的时间缩短[6]。自噬溶酶体途径作为细胞重要的自稳机制,通过多种方式调节心肌细胞电重构、机械重构及细胞内物质代谢。多种导致心脏重构的心血管疾病如高血压、心力衰竭和糖尿病心肌病等的发生和发展过程中都有异常自噬激活。Yue等[7]以高频电流刺激犬心房组织建立房颤动物模型,在犬心房肌细胞中检测到自噬异常激活,房颤患者心房肌细胞中也得到了同样的结果,表明自噬水平的失衡可能是房颤的潜在致病因素。研究发现胺碘酮等多种抗心律失常药可能靶向自噬相关蛋白,影响心肌细胞自噬。此外,冠状动脉旁路移植术后房颤患者中发现自噬受损,快速心房起搏犬模型(易发生房颤)微管相关蛋白1轻链3B-Ⅱ水平升高,表明自噬通路参与房颤的发生[8]。
2.1 过度自噬激活促进心房电重构
2.1.1 离子通道重构
异常激活的自噬降解心肌细胞正常的结构和蛋白,使心肌细胞正常功能受损。传导功能是心脏电生理活动的基础,依赖于正常离子通道和细胞间缝隙连接。心房电重构是房颤的重要基础,使动作电位时程和心房有效不应期缩短。L型钙通道介导Ca2+内流,在心肌细胞动作电位平台期中起重要作用。已有研究发现自噬可选择性降解细胞跨膜蛋白。房颤患者心肌细胞自噬标志物及自噬相关基因显著激活,而高频电刺激快速起搏心房同样可激活心肌细胞自噬,并通过泛素蛋白促进L型钙通道蛋白的自噬降解,缩短动作电位时程和心房有效不应期,使房颤更易发生和维持[9]。
2.1.2 间隙重构
心肌细胞间存在独特的缝隙连接结构,使电信号能迅速传至整个心房。缝隙连接蛋白(connexin,Cx)40和Cx43是缝隙连接的重要组成蛋白。Cx43下调或分布紊乱可能导致心肌细胞间不同的阻抗和传导速度,导致微折返形成,增加房颤的易感性[10]。Chen等[11]发现心房肌细胞自噬激活抑制Cx43的表达,Cx43重构是心房重构中最重要的过程之一,可能与自噬有密切关联,但其机制尚不清楚。
2.2 自噬在心肌纤维化中的双向作用
2.2.1 自噬激活促进心肌纤维化
心肌纤维化造成心肌束间电传导的不均一性,当心房异位电信号遇到这种易损基质时,可能诱发折返环形成,导致房颤的发生。心脏成纤维细胞向肌成纤维细胞转化,同时合成大量胶原蛋白和纤连蛋白,导致心房结构重构,使房颤向永久性形式进展。肾素-血管紧张素-醛固酮系统过度激活是心脏重构的重要机制,血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)是其主要效应分子。AngⅡ促进小鼠肌成纤维细胞分泌胶原蛋白且与自噬激活相平行,使用自噬抑制剂3-甲基腺嘌呤或氯喹阻断自噬后,胶原蛋白分泌明显减少,表明自噬可能与心肌纤维化有关[12]。Ghavami等[13]用转化生长因子β1(transforming growth factor-β1,TGF-β1)处理人心房肌成纤维细胞诱导心肌纤维化的同时,观察到自噬体和自噬溶酶体的形成,使用自噬抑制剂抑制自噬激活后心肌纤维化标志物明显减少,表明自噬激活促进心肌纤维化。
2.2.2 自噬受损导致心肌纤维化
研究表明自噬在细胞外基质的调节中至关重要。一方面,许多细胞信号可激活自噬,直接降解胶原蛋白和纤连蛋白[14];另一方面,自噬可调节TGF-β1等促纤维化因子的分泌来调节纤维化过程[15]。迄今为止,多种导致心房纤维化的细胞因子被发现,其中骨桥蛋白(osteopontin,OPN)与多种纤维化病理过程有关,在房颤患者血液循环和心房组织中高表达,且与心房纤维化程度正相关。Lin等[16]发现OPN激活Akt/mTOR信号通路抑制自噬,减少Ⅰ型胶原蛋白和纤连蛋白的降解,促进心房纤维化,OPN的这种促纤维化作用可通过使用雷帕霉素(一种自噬诱导剂)来减弱。
2.3 自噬与细胞物质代谢稳态
蛋白质稳态对维持心肌细胞正常形态和电传导十分重要,蛋白质稳态失衡会引起未折叠蛋白蓄积,导致细胞损伤甚至诱导凋亡。研究发现蛋白质稳态脱轨导致心房重构,是房颤自我持续特性的重要原因。在动物模型和房颤患者的心房组织中观察到内质网应激诱导自噬激活,促进心房重构,使用4-苯基丁酸盐阻断内质网应激或自噬抑制剂抑制自噬激活,使心肌细胞免受电重构,表明自噬激活介导房颤患者的心肌细胞重构[17]。
自噬溶酶体途径是细胞内异常蛋白质、受损细胞器和活性氧清除的重要方式。Ullrich等[18]发现SPRED2(ERK-MAPK信号通路抑制蛋白)缺失的小鼠心律失常的发生率和严重程度明显升高,相比正常小鼠寿命明显缩短;进一步的研究证明SPRED2缺失小鼠自噬受损,心肌细胞大量无功能线粒体和电子致密物的沉积,伴随着活性氧积聚,细胞内物质的自噬降解过程紊乱可能是SPRED2缺失小鼠发生严重心律失常的原因。
脂肪酸氧化是心肌细胞的主要能量来源,血清游离脂肪酸升高是房颤及房颤相关性卒中的危险因素,脂肪酸代谢失调可能导致游离脂肪酸和二酰甘油等毒性代谢产物积聚,促进心房重构。自噬已被证明可通过特异性“脂噬”在脂肪酸代谢中起作用。Shingu等[19]发现房颤患者血清游离脂肪酸升高,且心房内径增大及电-机械延迟,提示心房重构,自噬可能对慢性房颤患者的心脏脂肪毒性有保护作用。
2.4 线粒体自噬在房颤中的作用
线粒体参与了心肌细胞的能量代谢、钙稳态调控、氧化还原、衰老、自噬和凋亡等生理过程。受损线粒体积聚会显著增加线粒体活性氧的产生,启动内源性细胞死亡程序,造成心肌细胞损伤。越来越多的证据表明线粒体功能障碍与心律失常有关。Montaigne等[20]发现,心房肌线粒体功能受损的代谢综合征患者行冠状动脉旁路移植术后房颤发生风险较高,表明受损线粒体蓄积可能是房颤发生的潜在因素。同样,快速起搏的心房肌细胞中也检测到线粒体Ca2+处理能力下降、线粒体应激、线粒体膜电位和ATP产生降低,表明房颤也会导致线粒体损伤[21]。
受损线粒体会产生大量活性氧并损伤细胞,线粒体的选择性自噬清除,即线粒体自噬,对清除受损线粒体至关重要。线粒体自噬靶向降解受损线粒体,维持线粒体正常功能及数量,是细胞自稳的重要机制[22]。Zhou等[23]发现与窦性心律组相比,房颤组患者自噬受损,且细胞内可见较多受损线粒体,表明自噬靶向降解受损线粒体功能受损,这也许是研究房颤机制的新方向。目前对线粒体自噬与房颤的关系及分子机制研究有限,线粒体自噬可能是房颤的潜在机制和治疗靶点。
3 总结与展望
心肌细胞属于终末分化细胞,已丧失分化和再生能力,自噬是机体应激状态下的自我保护机制,对维持心肌细胞功能和活性具有重要作用。如图2所示,心肌细胞通过自噬激活降解异常蛋白质、毒性代谢产物和受损细胞器,对心肌具有保护作用。然而,近年来亦有大量研究证明异常自噬激活在心房重构发生中起重要作用,如图3所示。自噬与房颤之间的机制尚未完全阐明,自噬激活在房颤发生过程中是起促进还是抑制作用仍需进一步研究。
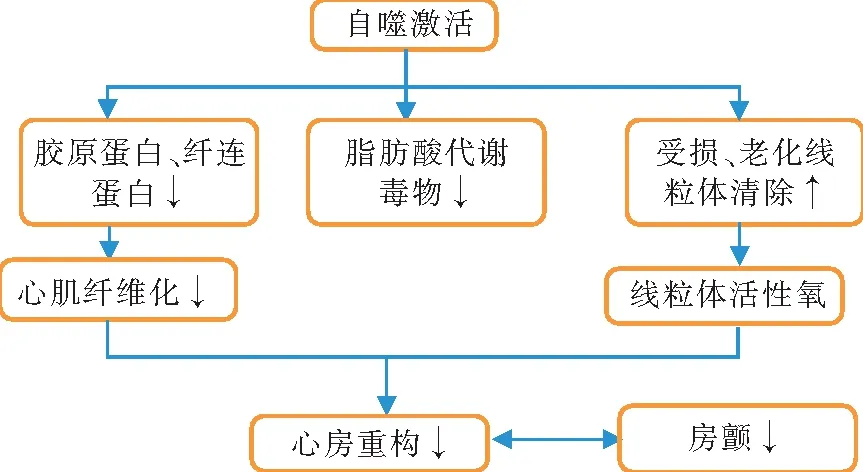
注:↑表示促进或增加,↓表示抑制或减少。
房颤是多因素共同作用的结果,又因心房重构难以逆转,药物治疗及导管消融效果有限,其易复发及持续特性是困扰诸多学者的难题。聚焦于心房重构的分子机制,限制心肌细胞重构可能是房颤防治的关键。通过调节自噬改善心房重构对包括房颤在内的心脏疾病可能是一个新的治疗靶点。

注:↑表示促进或增加,↓表示抑制或减少,IL-Ca2+为L型钙电流,APD为动作电位时程,AERP为心房有效不应期。
