GCK基因多态性与原发性肾病综合征糖皮质激素治疗相关SD的关联分析*
2022-04-13陈昕彦于萌李湘许静宜林奕辰刘小丹
陈昕彦 于萌 李湘 许静宜 林奕辰 刘小丹
近年来,原发性肾病综合征(primary nephrotic syndrome,NS)患者免疫抑制治疗的有效性和安全性受到越来越多的关注。类固醇性糖尿病(steroid diabetes,SD)是接受糖皮质激素治疗的肾病综合征患者发生的严重代谢并发症,导致心血管疾病风险增加[1]。调查显示,NS患者免疫抑制治疗后SD的1年累积发病率为34%[2]。糖皮质激素作为一线免疫抑制剂,是诱发SD的主要危险因素[3]。据观察,糖皮质激素对胰岛β细胞的有害作用呈剂量依赖性和可逆性,并且糖皮质激素与SD的强烈关联是由于胰岛β细胞中较高的药物浓度改变了胰岛素分泌所致[4]。葡萄糖激酶(glucokinase,GCK)是参与葡萄糖代谢过程的关键蛋白,也是参与调节细胞内游离葡萄糖水平、维持葡萄糖稳态的关键激酶之一。GCK活性下降与2型糖尿病有关[5]。然而,在以糖皮质激素为基础的免疫抑制治疗中,GCK的遗传多态性与SD发生之间的关系尚不确定。在本研究中,我们分析了接受糖皮质激素免疫抑制治疗的NS患者SD事件的发生和GCK基因的单核苷酸多态性(single-nucleotide polymorphisms,SNPs)的相关性。
资料与方法
1 一般资料 从2015年1月~2019年12月,本研究连续招募了148名接受糖皮质激素治疗的原发性肾病综合征患者。所有参与者都是第一次接受糖皮质激素治疗。根据糖皮质激素治疗后是否出现SD将受试者分为2组:SD组(n=52)和非SD组(n=96)。SD诊断标准:患者在口服葡萄糖耐量试验中,空腹血糖≥7.0 mmol/L,负荷后2 h血糖≥11.1 mmol/L,或糖皮质激素治疗后需要注射胰岛素或口服降糖药控制血糖3个月以上[6]。如果患者有糖尿病史、严重代谢性疾病(如甲状腺疾病、库欣综合征、肢端肥大症或嗜铬细胞瘤)或传染病,则排除在外。所有参与者均签署了知情同意书。在整个观察期内,免疫抑制方案以醋酸泼尼松1 mg/kg/d作为起始治疗剂量。
2 SNP选择和基因分型 本研究在NCBI(http://www.ncbi.nlm.nih.gov/SNP)的dbSNP数据库131版和国际Hapmap项目(http://www.Hapmap.ORG/index.html)中分析了GCK基因的数据,最终确定了3个与糖尿病相关的SNPs位点:rs13306388、rs2971672、rs1799884。研究排除了具有未知杂合性的SNP和在一般人群中具有小于5%的次要等位基因频率的SNP。
采用市售的DNA Extraction试剂盒(日本Qiagen公司)从乙二胺四乙酸涂层管中的血液样品中提取基因组DNA。在用每种基因的特异性引物(表1)扩增基因组DNA后,通过直接测序进行SNP基因分型。使用ABI PRISM 3730XL分析仪(美国PE Applied Biosystems公司)对聚合酶链反应产物进行基因组测序,并用SeManII软件(美国DNASTAR Inc.公司)分析序列数据。GCK中的rs13306388、rs2971672、rs1799884的基因型成功率为99.67%。

表1 GCK基因中每个SNP的引物序列
3 数据分析 在研究期间分析了148名受试者GCK的rs13306388、rs2971672、rs1799884位点,并使用SNPstats软件中的Hardy-Weinberg平衡检查其顺应性。使用SPSS 16.0进行统计分析。所有连续变量均表示为平均值±标准差。使用卡方检验分析两组之间等位基因频率。多重遗传模型,共显性1(主要等位基因纯合子vs.杂合子),共显性2(主要等位基因纯合子vs.次要等位基因纯合子),显性(主要等位基因纯合子vs.次要等位基因纯合子+杂合子)和隐性(主要等位基因纯合子+杂合子vs.次要等位基因纯合子),用于多元logistic回归分析,以确定GCK中的rs13306388、rs2971672、rs1799884位点与SD的关联。P<0.05表示差异具有统计学意义。
结 果
1 受试者的基本特征 两组的临床特征见表2。所有受试者的SD总发生率为35.1%(52/148)。本研究平均随访时间为82个月,两组随访时间无明显差异。SD组受试者的年龄大于非SD组(P<0.001),并且使用糖皮质激素浓度/剂量更高(P<0.05)。两组患者的性别比、体重指数、随访时间、强的松治疗剂量、治疗前HbA1c水平均无差异(P>0.05)。
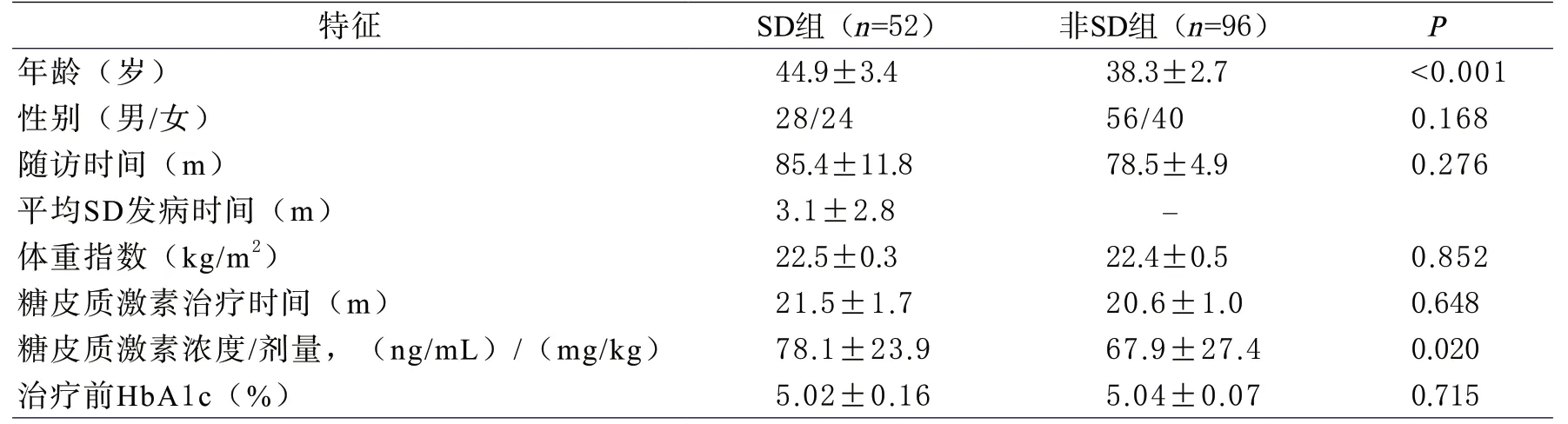
表2 患者的临床特征
2GCK多态性的等位基因频率 本研究中所有SNP的基因型分布均为Hardy-Weinberg平衡(P>0.05)。GCK多态性的等位基因频率如表3所示,仅rs2971672*C等位基因与SD的发生显著相关(OR=0.37;95%CI=0.16~0.80;P=0.012)。

表3 非SD和SD患者GCK基因多态性的等位基因频率
3GCK基因多态性与SD发生的关系 表4显示,在多元logistic回归分析中调整年龄后,GCK基因型的SNP rs1799884(共显性2模型:OR=3.63,95%CI=1.19~12.06,P=0.027;隐性模型:OR=3.78,95%CI=1.22~11.94,P=0.035)和SNP rs2971672(共显性1模型:OR=0.32,95%CI=0.13~0.75,P=0.009;显性模型:OR=0.29,95%CI= 0.12~0.68,P=0.002)与SD的发生显著相关。

表4 非SD和SD患者GCK基因多态性的基因型频率
讨 论
SD是NS糖皮质激素治疗的一个重要并发症[7]。糖皮质激素可直接作用于胰岛β细胞,参与调节葡萄糖诱导的胰岛素分泌[8]。大量研究显示,糖皮质激素副作用的发生率与糖皮质激素的浓度/剂量比密切相关,由于不同人群的代谢多样性,糖皮质激素的浓度/剂量比存在差异[9-10]。值得注意的是,本研究发现SD组患者比非SD组患者使用更高浓度/剂量比的糖皮质激素,这意味着糖皮质激素的浓度/剂量比存在诱导SD的潜在风险。
一些研究表明,SD的发生可能受遗传因素的影响,包括维生素D受体、锌转运蛋白、趋化因子配体5基因以及成员8基因[11-12]。然而,很少有报道确定糖皮质激素诱导SD的遗传易感位点。目前认为,糖皮质激素所致胰岛β细胞功能障碍可能是NS免疫抑制治疗后糖耐量持续受损的最重要机制[13]。GCK是调节胰岛β细胞胰岛素释放的关键酶,由位于染色体7p15.3-p15.1的葡萄糖激酶基因编码[4]。基因突变导致的GCK异常会破坏葡萄糖稳态,出现高血糖和低血糖。因此,本研究检查了与胰岛β细胞功能受损的T2DM风险相关的GCK遗传变异情况。通过文献查阅,本研究选取了3个与糖尿病相关的SNPs位点rs13306388、rs2971672、rs1799884进行分析,多元回归分析结果显示,rs2971672和rs1799884位点与SD的发生显著相关。
研究发现[14],在汉族人群中,GCK基因区域的rs2971672位点与糖尿病遗传易感性密切相关。本研究证实了上述研究结果,发现在共显性1模型和显性模型下,rs2971672位点的基因型分布在SD组和非SD组中存在显著差异,并且通过等位基因频率研究,rs2971672*C等位基因与SD的发展显著相关,提示该位点在共显性1和显性模型下与SD的易感性密切相关。此外,本研究发现,rs1799884在共显性2和隐性模型下与SD的易感性密切相关。CHENG[15]等研究证实GCK rs1799884与HOMAβ、胰岛素生成指数和一、二期胰岛素分泌相关,单核苷酸多态性与2型糖尿病相关。同样,TARNOWSKI等[16]研究发现GCKrs1799884多态性与孕妇高妊娠糖尿病风险之间存在关联。然而,本研究的数据未显示rs13306388与SD之间的显著关联,这与FRIGERI等报道的rs13306388位点突变与妊娠期糖尿病显著相关[17]的结论不符,可能与种族和地域差异有关。此外,本研究发现SD组受试者的年龄大于非SD组,与文献报告一致[2]。
总之,GCK基因区域的rs2971672和rs1799884位点突变可能影响接受糖皮质激素免疫抑制治疗的肾病综合征患者SD事件的发生。本研究存在一定的局限性,样本量较小,今后需更大的样本量进行验证研究,并对其他未在本研究中分析的GCK位点进行进一步的单核苷酸多态性研究。
利益冲突所有作者均声明不存在利益冲突
