双侧PKP 与双侧PVP 治疗急性单节段骨质疏松性椎体压缩性骨折疗效对比研究
2022-04-13卢冬焱杨波刘会毅寇程新吕玉明王簕刘松
卢冬焱,杨波,刘会毅,寇程新,吕玉明,王簕,刘松
(广州医科大学附属第三医院骨科,广东 广州510150)
骨质疏松症患者随着我国人口老龄化不断逐年增多,骨质疏松症的防与治已经成为我国社会急需面对的严峻问题。2018 年中国首次居民骨质疏松症流行病学调查结果显示:我国老年女性骨质疏松症的患病率远远高于老年男性,年龄超过65 岁以上的女性骨松发病率超过一半。并且我国绝经后骨质疏松患病率显著高于欧美国家。据相关文献报道,全球平均每3 秒即发生一起骨质疏松性骨折,全球范围内影响2 亿患者[1],50 岁以上人群中约1/3 的女性和1/5 的男性将会发生一次骨质疏松性骨折[2],在骨质疏松性骨折中,以椎体压缩性骨折发病率最高[3]。相关研究资料显示我国骨质疏松性骨折的医疗支出逐年增加[4],给我国医疗行业以及患者家庭带来沉重的负担。并且,我国现阶段骨质疏松的现状不容乐观,因此明确骨质疏松性椎体压缩性骨折 (osteoporotic vertebral compression fractures,OVCF)的诊断及规范治疗具有重要意义。OVCF 是骨质疏松症中最常见、最严重的并发症之一,常因剧烈胸腰背部疼痛、活动功能受限、脊柱后凸畸形、神经脊髓功能障碍等一系列症状极大地困扰患者日常生活,极大地降低患者的生存质量。
本研究旨在通过回顾性分析研究双侧经皮椎体后凸成形术(PKP)与双侧经皮椎体成形术(PVP)治疗这两种治疗方案进行对比研究,找出安全性、有效性、更经济同时兼具术后恢复快、并发症少的干预方式。
1 材料与方法
1.1 纳入标准与排除标准
1.1.1 纳入标准 (1)继发于低能量损伤出现胸背部或者腰背部疼痛症状明显,X 光片示椎体压缩性骨折,磁共振检查(MRI)提示为T2加权像显示骨髓水肿即新鲜椎体压缩性骨折,同时双能X 线骨密度仪(DEXA)T 值≤-2.5;(2)CT 检查提示伤椎后缘及椎弓根壁完整,对应脊髓节段、硬膜囊水平及神经根无明显受压;(3)急性单节段伤椎骨折,骨折时间<2 w;(4)初次行双侧PVP 或者PKP 手术者;(5)单节段新发性椎体压缩性骨折,椎体骨折压缩大于或等于1/3 但不超过椎体高度的1/2;(6)获得本院医学伦理委员会审核批准。
1.1.2 排除标准 (1)双能X 线骨密度仪检测(DEXA)T 值>-2.5;(2)磁共振检查(MRI)提示为陈旧性骨折或无症状稳定性椎体压缩性骨折;(3)伤椎压缩骨折超过椎体高度的1/2 者或者CT 检查示伤椎椎体后壁骨质破坏及椎弓根壁不完整,无安全穿刺入路者,以及相应脊髓节段、硬膜囊水平或神经根明显受压者;(4)伤椎节段≥2个;(5)非首次行PVP/PKP 或者行单侧PVP/PKP 治疗的患者;(6)患者基础条件不允许手术治疗者,如合并严重心、肺、脑、血液等严重系统疾病以及患有精神系统疾病以及认知功能不健全者。(7)其他病理性骨折患者:如症状性脊柱血管瘤、多发性骨髓瘤、脊柱转移性肿瘤等;(8)术后失访等临床资料不全者。
1.2 一般资料
按上述纳入与排除标准筛选出2018 年8 月至2020 年12 月广州医科大学附属第三医院骨科采用双侧PVP/PKP 治疗的81例(81个椎体)单节段OVCF 患者,其中,男性患者17例(21.00%),女性患者64例(79.00%),年龄跨度为60 至96 岁,平均年龄(76.92±7.24)岁,所有患者主要诊断明确,均确诊为单节段骨质疏松性椎体压缩性骨折。按微创手术方式不同分为:试验组(双侧PKP组,n1=36)及对照组(双侧PVP组,n2=45),其中试验组36例共36个椎体,男9例,女27例,平均年龄(77.00±8.67)岁,均有明确的跌倒外伤史,病程1~14 d,平均(6.60±6.71)d;伤椎分布如下:T11椎体1个,T12椎体7个,L1椎体13个,L2椎体9个,L3椎体4个,L4椎体2个。对照组45例共45个椎体,男8例,女37例,平均年龄(76.69±9.54)岁,均有明确的跌倒外伤史,病程1~14 d,平均(5.08±4.60)d,伤椎分布如下:T10椎体2个,T11椎体8个,T12椎体12个,L1椎体9个,L2椎体7个,L3椎体4个,L4椎3个。两组患者年龄、性别、病程、体重、骨密度等术前一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.3 手术方法
1.3.1 试验组 患者于可透视脊柱外科手术床上取俯卧位,C 形臂X 线机透视下,予网格状简易辅助体表定位器初步确定伤椎双侧椎弓根在体表投影并标记,常规消毒、铺巾,从双侧椎弓根外上缘予1∶1生理盐水稀释后的1%利多卡因逐层浸润麻醉直至双侧椎弓根骨膜处,用尖刀分别在伤椎双侧椎弓根穿刺点位置作一长约5 mm 横形小切口,置入带芯穿刺针,在C 形臂X 线机透视辅助下穿刺针尖到达椎体中后1/3,拔出穿刺针芯,通过骨钻制备骨隧道,将含有照影剂的球囊置入伤椎椎体内,C 形臂X线机透视辅助下确定球囊位于伤椎椎体的前中部,并位于上下终板中间或者位于塌陷终板下面的最佳位置中,进行球囊扩张,当压力达到150~200 psi 时或伤椎椎体复位较满意后,维持扩张球囊2~3 min后取出球囊。将拉丝后期、团状期的早期的PMMA通过推杆注入伤椎,本组骨水泥注入量约为2.5~6.0 mL,平均骨水泥注入量约为(3.91±0.46) mL。待PMMA 骨水泥硬化后结束手术。
1.3.2 对照组 患者于可透视脊柱外科手术床上取俯卧位,C 形臂X 线机透视下,予网格状简易辅助体表定位器初步确定伤椎双侧椎弓根在体表投影并标记,常规消毒、铺巾,从双侧椎弓根外上缘予1∶1生理盐水稀释后的局麻1%利多卡因逐层浸润麻醉至伤椎双侧椎弓根骨膜处,用尖刀分别在伤椎双侧椎弓根穿刺点位置作一长约5 mm 横形小切口,置入带芯穿刺针,在C 形臂X 线机透视辅助下穿刺针尖到达椎体前中1/3 处。将拉丝后期、团状期早期的PMMA 骨水泥通过推杆,缓慢、低压注入伤椎椎体内,并实时动态透视监测伤椎椎体内骨水泥弥散分布情况,防止发生骨水泥向后渗漏至椎管内,导致截瘫等严重并发症。本组的骨水泥注入量约为2.0~5.5 mL,平均骨水泥注入量约为(3.78±0.68) mL。待PMMA 骨水泥硬化后结束手术。
1.4 术后处理
术后严密监测患者生命体征,嘱绝对卧床休息24 h,24 h 后佩戴腰围保护下可下地行走锻炼,所有患者术后嘱患者按抗骨质疏松治疗根据中华医学会骨质疏松和骨矿盐疾病分会发布的《原发性骨质疏松症诊治指南(2017 年)》选择抗骨质疏松药物:如基础药物(钙尔奇600 mg 口服qd)+抗骨吸收药(阿仑膦酸钠维D3 片70.14 mg 口服qw/唑来膦酸钠5 mg 静注1 年1 次(持续3 年)),规范抗骨质疏松治疗;鼓励患者适度户外运动,晒太阳,腰围保护1~3个月,坚持功能锻炼。术后3 d 内复查胸腰椎X 光线片,了解骨水泥位置及弥散情况,必要时予行CT 检查;术后3 月恢复正常生活,加强腰背部肌肉康复锻炼,坚持规范化抗骨质疏松治疗[26]。同时告知患者须按医嘱定期返院或在当地医疗机构进行复查。
1.5 相关评价指标
1.5.1 详细记录两组患者操作时间(min)、总透视次数(次)、术中出血量(mL)、骨水泥注入量(mL);两组术前、术后Oswestry 功能障碍指数、术前、术后3 天、末次随访VAS 评分、详细测量并记录两组患者术前、术后伤椎前缘高度(AVBH)、中线高度(MVBH)、后缘高度(PVBH)、术前、术后伤椎椎体局部Cobb 角比较,对两组患者术后腰背部活动功能进行详细的对比研究,复查胸腰椎X 光片及胸腰椎MRI 或者CT(必要时),观察统计术后骨水泥渗漏、邻椎新发骨折等并发症发生情况。
1.5.2 VAS 评分即视觉疼痛模拟评分[5]患者需根据自身实际情况打分,轻度疼痛(0~3分),中度疼痛(4~6分),重度疼痛(7~10分),若得分越高,效果则越差。
1.5.3 Oswestry 功能障碍指数[6]Oswestry 功能障碍数问卷表(ODI)由通常由以下疼痛强度;生活自理;提物;步行;坐位;站立;干扰睡眠;性生活;社会生活;旅游等10 方面的问题组成,如果全部问题均做了问答,统计分数的方法为:实际得分/50(最高可能得分)×100%,如果没有作答其中一个问题,则统计得分:实际得分/45(最高可能得分)×100%,如越高表明功能障碍越严重。
1.5.4 在本院放射科PACS 系统上,均在患者胸腰椎X 光矢状位片上用相同比例尺分别统计测量术前、术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)、后缘高度(PVBH)。伤椎椎体局部Cobb 角按Phillips[7]等学者报道的方法测量:在胸腰椎X 光侧位片上测量伤椎上终板平行线与伤椎下终板平行线的夹角,定义为伤椎椎体局部Cobb 角,本研究中所有患者的影像学数据由同一治疗组医师独立完成,测量3 次后取平均值作为最终结果,进行统计学分析。
1.6 统计学分析
本研究采用SPSS 24.0 统计软件进行数据统计学分析,计量资料以()表示,采用独立样本t检验进行组间比较,计数资料以率(%)表示,采用χ2检验或Fisher's 确切法或Wilcoxon 秩和检验进行组间比较;统计学结果以P<0.05 表示具有统计学意义。
2 结果
2.1 两组患者手术指标比较
两组患者共81个椎体均顺利完成手术,两组患者一般性手术指标(操作时间、总透视次数、术中出血量、骨水泥注入量)数据统计结果见(表1),手术操作时间试验组为(53.92±7.38)min,对照组为(46.55±8.91)min,组间比较,差异具有统计学意义(P<0.05);总透视次数试验组平均值为(21.18±3.53)次,对照组平均值为(19.73±3.47)次,组间比较,差异具有明显统计学意义(P<0.05);术中出血量、骨水泥注入量两组间进行比较,差异无显统计学意义(P>0.05)。
表1 两组患者手术指标比较(,n1=36,n2=45)

表1 两组患者手术指标比较(,n1=36,n2=45)
2.2 两组患者治疗疗效评价
两组患者术前、术后Oswestry 功能障碍指数及术前、术后第3 天、末次随访VAS 评分统计结果见(表2),两组术前、术后ODI 及术前、术后第3 天、末次随访VAS 评分对比,差异无明显统计学意义(P>0.05),但是,两组术后ODI 及术后第3 天、末次随访VAS 评分分别与术前对比,差异具有统计学意义(P<0.05)。
表2 两组术前、两组术前、术后Oswestry 功能障碍指数及术前、术后第3 天、末次随访VAS 评分比较(,n1=36,n2=45)
注:与术前数据对比,*P<0.05,与术后第3 天VAS 评分对比,#P<0.05;ODI=Oswesrty 残疾指数;VAS=视觉模拟评分
2.3 两组患者术前、术后伤椎椎体高度及伤椎椎体局部Cobb 角变化
两组患者术前、术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)、后缘高度(PVBH)和伤椎椎体局部Cobb 角统计学结果(见表3),两组术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)分别与术前对比,差异具有明显统计学意义(P<0.05);两组术后椎体后缘高度与术前对比,差异不具有明显统计学意义(P>0.05);两组术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)分别进行组间对比,差异有统计学意义(P<0.05)且试验组术后椎体前缘及中线高度恢复情况优于对照组;两组术后椎体后缘高度组间对比,差异不具有明显统计学意义(P>0.05)。两组术后伤椎椎体局部Cobb 角分别与术前伤椎椎体局部Cobb 角对比,差异具有统计学意(P<0.00);术后伤椎椎体局部Cobb 角两组间对比,差异具有统计学意义(P=0.037<0.05),提示试验组术后伤椎椎体局部Cobb 角矫正效果优于对照组。
表3 两组患者术前、术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)、后缘高度(PVBH)和伤椎椎体局部Cobb 角比较(,n1=36,n2=45)

表3 两组患者术前、术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)、后缘高度(PVBH)和伤椎椎体局部Cobb 角比较(,n1=36,n2=45)
注:与术前比较,aP<0.05;AVBH=伤椎椎体前缘高度;MVBH=伤椎椎体中线高度;PVBH=伤椎椎体后缘高度
2.4 两组患者骨水泥渗漏
两组患者骨水泥渗漏相关情况统计分析结果见(表4),试验组中共有5例患者出现了骨水泥渗漏并发症,总体骨水泥渗漏率为13.89%,其中按骨水泥渗漏部位分型[8-9],5例中有2例属于type D(通过皮质骨缺损渗漏到椎间盘),3例属于type E(通过椎旁静脉渗漏);对照组共有8例出现骨水泥渗漏,骨水泥渗漏率为17.78%,8例中2例属于type C(通过穿刺针道渗漏),有4例属于type D(通皮质骨缺损渗漏到椎间盘),2例属于type E(通过椎旁静脉渗漏) 两组共13例患者虽出现骨水泥渗漏的并发症,但渗漏的骨水泥均未进入后方椎管内,出现骨水泥渗漏的病例未出现明显脊髓或神经根损伤等严重症状及体征,均未予特殊处理,建议患者定期随访观察。两组骨水泥渗漏采用卡方检验进行统计学分析,差异无统计学意义(χ2=0.224,df=1,P=0.636>0.05)。
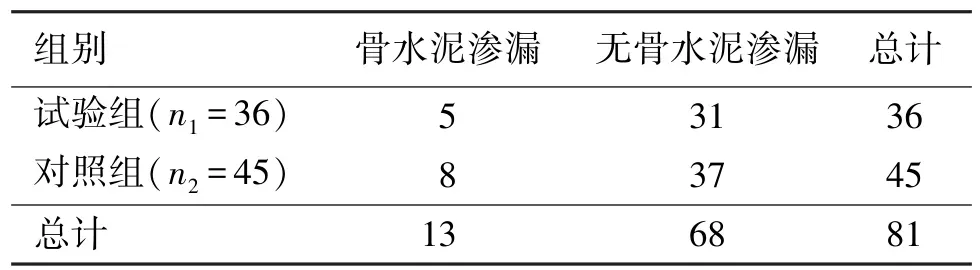
表4 两组患者骨水泥渗漏情况比较(n1=36,n2=45)
2.5 两组患者术后随访伤椎椎体再发骨折
两组患者术后随访伤椎椎体再发骨折情况统计结果见(表5),其中,试验组术后随访期间共出现7例伤椎椎体再发骨折,伤椎椎体再发骨折发生率为19.44%,对照组术后随访期间共5例出现伤椎椎体再发骨折,伤椎椎体再发骨折发生率11.11%,试验组伤椎椎体再骨折发生率明显高于对照(19.44%>11.11%),伤椎椎体再发骨折患者予保守治疗或行单/双侧PVP 治疗,疼痛得到明显缓解,两组采用独立二分类资料的χ2检验进行比较,差异未见明显统计学意义(χ2=1.101,P=0.294>0.05)。有一典型病例(见图1):患者赵XX,男,94 岁,于2019-8-30 因“咳嗽致腰背部疼痛3 天余”收入院,患者既往因“1.腰1 椎体新鲜压缩性骨折;2.重度骨质疏松”于2018-10-22 在我院行双侧经皮穿刺腰1 椎体成形术,术程顺利,术后规范抗骨质疏松治疗。患者入院后,VAS 评分8分,予行腰椎X 光片检查(A、B):腰1 椎体高度较前压缩,骨水泥填充,未见明显骨水泥渗漏,余椎体未见明显骨折征象。腰椎MRI 提示(C):腰1 椎体压脂序列呈高信号,提示腰1 椎体骨髓水肿。考虑患者腰1 椎体骨折再骨折,结合患者影像检查,于2019-9-2 行局麻下双侧经皮穿刺腰1椎体成形术(D),术后24h 患者腰背疼痛较前明显减轻,VAS 评分3分,术后第3 天复查腰椎X 光片(E、F):腰1 椎体再次PVP 术后,骨水泥较前增多、未见渗漏征,腰1 椎体高度较前明显恢复。

图1 典型病例

表5 两组患者术后随访期间伤椎椎体再发骨折情况比较(n1=36,n2=45)
2.6 两组患者术后随访期间邻椎椎体新发骨折
两组患者术后随访期间邻椎椎体新发骨折情况统计结果见(表6),其中试验组术后随访期间共9例出现邻椎椎体新发骨折,邻椎椎体新发骨折发生率为25.00%,对照组术后随访期间共11例出现邻椎椎体新发骨折,邻椎椎体新发骨折率为24.44%,邻椎椎体新发骨折患者予行经皮椎体强化术,疼痛得到明显缓解,两组采用独立二分类资料的χ2检验进行比较,χ2=0.003,df=1,P=0.954>0.05),差异无统计学意义。有一典型病例(见图2):患者邹XX,女,86 岁,2020-02-24 因“跌倒致胸背部疼痛2 天余”收入院,平素身体情况一般,入院后专科查体:患者脊柱生理曲度存在,未见明显侧凸畸形,胸腰段棘突及双侧椎旁肌明显压痛叩痛,余四肢肌力及肌张力正常,生理反射存在,病理反射未引出,VAS 评分8分。予行脊柱X 光线检查提示(图2A、B):胸11 椎体压缩性骨折,胸腰椎MRI 检查提示(图2C):胸11 椎体新鲜压缩性骨折;骨密度检查提示(L1-L3)T<-2.5,诊断:1.胸11 椎体新鲜压缩性骨折;2.重度骨质疏松。诊断明确,各项检查未见明显手术禁忌症,于2020-02-25 在介入手术中心行局麻下双侧经皮穿刺胸11 椎体成形术(图2D),术后48 h患者胸腰段背部疼痛明显减轻,VAS 评分为4分,术后按抗骨质疏松治疗根据中华医学会骨质疏松和骨矿盐疾病分会发布的《原发性骨质疏松症诊治指南(2017 年)》选择抗骨质疏松药物:基础药物(钙尔奇600 mg 口服qd)+抗骨吸收药(阿仑膦酸钠维D3片70.14 mg 口服qw),规范抗骨质疏松治疗;术后第3 天复查脊柱X 光片示(图2E、F):胸11 椎体高度较前恢复,骨水泥弥散良好,未见明显骨水泥渗漏。术后第5 天顺利出院。患者于2020-04-01 因“咳嗽致胸背部疼痛5 天余”再次入院治疗,查体:脊柱生理曲度存在,未见明显侧凸畸形,胸腰段棘突及双侧椎旁肌明显压痛叩痛,余四肢肌力及肌张力正常,生理反射存在,病理反射未引出,VAS 评分8分。予行脊柱X 光线检查提示(图2G、H):胸10 椎体压缩性骨折,胸腰椎MRI 检查提示(图2I):胸10椎体新鲜压缩性骨折;诊断:1.胸10 椎体新鲜压缩性骨折;2.重度骨质疏松。诊断明确,各项检查未见明显手术禁忌症,于2020-4-2 在介入手术中心行局麻下双侧经皮穿刺胸10 椎体成形术(图2J),术后3天复查脊柱X 光片(图2K,L):胸10 椎体高度较前恢复,椎体内骨水泥弥散良好,未见明显骨水泥渗漏。术后48h 患者胸背部疼痛明显减轻,VAS 评分2分,术后继续予原方案规范抗骨质疏松治疗。

图2 典型病例

表6 两组患者术后随访期间邻椎椎体新发骨折情况比较(n1=36,n2=45)
3 讨论
3.1 PKP/PVP 治疗OVCF 的机制
微创技术PVP/PKP 注入PMMA 骨水泥可修复椎体微骨折,同时恢复伤椎椎体高度及后凸Cobb角,并提高伤椎椎体的刚度及强度,减少机械应力,从而减轻神经受到的压迫及刺激,解除或缓解疼痛,从而达到治疗的目的,其主要机制为[10-14]:1.注入的PMMA 骨水泥可以降低椎体内骨折微动,增加伤椎的稳定性和强度,并防止伤椎压缩程度进一步进展,可改善脊柱的生物力学特性,具有明显机械稳定性;2.伤椎周围的组织和神经末梢被注入PMMA 骨水泥 固化时产生的热量完全破坏;3.伤椎内神经滋养血管被PMMA 骨水泥阻断,使伤椎内的神经末梢发生缺血性坏死;4.PMMA 骨水泥具有神经细胞化学毒性作用,PMMA 骨水泥通过上述机制减轻了伤椎内神经末梢的刺激,明显缓解患者腰背部疼痛,提高患者生活质量[15-16]。本研究中,两组患者术后Oswestry 功能障碍指数、术后3 天、末次随访VAS 评分均优于术前,但组间比较,差异不具有统计学意义(P>0.05),说明两种术式均可经注射骨水泥实现稳定伤椎目的,增加伤椎的强度并快速减轻腰背部疼痛症状,尽早恢复患者活动功能,与其他学者研究结果也相符合[17]。
3.2 PKP/PVP 治疗OVCF 的放射影响
PKP 及PVP 微创手术治疗过程中伤椎定位清晰准确、双侧椎弓根体表位置的标记、穿刺过程中监测、注入聚甲基丙烯酸甲酯骨水泥监测等关键步骤均需C 形臂X 线机实时透视监测下保驾护航,手术操作时间及总透视次数与医患双方遭受的放射暴露剂量成正相关[18]。同时医护人员因工作特殊,需长期暴露在放射线下工作,身体健康更容易受到不良影响[19]。本研究显示,对照组手术操作时间、总透视次数较试验组显著减少,意味着对照组术中医患双方的放射暴露剂量较试验组低以及术中患者俯卧位等手术体位的维持时间更短,可以降低患者围手术期间的风险,同时也可提升患者就医体验感。对比分析两种术式后,关键原因可能是试验组增加了球囊扩张这一重要操作步骤,相较对照组操作要多一些。因此,如果只从手术操作时间以及术中总透视次数方面考虑,对照组优势更明显。随着脊柱微创治疗方向数字化、智能化技术不断进展,术中可应用脊柱智能微创手术定位器辅助精准定位穿刺、手术智能导航系统可视化监测,使治疗更微创,使患者受益最大化[20]。
3.3 PKP/PVP 治疗OVCF 后伤椎高度变化
本研究中两组术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)分别与术前对比,差异具有明显统计学意义(P<0.05);两组术后伤椎椎体前缘高度(AVBH)、中线高度(MVBH)分别进行组间对比,差异有统计学意义(P<0.05)且试验组术后椎体前缘及中线高度恢复情况优于对照组;两组术后伤椎椎体局部Cobb 角分别与术前伤椎椎体局部Cobb 角对比,差异具有统计学意义(P<0.05);两组间对比,差异具有统计学意义(P=0.037<0.05),提示试验组术后椎体高度恢复情况、术后伤椎局部Cobb 角矫正效果均优于对照组。说明双侧PKP 术式在恢复伤椎局部Cobb 角方面是有效的,可改善患者的脊柱矢状面畸形情况[21]。对比分析两组手术术式可发现,对于单节段新鲜OVCF,按Denis 三柱理论[22]分区,大多数OVCF,大部分累及椎体前柱,伤椎椎体前柱应力能力受限,伤椎椎体高度的丢失,导致脊柱后凸畸形。由于伤椎局部Cobb 角增大,脊柱生物力学改变,伤椎力线的改变,伤椎椎体后柱结构受力减少,进一步加重伤椎椎体前柱生物力学负荷,造成病情进一步发展,更容易导致脊柱后凸畸形加重及伤椎椎体再骨折及邻近节段椎体新发压缩性骨折。试验组术中伤椎椎体经双侧球囊扩张有效地抬高塌陷终板,同时压紧伤椎椎体内周围的骨小梁骨,最大可能地恢复伤椎椎体高度,同时注入PMMA骨水泥填充空腔,固化后有效维持伤椎椎体高度,进而最大可能地纠正脊柱矢状面失衡状态[23],使脊柱生物力学得以尽可能维持正常力线,尽可能降低椎体再骨折及邻近椎体骨折的风险[24]。
3.4 PKP/PVP 治疗OVCF 并发骨水泥渗漏
PVP/PKP 的最常见并发症是骨水泥渗漏[25]。本研究中两组共13例患者虽出现骨水泥渗漏并发症,但骨水泥均未渗漏至后方椎管内,均未出现脊髓、神经根损伤等严重症状及体征,均未予特殊处理,建议患者定期随访观察。两组骨水泥渗漏率采用独立二分类资料的卡方检验进行统计学分析(χ2=0.224,df=1,P=0.636>0.05),差异无统计学意义。最大可能原因为本次研究纳入样本量小,属于单中心研究,随访时间较短相关。本研究中试验组骨水泥渗漏率(13.89%)低于对照组骨水泥渗漏率(17.78%),与国内外其他学者相关研究结果相符合[26],主要原理机制为行PKP 术时,扩张的球囊使伤椎椎体内形成一个空腔,降低了骨水泥推注压力,使骨水泥灌注过程保持低压,缓慢,有利于降低骨水泥渗漏发生概率。结合本次研究结果,分析骨水泥渗漏的原因为[27]:1.客观原因:(1)严重的骨质疏松,骨水泥从椎体上的滋养孔漏出,容易造成硬膜外漏;(2)椎基底静脉走行变异;(3)伤椎椎体后壁形态各异。主观原因:(1)手术医师手术熟练度欠缺,穿刺针放置位置不理想,定位不准确,多次反复穿刺,造成伤椎终版损伤以及椎弓根内壁破裂;(2)对受伤椎体的情况了解不够彻底;术前未仔细研究患者脊柱X线、MRI、CT 片,对伤椎骨折线走行不了解;(3)过度追求骨水泥在伤椎椎体内弥散效果,导致骨水泥推注时间过早或者过多推注骨水泥注入量;(4)术后拔出工作通道过早可造成椎旁软组织漏;(5)术中未充分运用C 形臂X 线机进行实时透视;(6) 椎体压缩程度较大,球囊扩张不明显,不能形成有效的空腔,未能压紧周围骨小梁,导致需较大压力推注骨水泥,椎体骨折裂隙过大,易出现骨水泥渗漏。骨水泥渗漏防治措施[28-29]:(1)术前完善相关X 线、CT、3D-CT、MRI 等相关影像学检查,术者实施手术前因仔细阅片,熟悉伤椎椎体解剖情况及骨折线走行,根据伤椎情况合理选择术式;(2)术中争取一次穿刺成功,避免多次穿刺;尽量穿向椎体中部;(3)行PKP 术式,伤椎椎体的前中部是球囊扩张的较安全的位置,扩张球囊尽量放置在伤椎塌陷的终板下方或者上下终板的中间的位置;(4)把握好骨水泥灌注时机,选择拉丝后期或团状早期灌注骨水泥,可防止推注时间过早导致骨水泥过稀在椎体内弥散过快出现不同类型的骨水泥渗漏;同时可预注射封堵骨折裂缝处,可采取分次注射原则;(5)术中合理应用C 形臂X 线机进行实时监测骨水泥弥散情况。
3.5 PKP/PVP 治疗OVCF 后伤椎再骨折
本研究中,81例患者在随访期间,共12例患者出现伤椎椎体再骨折,其中试验组出现7例伤椎椎体再骨折,试验组伤椎再骨折发生率为19.44%;对照组出现5例伤椎椎体再骨折,对照组伤椎椎体再骨折发生率11.11%,试验组伤椎再骨折发生率高于对照组(19.44%>11.11%)。分析两组术后伤椎再骨折原因为试验组实施双侧PKP,伤椎椎体经球囊扩张,椎体内骨小梁重新再分布,椎体内骨质不一,椎体内经球囊扩张形成空腔,注入的高黏度PMMA骨水泥后,骨水泥在椎体内聚集,弥散程度不高,骨水泥与周围骨质密度不一,硬度及刚度不等,椎体应力分布不均匀,脊柱生物力学改变,容易在低能量损伤时发生伤椎再骨折;对照组实行双侧PVP,灌注的高黏度骨水泥在低压连贯的注入伤椎椎体内,骨水泥在伤椎椎体内弥散分布较均匀,与周围骨小梁结合紧密,为骨小梁再生创造良好条件,促进伤椎骨折愈合,恢复伤椎椎体高度及后凸Cobb 角,提高伤椎的刚度及强度,从而达到伤椎椎体骨折愈合治疗效果[30]。
3.6 PKP/PVP 治疗OVCF 后邻椎骨折
本研究结果提示试验组术后随访期间共出现9例邻椎椎体新发骨折,邻椎椎体新发骨折发生率为25.00%,对照组术后随访期间共11例出现邻椎椎体新发骨折,邻椎椎体新发骨折率为24.44%,试验组邻椎椎体新发骨折率高于对照组,与国内外其他学者研究结果相符[31],本研究两组邻椎椎体新发骨折率差异无统计学意义(χ2=1.101,df=1,P=0.294>0.05)的原因与纳入研究的样本量不足、术后随访时间较短,属单中心性研究相关。结合本研究结果,分析两组术后出现邻近椎体新发骨折原因有[32]:(1)患者术前术后未规范、长期抗骨质疏松治疗,疾病不断进展的结果;(2)改变了脊柱生物力学机制。试验组实施双侧PKP 术后,伤椎椎体经球囊扩张后,椎体内形成空腔,注入的骨水泥大部分聚集于椎体空腔内,更容易造成伤椎与相邻椎体的刚度与硬度差异更大,脊柱生物力学失衡,相较于对照组的双侧PVP 术,更容易造成上下邻近椎体新发骨折,Liu等[33]研究表明当注入椎体的骨水泥弥散程度不够,分布不均匀时即聚集在椎体下部或靠近终板侧,由于脊柱生物力学失衡,增加邻近椎体新发骨折的风险;(3)同时相关研究表明,椎间隙或椎间盘骨水泥渗漏,将导致明显增加邻近椎间盘的压力及邻近椎体的上终板或下终板的压力,使邻近椎体间力学分布失衡,增加邻近椎体新发的骨折的风险[34]。
PKP/PVP 治疗只是强化了伤椎椎体硬度及刚度,而并未改变患者全身骨质疏松的状况。因此根据患者骨密度和骨代谢指标选择合适的抗骨质疏松药物进行规范的、长期的抗骨质疏松症治疗方案才是治疗的关键。
