雌孕激素在CD34+脐血来源造血干细胞增殖中的作用
2022-04-13姚静欣林雯李莉平
姚静欣,林雯,李莉平
(广州医科大学附属广州市第一人民医院妇产科,广东 广州510180)
造血干细胞(hematopoietic stem cells,HSCs)是造血系统中一群罕见的细胞亚群,被定义为一类具有自我更新能力和分化成所有血细胞能力的前体细胞[1],是所有造血细胞和免疫细胞的来源[2]。HSCs最直接的子细胞是多能祖细胞(multipotent progenitors,MPPs),MPPs 的下游发育分支被进一步定义为仅具有有限谱系分化能力的造血祖细胞(hematopoietic progenitor cells,HPCs)[3],包括普通髓系祖细胞(common myeloid progenitors,CMPs)[4]、巨核细胞-红细胞祖细胞(megakaryocyteerythroid progenitor cells,MEPs)[5]、粒细胞-巨细胞祖细胞(granulocyte-macrophage progenitors,GMPs)和普通淋巴祖细胞(common lymphoid progenitors,CLPs)[6,7]。HSCs 和HPCs 又可被统称为造血干祖细胞(hematopoietic stem and progenitor cells,HSPCs),这些细胞是维持体内造血平衡的关键[8]。
成人HSCs 主要位于骨髓中,其数量在稳态条件下受到严格调节[9]。然而,造血应激状态,如感染、晚期肿瘤、贫血和妊娠等,可诱发髓外造血[10],促进HSCs 的增殖和动员HSCs 至包括脾在内的髓外组织,扩大HSCs 的数量并增加造血功能,以支持血容量的快速扩充[11]。在稳态条件下调节HSCs 功能的机制已被广泛研究,但是对于妊娠期间的造血应激及HSCs 活化的调节机制则知之甚少。
妊娠期间雌激素和孕激素明显上调[12]。雌激素不仅影响包括性器官和大脑在内的组织的干细胞[13],还参与调节造血多能干细胞的增殖分化及其微环境[14]。Nakada 等[15]发现,雌二醇(estrodiol,E2)不仅能够增强HSCs 的自我更新,而且还能促进HSCs 向MEPs 方向进行不对称自我更新。Choi等[16]发现,E2 显著增加HPCs 产生的菌落总数。此外,孕酮(progesterone,P4)也能够促进成人乳腺干细胞的扩增[17]。但雌、孕激素在HSCs 增殖中的作用尚未完全阐明,本研究采用流式细胞术检测正常孕妇和未孕女性外周血中HSCs 占单个核细胞(mononuclear cells,MNCs)的比率及HPCs 不同亚群占MPPs 的比率;采用细胞计数试剂盒(Cell Counting Kit-8,CCK-8)及流式细胞术观察雌、孕激素作用下CD34+脐血来源的HSCs 的增殖情况,旨在探讨雌、孕激素在CD34+脐血来源的HSCs 增殖中的作用。
1 材料与方法
1.1 研究对象
本研究经医院伦理委员会审批,研究对象均签署知情同意书。将2020 年4 月至2021 年3 月我科收治的62 名正常足月孕妇作为实验组,收集26例孕妇外周血及36例孕妇脐静脉血,妊娠孕周均通过早期B 超检查确认,排除妊娠并发症及感染症状,并因社会因素要求剖宫产结束分娩。选取24 名正常未孕成年女性作为对照组,收集外周血。两组临床特征见表1。
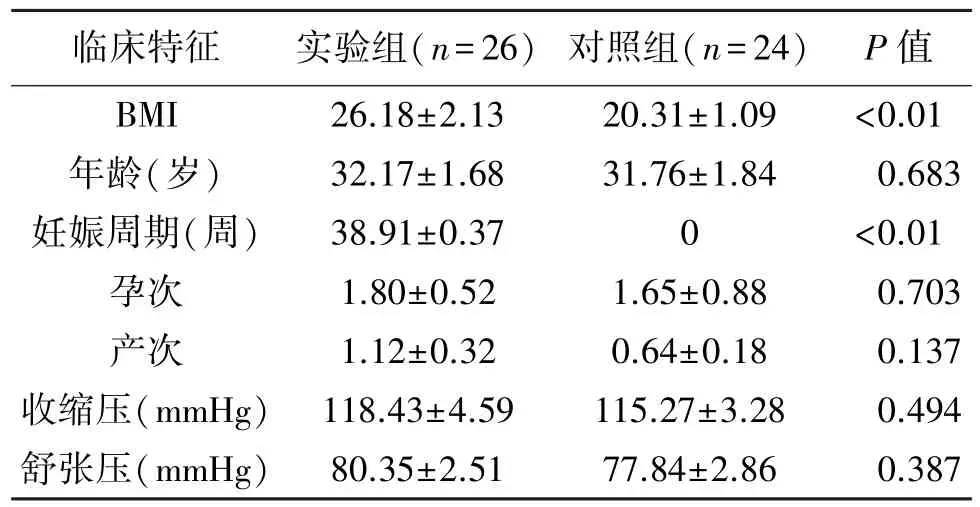
表1 受试女性临床特征
1.2 标本采集及处理
孕妇手术前30 min,一次性真空采血管抽取外周血5 mL。胎儿娩出后,一次性塑料血袋抽取脐静脉血60~100 mL。
1.3 外周血和脐血单个核细胞分离
PBS 将外周血及脐血标本稀释一倍。2∶1 比例加入到人淋巴细胞分离液中,800 g,20℃离心20 min。从云雾状的中间层小心吸取单个核细胞,移入另一离心管,PBS 300 g 离心10 min,洗涤2 次,弃上清。含2%胎牛血清(Thermo Fisher Scientific,Grand Island,USA)的PBS 重悬细胞,计数并调整细胞浓度为1×106/mL。
1.4 脐血CD34+细胞的分选
脐血单个核细胞悬液4℃,300 g 离心10 min,弃上清,重悬并调整细胞浓度为108/100 μL,加入100 μL 封闭液(Miltenyi Biotec,Bergisch Gladbach,Germany),4℃封闭10 min,加入100 μL CD34 磁珠(Miltenyi Biotec,Bergisch Gladbach,Germany),4℃孵育30 min。用 含1% EDTA(Solarbio,Beijing,China)的PBS 洗涤1 次,细胞重悬至3 mL。将LS分离柱固定于磁铁上,PBS 洗涤1 次。将细胞悬液加入LS 柱,使其自然过柱并收集阴选细胞。PBS 洗涤LS 柱3 次后将LS 柱从磁铁上取下,用3 mL RPMI 1640 培养基(Thermo Fisher Scientific,Grand Island,USA)把结合到LS 柱上的细胞吹打出来,计数并调整细胞浓度为1×105/mL。
1.5 脐血干细胞的培养及雌、孕激素刺激
将分选后的CD34+细胞置于24孔或96孔细胞培养板,1×105/mL,加入无血清扩增培养基(Vancouver,Canada)及终浓度分别为10 U/mL 的青霉素(LA,USA)、10 μg/mL的链霉素(LA,USA)、100 ng/mL 的干细胞因子(PeproTech,New Jersey,USA)、100 ng/mL 的FMS 相关酪氨酸激酶3配体(Biolegend,San Diego,USA)以及100 ng/mL的促血小板生成素(Pepro Tech,New Jersey,USA),再分别加入终浓度为50 ng/mL 的E2 (Med Chem Express,New Jersey,USA) 和500 ng/mL 的P4(Med Chem Express,New Jersey,USA)。以不加激素者作为对照组,24 孔板定容1 mL,96 孔板定容100 μL,置37 ℃、5% CO2培养箱中培养,2 d 传代1 次。
1.6 羧基荧光素二乙酸酯琥珀酰亚胺酯(CFSE)染色
调整分选后的细胞浓度为1×107/mL,加入终浓度为5 μmol/L 的CFSE (Biolegend,San Diego,USA),充分混匀,室温下避光放置20 min。以PBS和RPMI 1640分别离心300 g,5 min,洗涤细胞1次,重悬于RPMI 1640,计数并调整细胞浓度为1×105/mL,按上述培养方案于24 孔板中培养48 h 和72 h。FACSCanto II 流式细胞仪(BD Biosciences,San Jose,USA)检测CFSE 含量下降的HSCs 占总细胞群的比率。FlowJo 软件(FlowJo,LLC,Ashland,OR,USA)分析数据,Modfit 软件(ModFit LT,Verity Software House,Topsham,ME,USA)分析增殖指数。每个样品设2个复孔,实验重复12 次。
1.7 CCK-8 检测细胞增殖
培养3、5、7d,每孔添加10μL CCK-8(Meilunbio,Dalian,China),37℃、5% CO2孵育8 h。酶标仪(Eon,BioTeck,CA,USA)450 nm 下测量光密度(optical density,OD)值,参比波长为650 nm,OD 值=A450 值-A650 值。每个样品设3个复孔,实验重复12 次。
1.8 荧光抗体标记和流式细胞术检测及分析
外周血单个核细胞悬液PBS 离心300 g,5 min,洗涤2 次,50 μL PBS 重悬,每管样品加入FITC 标记的抗人Lineage Cocktail、APC 标记的抗人CD34、PE标记的抗人CD38、APC/Cy7标记的抗人CD45RA 及PE/Cy7 标记的抗人CD123 (Biolegend,San Diego,USA)各5 μL,混匀后4℃避光孵育30 min。PBS 洗涤2 次,含2% FBS 的PBS 300 μL 重悬细胞。
细胞培养3、5、7 d,将24 孔板取出,收集各组细胞,PBS 洗涤2 次,50 μL PBS 重悬,每管样品加入FITC 标记的抗人Lineage Cocktail 和APC 标记的抗人CD34 (Biolegend,San Diego,USA)各1 μL,混匀后4℃避光孵育30 min。PBS 洗涤2 次,含2% FBS的PBS 300 μL 重悬细胞。
采用 FACSCanto II 流式细胞仪 (BD Biosciences,San Jose,USA)检测外周血中HSCs(Lin-CD34+细胞)占MNCs的比率,MPPs (Lin-CD34+CD38+细胞)占HSCs的比率,CMPs(Lin-CD34+CD38+CD123+CD45RA-细胞)、MEPs (Lin-Lin-CD34+CD38+CD123-CD45RA-细胞)及GMPs(Lin-CD34+CD38+CD123+CD45RA+细胞)占MPPs的比率,检测Lin-CD34+HSCs 和Lin-细胞的数量。FlowJo 软件(FlowJo,LLC,Ashland,OR,USA)进行数据分析。每个样品设2个复孔,实验重复12 次。
1.9 统计学方法
应用Graphpad Prism 8.4.0 软件(San Diego,USA)进行统计学分析,符合正态分布的计量资料以均数±标准差表示,多组比较采用单因素方差分析,两组比较采用两独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 妊娠女性外周血HSCs 和HPCs 各亚群占比变化
相对于未孕女性,妊娠女性外周血中的HSCs比率增高(P<0.05,图1A-C),MPPs 占HSCs 的比率无明显差异(图1A、B 和D),CMPs 占MPPs 的比率明显降低(P<0.01,图1A、B 和E),而MEPs 及GMPs 占MPPs 的比率显著增高(P<0.01,P<0.05,图1A、B、F 和G)。

图1 外周血HSCs 和HPCs 各亚群占比
2.2 脐血HSCs 的分选结果
脐血中HSCs 占MNCs 的比率为(1.42 ±0.48)%,分选后HSCs 占MNCs 的比率为(95.3±2.76)%,>90%,表明用于后续实验的HSCs 纯度高,适用于进一步进行增殖能力评估(图2)。
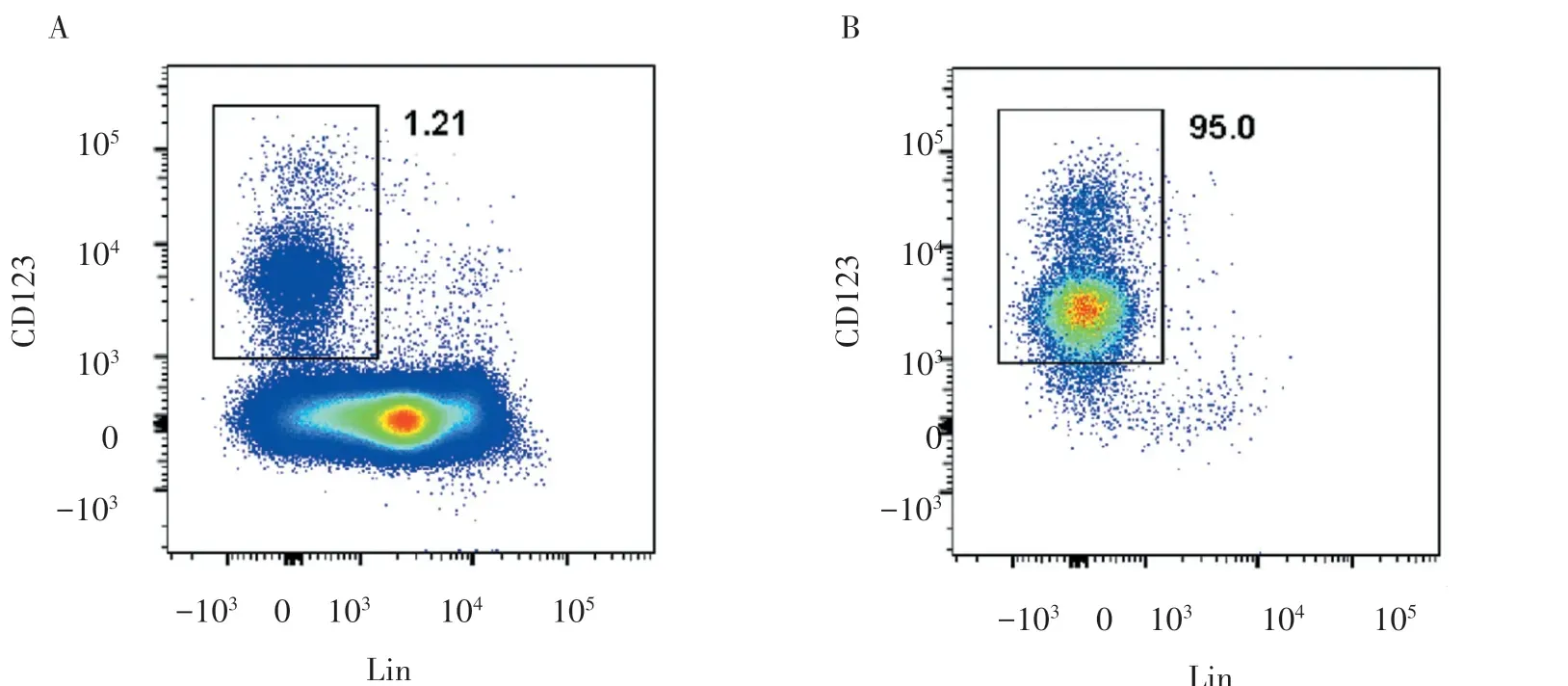
图2 脐血HSCs 占MNCs 的比率
2.3 雌孕激素作用下HSCs 中CFSElow 细胞占比和
相对于未给药组,50 ng/mL E2 作用48、72 h后,HSCs 中CFSElow 细胞占总体细胞的比率均明显增高(P<0.05,P<0.01,图3A-C),HSCs 的增殖指数也均明显增高(P<0.05,P<0.01,图3D);500 ng/mL P4 作用72 h 后,HSCs 中CFSElow 细胞占总体细胞的比率明显增高(P<0.05,图3A-C),HSCs 的增殖指数也明显增高(P<0.01,图3D)。

图3 体外培养过程中HSCs 中CFSElow 细胞占总体细胞的比率和HSCs 的PI
2.4 雌孕激素作用下HSCs 的活细胞数变化
相对于未给药组,50 ng/mL E2 作用5、7 d 后,HSCs 在450 nm 处的OD 值均明显增高(P<0.01,图4A);500 ng/ml P4 作用7 d 后,HSCs 在450 nm 处的OD 值明显增高(P<0.01,图4A)。相对于未给药组,50 ng/ml E2 作用5、7 d 后,HSCs 的活细胞数均明显增高(P<0.01,图4B),Lin-细胞的活细胞数也明显增高(P<0.01,图4C);500 ng/mL P4 作用7 d后,HSCs 活细胞数明显增高(P<0.05,图4B),Lin-细胞活细胞数明显增高(P<0.05,图4C)。

图4 体外培养过程中HSCs 的OD 值和流式细胞术检测所得活细胞数
3 讨论
本研究采用表面抗体标记Lin-CD34+代表HSCs[18],检测HSCs 占PBMCs 的比率,以此探究妊娠对女性HSCs 数量的影响,结果显示,与未孕女性相比,妊娠女性外周血HSCs 占MNCs 的比率明显增加;妊娠期间造血活动明显增强,能促进HSCs 增殖。Nakada 等[15]的研究也表明,与未孕雌鼠相比,孕鼠骨髓和脾脏中HSCs 数量和增殖频率均明显增高;与雄鼠相比,HSCs 在雌鼠骨髓中的分裂频率更高。Ganguly 等[19]发现,雌鼠骨髓及脾脏中HSCs 的比例和数量在妊娠第14 天显著增加,产后则迅速下降。
本研究结果还显示,与未孕女性相比,妊娠女性外周血CMPs 占MPPs 的比率明显降低,而CMPs 下游细胞MEPs 和GMPs 占MPPs 的比率明显增高,这表明女性妊娠期间造血活动明显向红系细胞及髓系细胞分化偏移。Oguro 等[20]发现,与未孕雌鼠相比,孕鼠脾脏中的HSCs、CMPs、GMPs 和MEPs 数量均显著增高,Nakada 等[15]发现,雌鼠中MEPs 的比率较雄鼠明显增高,这些HPCs 亚群数量的增加也侧面印证了HSCs分裂的增加。鉴于MEPs 可能直接来自HSCs 的不对称分裂[21],妊娠期女性MEPs 比例的增加可能反映了女性HSCs 对性激素反应的不对称自我更新增加。
本研究结果表明,与未给药组相比,E2 作用48、72 h 及P4 作用72 h 后,HSCs 中CFSElow 细胞占总体细胞的比率均明显增高,且HSCs 的增殖指数也明显增高。与未给药组相比,E2 作用5、7 d 及P4作用7 d 后,HSCs 的OD 值明显增高,HSCs 和Lin-细胞的活细胞数明显增加。上述结果与CFSE 检测结果略有落差,考虑为CCK-8 和流式细胞术计数与CFSE 检测细胞增殖的角度不同所致,CCK-8 与流式细胞术计数对活细胞数量的检测易受细胞状态影响,而CFSE 对处于增殖状态的细胞比例的检测更为直观。此外,虽然CFSE 结果表明,相对于未给药组,雌、孕激素组处于增殖状态的HSCs 比例明显增加,但从HSCs 增殖的提高到产生HSCs 数量上的明显差异,需要一定的时间,而细胞在增殖的同时也存在衰老与凋亡[22],对活细胞数量产生一定影响,故导致不同检测方法所得结果存在一定差异。
关于雌激素促进HSCs 增殖的作用,Kim 等[23]将从人脐血中富集的CD34+细胞置于E2 作用下培养,第10 天可观察到CD34+细胞显著增加,此外,E2除对脐血来源的HSCs 增殖有促进作用外,还能改善人多能干细胞(human pluripotent stem cells,hPSCs)的造血发育,使hSPCs 比例和数量增高。与本研究不同的是,Nakada 等[15]在对小鼠进行雌激素给药后,虽然观察到小鼠骨髓中HSCs分裂频率明显增高,却并未观察到HSCs 数量明显增加,这可能是因为Nakada 等[15]的检测位置在骨髓,由于HSCs分裂后即有可能被立即动员至循环或其他组织中,无法准确反映HSCs 数量。Qiu 等[24]研究发现,经过卵巢切除术,雌鼠骨髓中HSCs 的数量和功能显著降低。
Nakada 等[15]研究表明,HSCs 高度表达雌激素受体-α(estrogen receptor-α,ERα),并通过5-溴脱氧尿苷掺入的方式验证了E2 可以增加雌鼠骨髓中HSCs 的分裂。Oguro 等[20]也再次验证了E2 处理会诱导小鼠骨髓中HSCs 的分裂,ERα 的另一个配体27-羟基胆固醇可以诱导ERα 依赖性HSCs 的动员。而与之相反的是,Illing 等[25]发现E2 会导致血管壁中的HSCs 数量增加,条件性敲除小鼠中编码ERα的基因ESR1 后在小鼠骨质不增加的情况下,血管壁中HSCs 数量增加,这表明E2 是以自主的方式促进血管壁中HSCs 增殖,而独立于其ERα 依赖的合成代谢骨效应。E2 对于HSCs 的调节机制及不同通路间可能的交互作用仍需要进一步的探索。
大量研究表明,雌激素可能通过不同途径影响造血细胞的分化活性。E2 可以通过激活雌激素受体-β 剂量依赖性促进巨核系细胞的多倍体化和成熟,同时上调促巨核细胞分化基因GATA-1 的表达[26]。在粒细胞-巨噬细胞集落刺激因子存在的条件下,E2 可以通过ERα 介导,促进髓系祖细胞分化出具有朗格汉斯细胞特征的的树突状细胞[27]。雌激素缺乏会导致骨髓中B 细胞祖细胞数量增加[28]。但本研究细胞培养体系为维持HSCs 干性的增殖体系,缺乏诱导HSCs分化的细胞因子,故无法体现E2对HSCs分化的影响,有待进一步细化方案,以探究雌激素在HSCs分化中的作用。
作为另一种重要的性激素,P4 参与女性妊娠和性器官发育成熟。目前对于孕激素的研究仍主要集中于妊娠期间对子宫的维护,如抑制炎症反应[29]、改善子宫胎盘循环[30]、预防和治疗先兆流产等[31]。关于孕激素在造血系统中的作用研究鲜少,本研究结果表明,除E2 外,P4 也具有促HSCs 增殖的作用。
此外,有研究结果显示,P4 通过刺激孕激素受体介导的成骨细胞生长,可促进骨形成过程[32]。这个过程是E2 和P4 之间平衡的结果,E2 能迅速吸收骨骼,而P4 则能缓慢形成骨骼,反之,P4 水平下降会导致骨密度下降。Wu 等[33]研究发现,P4 可通过ERK 1/2 信号通路促进人骨髓间充质干细胞的纤连蛋白合成,以提高造血微环境的支持作用,从而增强造血功能。另一方面,在红系造血活动中,促红细胞生成素(erythropoietin,EPO)是刺激红细胞生成的重要细胞因子[34],Ogawa 等[35]研究发现,P4 而非E2 可以显著提高EPO 的生物活性,并通过促进人羊膜上皮细胞合成EPO 来调节红细胞生成。此外,Joshi 等[17]研究表明,P4 能够促进成人乳腺干细胞和乳腺癌干细胞的扩增。P4 抑制转化生长因子-β自分泌,阻止上皮-间质转化,维持羊膜上皮细胞的再生潜能[36]。以上研究提示,P4 对于不同细胞群生物活性的促进作用是通过调节细胞所在微环境中的细胞因子或与其他因素协同作用产生的。但目前P4 在HSCs 增殖过程中发挥作用的确切机制尚未明确,需要进一步探索P4 介导的造血功能和促进HSCs 增殖的分子机制。
综上所述,女性妊娠期间造血活动明显增强,且明显向红系细胞和髓系细胞分化偏移;雌、孕激素在妊娠期造血活动中具有重要作用,能够促进CD34+脐血来源的HSCs 增殖。
