低T3综合征对维持性血液透析患者的生存预后影响
2022-04-11黄国海许少英李绪城
黄国海,许少英,李绪城
(汕头市中心医院血液净化中心,广东 汕头 515041)
维持性血液透析(maintenance hemodialysis,MHD)患者常合并低T3综合征(low triiodothyronine syndrome,LT3S)[1]。LT3S 会加重MHD患者的营养不良、贫血、微炎症反应等[2-3]。近年来的研究结果显示终末期肾病患者的LT3S患病率高[1-3],但其对MHD患者的生存预后影响尚无统一意见,且鲜有国内研究报道。本研究通过分析汕头市中心医院血液净化中心随访2年的283例MHD患者的临床资料,探讨LT3S对MHD患者生存预后的影响。
1 资料与方法
1.1 一般资料
选择2018年12月在汕头市中心医院血液净化中心接受MHD治疗的终末期肾病患者作为研究对象。纳入标准:(1)符合终末期肾病诊断标准;(2)完善甲状腺功能指标检测。排除标准:(1)年龄<18岁或>90岁;(2)接受MHD治疗时间<1个月或>10年。本研究经汕头市中心医院伦理委员会审查批准,所有患者治疗前均签署知情同意书。
1.2 方法
收集患者年龄、性别、基础病、血管通路、血常规、生化指标、血清铁蛋白、甲状旁腺素、甲状腺激素等临床资料。随访时间设定为2年,截止时间为2020年11月30日,主要研究的终点事件为全因死亡。记录随访期间退出透析患者的具体原因,如肾脏移植、转诊外院治疗等。
甲状腺激素指标正常参考范围分别为:游离三碘甲状腺原氨酸3.8~6.0 pmol/L、游离甲状腺素7.9~14.4 pmol/L、促 甲 状 腺激素 0.38~5.33 μIU/mL。LT3S定义为游离三碘甲状腺原氨酸<3.8 pmol/L,且促甲状腺激素<5.33 μIU/mL;亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)定义为血清促甲状腺激素>5.33 μIU/mL,且游离三碘甲状腺原氨酸及游离甲状腺素在正常范围内;甲状腺功能减退症(甲减)定义为血清促甲状腺激素≥5.33 μIU/mL,且血清游离甲状腺素<7.9 pmol/L。
1.3 统计学方法
应用SPSS 24.0统计软件进行分析。正态分布的计量资料以±s表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数和四分位数间距[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU检验。计数资料以频数和百分率表示,组间比较用χ2检验。采用Kaplan-Meier法计算患者的生存率并绘制生存曲线,Log-rank检验比较组间生存时间差异。采用逐步Cox回归模型分析患者生存预后的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床资料及生存预后
本组研究共纳入283例MHD患者,其中男性167例(59.0%),女性116例(41.0%),平均年龄(55.9±13.2)岁。合并甲状腺功能紊乱者100例(35.3%),其中LT3S 84例(29.7%),SCH 12例(4.2%),甲减4例(1.4%)。截至随访终点,死亡71例(25.1%),仍在我科继续透析治疗的患者193例(68.2%),转诊外院12例(4.2%),接受肾脏移植7例(2.5%)。与死亡组患者比较,存活组患者的平均年龄较小、动静脉内瘘比例较高、血清白蛋白较高、合并糖尿病比例较低、合并LT3S比例较低,差异均有统计学意义(P值均<0.05),见表1。患者1年生存率为88.1%,2年生存率为73.8%,见图1。

表1 生存组与死亡组患者的临床资料比较
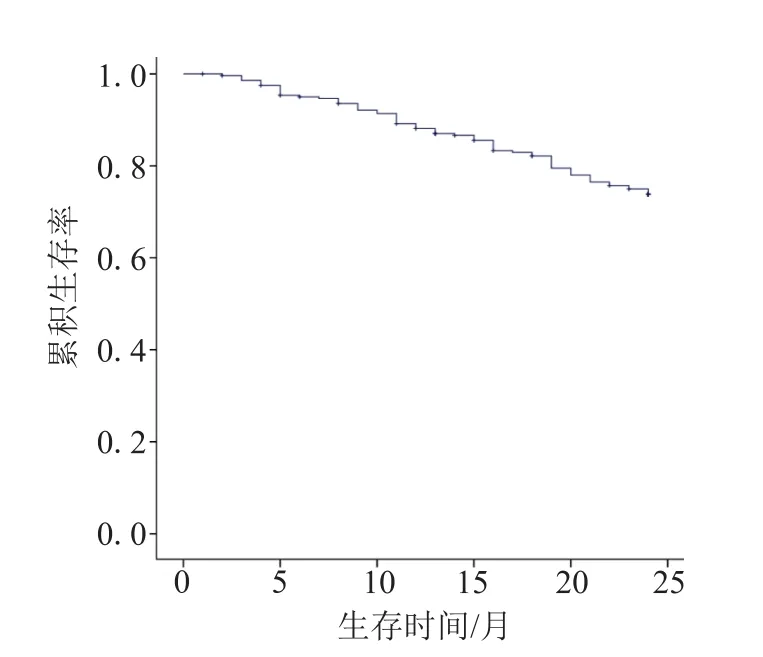
图1 MHD患者生存曲线
2.2 LT3S对患者生存预后的影响
Kaplan-Meier结果显示合并LT3S的MHD患者平均生存时间(19.7±0.8)个月,非合并LT3S患者平均生存时间(21.8±0.4)个月,差异有统计学意义(χ2=8.38,P=0.004),见图2。
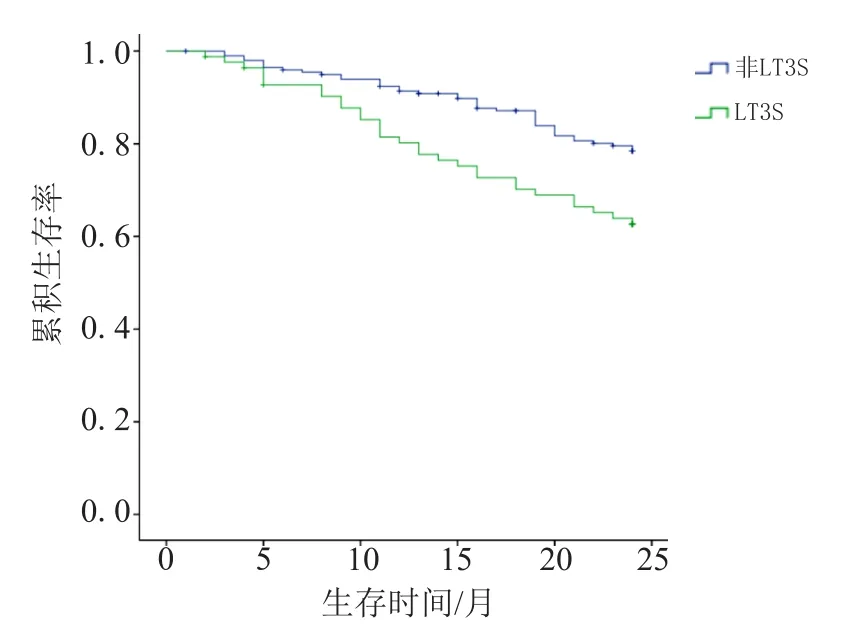
图2 LT3S与非LT3S的MHD患者生存曲线
2.3 患者生存预后的影响因素
逐步Cox回归分析结果显示男性(HR=2.00,95%CI: 1.19~3.38,P=0.009)、 透析龄>1 年(HR=2.62,95%CI:1.47~4.68,P=0.001)、糖尿病 (HR=1.75, 95%CI: 1.07~2.86,P=0.026)、LT3S (HR=1.65,95%CI:1.02~2.65,P=0.041)、血管通路为中心静脉导管(HR=2.45,95%CI:1.35~4.46,P=0.003)、血清白蛋白≤35 g/L(HR=2.91,95%CI:1.70~5.00,P<0.001) 为影响患者生存预后的危险因素,见表2。

表2 Cox回归分析
3 讨论
甲状腺激素水平异常在慢性肾脏疾病患者中非常普遍,其中以LT3S较为常见,其患病率约为20%~50%[1],本研究结果显示MHD患者合并LT3S为29.7%。LT3S对MHD患者的危害尚存争议,以往认为LT3S是机体适应的生理反应,可降低患者代谢水平,减少蛋白和能量耗损,但近年来的研究发现LT3S与心血管事件等有关,且有增加患者的死亡风险[2,4-5]。一项纳入12项临床研究、共14 766例MHD的荟萃分析表明合并LT3S的患者生存预后更差、死亡率更高[4]。关于此类患者的生存分析的临床研究国内鲜有报道,一项纳入121例MHD患者的临床研究结果表明LT3S是国内MHD患者全因死亡的危险因素[5]。就现有的研究证据而言,LT3S并非是一种良性代偿,其在一定程度上影响MHD患者的疾病进展及预后[6-7]。
本组患者1年生存率为88.1%,2年生存率为73.8%。既往研究结果显示MHD患者的生存率与年龄、糖尿病、贫血、低白蛋白血症、钙磷代谢指标、血管通路、甲状腺激素水平等多种因素有关[8-9]。本研究结果显示影响MHD患者生存预后的危险因素包括性别、透析龄、糖尿病、LT3S、血管通路、血清白蛋白,这与临床工作经验基本相符。
目前对MHD合并LT3S进行甲状腺激素替代治疗的必要性仍缺乏可靠的临床证据,长期以来LT3S患者多以原发病治疗为主[10]。既往研究显示非透析的慢性肾脏病患者常合并甲状腺疾病,且与肾功能相关[11]。与无干预的患者相比,接受激素替代治疗致甲状腺激素水平正常的患者死亡率更低[7]。
另外,本组研究患者SCH的患病率为4.2%,国外研究报道结果显示MHD患者的SCH患病率为10.5%~12.9%,且与患者全因死亡率相关[12]。由于本组研究对象合并SCH的病例较少,未发现其对患者生存预后有影响。此外甲减的患病率为1.4%,低于既往报道的12.4%[5],且所有确诊甲减患者均已接受甲状腺激素替代治疗,迄今仍在我科接受透析治疗,目前一般状况良好。就目前现有的研究证据而言,MHD患者合并LT3S尚无明确的激素替代治疗指证,但部分患者可能会因此获益。对患者进行精准的分层诊疗是目前医学发展的趋势,如何选择治疗对象、药物的用法、以及激素水平的监测等仍需进一步探讨。
综上所述,MHD患者常合并甲状腺激素紊乱,其中多以LT3S为主,其可作为影响患者生存预后的独立危险因素。但此类患者应如何进一步干预及监测尚需进一步地研究和探讨。
