电子垃圾拆解区儿童血浆脂氧素A4水平的检测分析
2022-04-11杨江夏卢雪玲陈梓涵徐锡金
杨江夏,霍 霞,卢雪玲,罗 琼,陈梓涵,徐锡金,3
(1.汕头大学医学院环境医学与发育毒理学实验室,广东 汕头 515041;2.暨南大学环境学院,广东 广州 510632;3.汕头大学医学院细胞生物学与遗传学教研室,广东 汕头 515041)
脂氧素A4是通过跨细胞途径,经不同脂氧合酶按顺序催化花生四烯酸而形成的一种内源性抗炎介质[1]。脂氧素A4通过与其受体结合传递炎症消退信号,即促进炎性细胞如外周血中性粒细胞的凋亡与清除,刺激单核细胞的非炎症性趋化,增强吞噬细胞的吞噬活性,促进机体内环境稳态的恢复[2]。血浆脂氧素A4的表达水平受体内炎症状态的影响,其变化是多种炎症相关疾病发展的关键机制[3]。本实验室研究发现,生活在电子垃圾拆解区的儿童体内多种环境化学污染物水平均高于参照组,如重金属[4]、多环芳烃[5]等,且化学污染物暴露刺激儿童外周血中性粒细胞、淋巴细胞等炎性细胞和IL-1β、IL-6和TNF-α等促炎细胞因子以及促炎介质白三烯B4水平的增加[4,6]。这些促炎介质的升高,可能激活体内抗炎通路,启动体内多种细胞和促炎症消退介质共同参与的抗炎程序。因此,本研究通过分析电子垃圾拆解区儿童血浆脂氧素A4水平的变化特点,探讨环境化学污染物暴露对儿童免疫系统抗炎能力的影响。
1 资料与方法
1.1 研究对象
2018年11—12月,招募196名4~7岁儿童,平均年龄(5.43±0.64)岁。汕头市贵屿镇(电子垃圾拆解区)儿童作为暴露组,其中男53名,女45名;汕头市濠江区(无电子垃圾拆解活动和污染的区域)儿童作为参照组,其中男55名,女43名。所有参与儿童样本采集前1个月内无外伤或感染性疾病。本研究经汕头大学医学院伦理委员会审查通过,所有参与研究的儿童家长均签署知情同意书。
1.2 样本采集和血浆脂氧素A4的检测
由护士用EDTA抗凝管采集儿童空腹肘静脉血2管,其中一管以1 500 r/min离心5 min,分离血浆,分装后置-80℃冰箱保存;另一管运送至检验室使用Sysmex XE-2100全自动血液分析仪(日本Sysmex公司)分析外周血细胞计数。血浆脂氧素A4的检测:将100 μL完全解冻的血浆分装样本加入甲醇混合液(200 μL甲醇混合1.5 mL超纯水),用1 mol/L的盐酸将混合液pH酸化至3.5,得到样本处理液。用2 mL甲醇和2 mL超纯水预处理Sep-Pak C18 Plus Light滤芯(美国Waters公司);将上述样本处理液加入滤芯,然后用5 mL超纯水和5 mL正己烷先后冲洗该滤芯,用2 mL甲酸甲酯洗脱出脂氧素A4,氮气流挥发甲酸甲酯,将残留物溶解于1 mL稀释过的提取物缓冲液中。采用酶联免疫吸附试剂盒(美国Neogen公司)和Infinite M200 Pro光栅型多功能酶标仪(瑞士Tecan公司)检测提取物缓冲液中的血浆脂氧素A4。样本前处理、检测流程、结果测定和计算严格按照试剂盒的说明进行。
1.3 统计学分析
使用SPSS 24.0统计软件进行分析。经正态性检验后,正态分布的计量数据采用±s,组间比较采用独立样本t检验;偏态分布的的计量数据以M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验。采用GraphPad Prism 8软件进行作图。当P<0.05时认为差异具有统计学意义。
2 结果
暴露组儿童血浆脂氧素A4水平[89.58(68.08,111.87)pg/mL]高于参照组儿童[80.04(61.05,97.30)pg/mL](P<0.05),见图1A。年龄分层分析发现,暴露组4岁~年龄段儿童血浆脂氧素A4水平[87.76(69.30,111.77)pg/mL]高于参照组4岁~年龄段儿童[67.49(55.05,84.91)pg/mL](P<0.05),见图1B。血细胞计数分析发现,暴露组儿童外周血单核细胞计数高于参照组儿童(P<0.01),见表1。
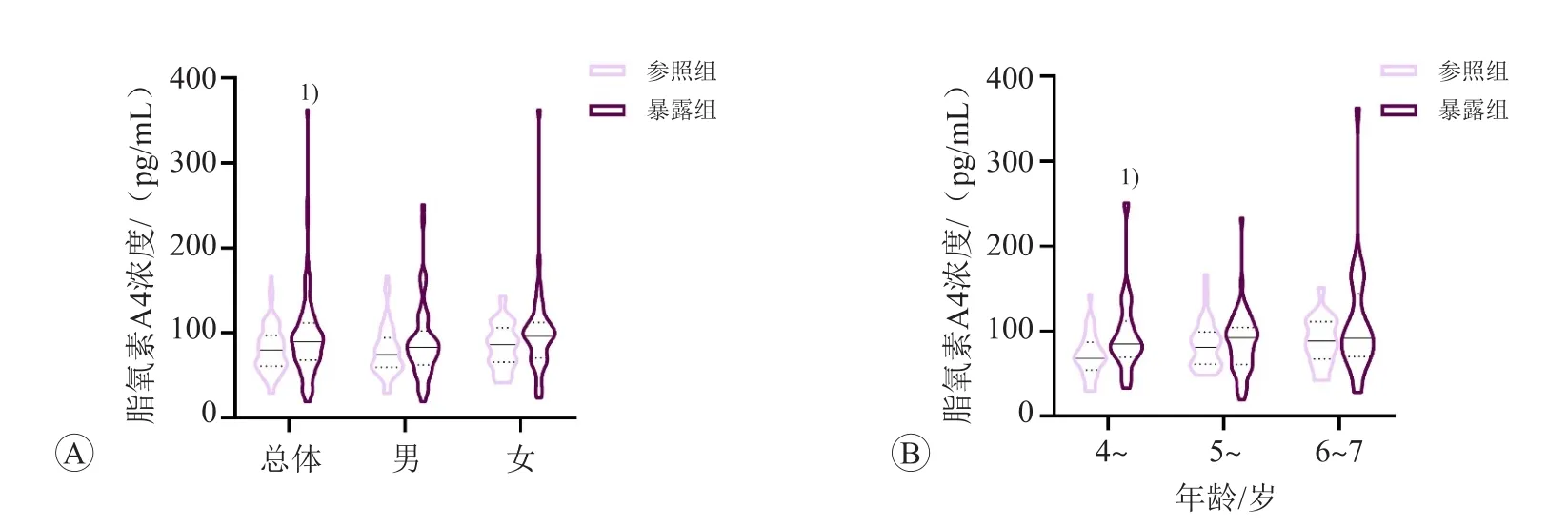
图1 参照组和暴露组儿童血浆脂氧素A4水平比较
表1 两组儿童外周血炎性细胞计数比较(×109/L,±s,n=98)

表1 两组儿童外周血炎性细胞计数比较(×109/L,±s,n=98)
1)与参照组相比,P<0.01。
组别参照组暴露组白细胞6.84±1.82 7.10±1.53中性粒细胞3.24±1.52 3.36±1.31单核细胞0.37±0.12 0.45±0.151)
3 讨论
炎症是机体对有害刺激的免疫防御机制的一部分。炎症的及时消退能有效防止炎症慢性化和进一步对机体造成的损伤。研究认为,炎症消退是一个依赖炎性渗出液中炎症介质改变的主动和程序化进程[7]。在炎症过程中,炎性刺激物诱导中性粒细胞快速响应,内流进入炎症发生部位,产生前列腺素、白三烯等炎性介质,启动并放大炎症信号;同时,前列腺素激活中性粒细胞中15-脂氧合酶的转录,促进抗炎介质(如脂氧素A4)的表达,启动抗炎信号[8-9]。脂氧素A4与脂氧素受体结合激活各种激酶,调控NF-κB等炎症信号通路,抑制中性粒细胞的聚集和化学趋化、炎性细胞因子(IL-6、IL-8等)的表达,并通过刺激单核细胞的非炎症性趋化和黏附、增强吞噬细胞活性等发挥抗炎作用[10]。脂氧素水平的变化可能与疾病发生发展相关。研究显示,与健康人群相比,非重症哮喘患者脂氧素A4水平升高;但与非重症哮喘患者相比,重症哮喘患者脂氧素A4及其受体的基因和蛋白表达降低,脂氧素A4的合成障碍会导致慢性炎症和典型的气道高反应性,引起病情进一步恶化[11]。因此,脂氧素A4水平变化与机体免疫系统抗炎能力的改变有着密切联系。
汕头市贵屿镇是一个有40多年电子垃圾处理历史的地区。由于露天焚烧、酸洗等不规范电子垃圾拆解回收操作产生的环境污染物经空气、废水、尘土传播,使该区域受到大量重金属[12]、多环芳烃[13-14]等有害化学污染物的严重污染。根据本实验室的研究,2018年招募的长期居住在贵屿镇的儿童体内相比于参照组有更高浓度的多环芳烃[5]、铅[6]等环境化学污染物,且本实验室前期研究均显示,环境化学污染物刺激儿童外周血包括中性粒细胞、血小板、IL-6在内多种炎症介质的升高[15],表明这些儿童长期处于低度炎症的状态[16]。本研究结果显示暴露组儿童血浆中脂氧素A4水平升高,表明电子垃圾拆解区的多种环境污染物刺激儿童免疫系统,诱发炎症反应,同时启动机体的抗炎保护机制,增加抗炎因子脂氧素A4的产生,促进了炎症的消退。暴露组4岁~年龄段儿童血浆脂氧素A4比参照组高,这与低年龄组更容易受到外界有害因素的干扰、刺激炎症与抗炎反应的发生有关,且随着年龄的增长,儿童认知能力的提高与手口习惯的改变减少了污染物暴露的机会。此外,本实验室的前期研究发现,暴露组儿童外周血中性粒细胞计数显著高于参照组儿童[17],而本研究显示暴露组儿童外周血单核细胞计数显著高于参照组,反映了脂氧素A4能够减少中性粒细胞浸润并且刺激单核细胞非炎症性趋化而促进炎症消退的生理作用,提示环境污染物的长时间暴露刺激儿童免疫抗炎的积极应答。
综上所述,在电子垃圾拆解区的环境化学污染物暴露下,儿童机体内发生炎症反应,并启动自身抗炎机制,使机体维持内环境稳态。但长期持续的污染物暴露,使机体一直处于炎症与抗炎的对抗状态,超负荷消耗儿童免疫系统的抗炎介质,不利于儿童的健康生长。因此,本研究为进一步探讨长期环境化学污染物暴露对体内免疫抗炎能力的影响提供了基础。
