数据完整性计算机化在药品研发中的应用实例
2022-04-11颜雁周晓娜刘岭
颜雁 周晓娜 刘岭


关键词:药品研发;计算机化系统;数据完整性;管理应用
【中图分类号】 F224-39 【文献标识码】 A 【文章编号】2107-2306(2022)06--02
药品研发计算机化系统由一系列硬件和软件组成,以满足特定的功能。实现数据完整性计算机化系统管理是药品的法规要求,涉及药品研发、检验、生产、仓储过程中的计算机化系统均应满足数据完整性的要求,对计算机化系统整个生命周期进行管控,采取有效的措施最大程度的降低系统风险,以保证其提供数据的准确性、可靠性。
对于数据完整性计算机化系统管理,目前国内外均有明确的法规要求,但没有关于如何落实数据完整性计算机化系统的实例指导,尤其是药品的研发单位,国家对其数据完整性管控程度要求提高,并落入国家《药品注册管理办法》、《药品生产质量管理规范(2010年修订)》及其附录10计算机化系统等法规要求。因此,建立一套完整的数据完整性计算机化应用尤为重要。本文重点研究了以数据完整性计算机化系统在药品研发单位的推进落实案例,从计算机化系统的建立验证、形成实例指导,为药品相关行业数据完整性计算机化系统管理法规要求的落实提供参考。
1调查评估部分
1.1法规符合性回顾
首先对药品研发计算机化系统管理的法规符合性进行回顾,查阅并收集国内外关于数据完整性计算机化系统的法规,并确认为现行有效。
1.2仪器设备分类评估
将仪器设备的硬件和软件分类进行评估。
1.2.1仪器设备硬件方面的分类评估[1]
对于仪器设备的硬件方面,按照USP 1058将仪器设备分为A类、B类、C类,并采用相应级别的维保、计量、验证等管理方式管理,硬件分类标准如下:
A类:包括没有测量能力或通常的校准要求的标准设备,其中制造商对基本功能的标准被接受为用户需求。A类设备与用户需求的符合性可以通过肉眼观察其操作来确认,此类设备不进行验证和确认。
B类:包括提供测量所得数值的标准设备和仪器,以及控制需要校准的物理参数(例如温度、压力、或流动)的设备,其中用户需求通常与制造商的功能标准和操作限度相同。B类仪器或设备对用户需求的符合性是按照该仪器或设备的标准操作程序来测定的,此类设备只进行安装运行确认。
C类:包括仪器和计算机化系统,其中对功能、操作、性能限度的用户需求针对特定的分析用途。C类仪器对用户需求的符合性通过具体的功能测试和性能测试来测定。此类设备要进行安装、运行、性能确认。
依据USP 1058及仪器设备的使用用途,对仪器设备分类进行回顾评估确认,具体评估确认表,部分仪器见表1 仪器设备分类评估表。
1.2.2仪器设备软件方面的分类评估[2]
对于仪器设备的软件方面,计算机化系统软件结合实际用途,按照GAMP 5分为基础软件、不可配置软件、可配置软件、定制软件共4类,分类标准如下:
基础设施软件:如电脑windows系统。
不可配置软件:如仪器仪表自带软件。
可配置软件:如Chromeleon等。部分软件见表2 可配置软件分类评估表。
定制软件:如企业内部或外部开发的应用程序等。
2搭建实施部分[3-12]
2.1数据完整性计算机化系统搭建
结合行业的工作经验、公司研发条件作出项目差距分析,建立、详化一套完整的、适用于本公司体系运行的计算机化系统管理文件与记录。
2.1.1计算机化系统管理
起草计算机化系统管理规程,规定数据完整性计算机化管理的原则性规定,本规程作为计算机化管理的纲领性文件。规定计算机化系统的定义、分类、供应商管理、URS、验证管理、运行和维护、数据管理、备份与恢复、灾难恢复管理、系统回顾、系统退役等。
2.1.2机房与服务器的管理[13-17]
根据GB 50174-2017数据中心设计规范等要求,结合机房的组成、服务器的不同类型,规定了机房的维护管理。机房管理人员定期检查机房内环境(25±10℃,8%~80%)、防鼠设施,定期维护机房基础设施(如,机柜线路的整理、标签检查更换、服务器除尘及相关配套)、服务器、空调、USP及电池、消防设施。尤其是服务器需要重点维护,服务器的管理可采用远程桌面和服务器直接登录的形式,定期检查服务器的状态(CRU使用率、存储使用率等,超过80%时,进行维护)、日志检查、服务器硬件指示灯、网络防火墙等。
2.1.3用户需求规范(URS)的起草规范性
URS进行编号管理;对起草内容的要求进行详细规定,要求写明目的、URS概述、对于一些规范中涉及的专业术语进行解释说明、制定人员、URS的内容进行分类描述(总需求、硬件、软件、功能、环境、公共设施、审计跟踪、电子签名、报表、安全、系统集成/交互、EHS、交付文件、培训、可用性/可靠性/可维护性、其他等的需求);对URS的审批、变更作详细要求。
2.1.4计算机化系统供应商的管理
建立计算机化系统相关仪器设备合格供应商名单,对新增的供应商进行资质评估,定期进行审计,发起新采购申请时可采用资料审计、访问或面谈(必要时,调查问卷)的审计方式,对其资料完整性、产品适用性、供货及时性进行审计,全面的了解供应商的质量管理体系、人员资质、产品开发、生命周期的管理、售后服务等情况;每年对其资料进行审计。
2.1.5新增仪器设备操作指导
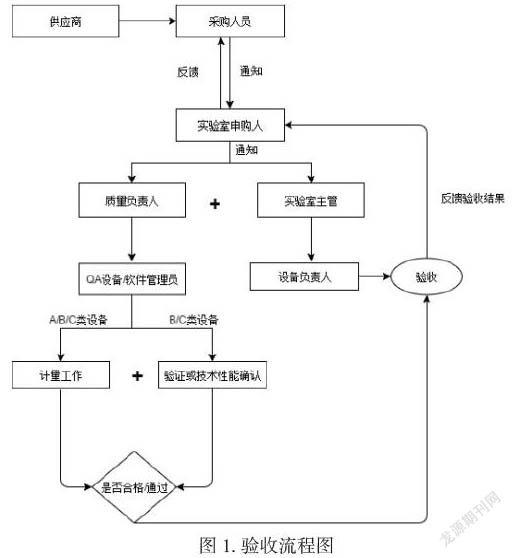
对于预购设备或仪器,建立流程进行指导操作,具体详见图1。
计算机化系统的验证包括不限于:仪器设备,ERP系统, EXCEL计算表格等。需对其进行首次验证、定期再验证(一般验证周期为2年)、计算机系统硬件或者软件配制的改变时,进行的验证,并监督其验证状态的持续性。
2.1.7计算机化系统的运行和维护
在计算机化系统的生命周期内,按照相应仪器设备的操作和维护保养要求进行日常操作和维护,过程中计算机化系统的变更应按照变更的要求进行。
明确所有使用和管理计算机化系统人员的职责和权限,保证计算机化系统生命周期中所涉及的各项活动,如验证、使用、维护、管理等符合法规要求,实行三级基础权限的管理。规范GMP相关的计算机化系统用户账号的管理要求,包括账号的创建(培训授权)、注销、变更等。规范GMP相关的计算机化系统的密码策略和原则,独立账号、密码的设置策略、密码修改周期、密码的尝试次数等。
2.1.8数据的管理
2.1.8.1电子数据的管理
对电子数据的处理流程及要求、存储规则进行规范。同时对于归档的电子数据、备份数据的有效期等均进行相关规定。
2.1.8.2计算机化系统备份与恢复
规范计算机化系统备份与恢复流程,有序有效的开展备份、恢复工作,明确各部门的职责,防止因硬件故障、意外断电、病毒等因素造成数据的丢失,保障实验室正常的数据保存,规范系统数据备份与恢复,保证数据的完整性。
备份数据进行分为六级管理:第一级:非电子系统,GXP数据不存储、手工记录为原始数据;第二类:电子系统,显示但是不存储GXP数据,员工目视然后再记录;第三类:电子系统,显示但是不存储GXP数据,可打印;第四类:电子系统,显示但是不存储GXP数据或不长久存储数据,可以传输至其他系统进行存储的;第五类:电子系统,永久存储GXP静态数据;第六类:电子系统,永久存储GXP动态数据。第一至三级不需备份,第四、五级需备份静态数据以及应用软件(如需要),第六级,必须备份元数据及应用系统软件。
备份数据有效性确认需定期进行,规定每季度进行恢复操作需要一次。恢复过程需要由数据拥有部门主管指派负责人主导,IT和质量人员参与。恢复操作完成后负责人对恢复结果进行确认,确认恢复后的版本为指定的版本。
2.1.9 EXCEL计算表格管理
规范EXCEL计算表格的建立、保存、使用、变更流程;EXCEL计算表格需要编号管理,建立版本号,对其权限进行明确要求,如使用人员不能修改EXCEL计算表格的内容;QA保管密码。同时对页面、锁定、验证内容进行要求,页面中规定页眉、页脚、正文的内容;锁定的范围进行明确;验证应有安装验证、运行验证、性能验证。
2.1.10计算机化系统时间调整
为确保所有时间的一致性、准确性和可靠性,规范时间一致性原则。采用北京东八时区的区时作为标准时间,即北京时间(www.beijing-time.org)。根据实验室基于计时器用途、种类制定同步管理要求;为确保实验室所有操作时间有逻辑性,评估实验室2个连续操作之间时间的差距,可接受偏离为5分钟;为确保计算机化系统时间的安全,对计算机化系统时间进行专人管理。
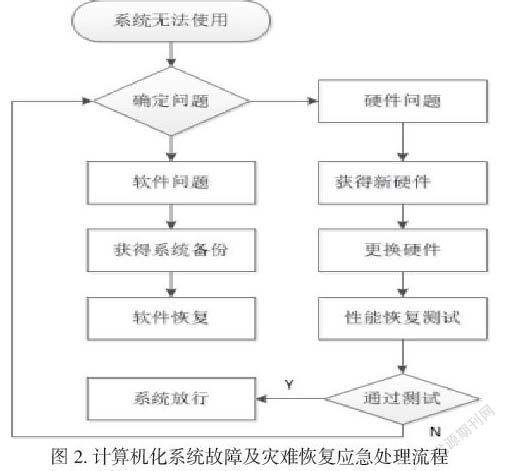
2.1.11计算机化系统故障及灾难恢复应急计划操作
根据计算机化系统应急事件,影响信息系统安全的突发事件不同与计算机系统故障等级划分,将计算机化系统故障进行分类。按照如图2计算机化系统故障及灾难恢复应急处理流程进行:
通过测试验证考察实施效果,并形成具体的管理程序和操作规程;将规定后文件进行培训执行。后期将根据实际执行效果、客户与官方检查、计算机化系统回顾,不断优化体系,确保数据真实、可靠,满足法规要求。
3结论
本项目的开展,从计算机化供应商的筛选、URS的需求、新购仪器的验收及验证、日常的运行与维护、数据的管理、备份与恢复、灾难应急处理等,对整个计算机化的生命周期进行管控,建立了一套完整的数据完整性计算机化应用。经目前开展的效果表明,有望用于指导药品相关行业对数据完整性计算机化系统管理法规的快速落实。
参考文献:
[1]<1058>ANALYTICAL INSTRUMENT QUALIFICATION 分析仪器的确认[S]
[2]良好自动化生产实践指南第五版中文版本(简称:GAMP 5) [S]
[3]药品生产质量管理规范(2010年修订)与附录:计算机化系统[S]
[4]《药品记录与数据管理要求》(试行) (2020年7月) [S]
[5]美国联邦法规第21篇,211部分:现行成品药生产质量管理规范[S]
[6]美国联邦法规第21篇,第11部分:电子记录和电子签名[S]
[7]欧盟药品控制条例第四卷:药品生产质量管理规范(2011年)[S]
[8]欧盟GMP附录11:计算机化系统[S]
[9]MHRA:制药行业GMP数据可靠性定义及指南[S]
[10]WHO:良好数据与记录管理规范指南[S]
[11]PIC/S:良好数据可靠性管理规范[S]
[12] CNAS-CL01:2018,中国合格评定国家认可委员会(CNAS),检测和校准实验室能力认可准则 [S]
[13] GB 50174-2017,数据中心设计规范[S]
[14] ISO9001-2015,计算机数据机房管理规范[S]
[15] GB/T 21028-2007 ,信息安全技术服务器安全技术要求[S]
[16] GB/T 22239-2008 ,信息安全技术信息系统安全等级保护基本要求[S]
[17] GB/T 22240-2008, 信息安全技术信息系统安全等级保护定级指南要求[S]
颜雁(1988.11-),女(汉族),本科,胶州市,青岛科创质量检测有限公司,职称:中级职称;研究方向:药品质量。
