盐胁迫对两种甘草幼苗生物量及光合荧光特性的影响
2022-04-08刘萱,王芸
刘 萱,王 芸
(1.河南广播电视大学农医学院,河南 郑州 450008;2.西北农林科技大学林学院,陕西 杨凌 712100)
土壤盐碱化是农业高质量发展的巨大威胁[1],特别是在干旱半干旱农业种植区域,更是对作物生产造成了一定影响,培育和引进耐盐碱的优良植物材料是绿色农业可持续发展的迫切需要[2-3]。光合作用是植物生长进程中最重要的生理生化过程,光合系统能否运转正常对作物产量的形成至关重要[4-5]。有学者通过研究证实,作物耐盐性的高低会影响光合作用的强弱,进而影响植株的正常生理功能,最终影响作物产量[6-10]。因此,研究药用植物的光合特性,对于阐明甘草耐盐碱机制,促进盐碱地的高效利具有十分重要的意义。
叶绿素的含量可以反映光合作用对盐分胁迫的响应,光合荧光参数的变化能对植物光合潜能进行准确表征[11-12]。孙文君等[13]研究表明,棉花在盐浓度为50 ~100 mmol·L-1范围内能够避免光反应系统受到损伤,而当盐浓度达到150 mmol·L-1时,叶片的光能利用效率显著降低,最终导致植物生长受到抑制。王宝强等[14]研究表明,碱性盐比例及胁迫时间对藜麦幼苗叶片光合系统及抗氧化系统有不利影响,但均衡离子比例的协同效应可以改善藜麦幼苗的盐碱耐受性。巩志勇等[15]研究表明,盐碱混合胁迫显著抑制了香椿幼苗叶片光合作用,但香椿可以通过调控抗氧化系统和渗透调节物质来适应盐碱胁迫环境,从而具备一定的耐盐碱能力。温赛群等[16]研究表明,盐胁迫下花生品种抗盐耐逆的主要生理响应特征是提高光补偿点和最大净光合速率,增强叶片持水能力和物质代谢能力,提升抗氧化和渗透调节能力。可见,植物的耐盐性涉及多种耐盐机制的协调作用。甘草(Glycyrrhiza uralensis Fisch.)是一种多年生草本中药材植物,因其具有抗盐碱和抗旱等特性,是中国“三北”干旱盐碱地区重要的植物资源之一[17-18]。甘草是大宗的药用植物,但目前对于不同甘草耐盐机理的报道相对较少。为此,本研究通过对不同盐胁迫浓度下甘草幼苗光合荧光特性方面的差异进行了初步研究,探讨了盐胁迫对甘草幼苗生物量和光合作用的影响,为甘草在盐碱地的抗逆栽培提供科学参考。
1 材料与方法
1.1 试验设计
试验于2020 年6 月开始,在西北农林科技大学农科实训基地玻璃温室中进行。供试品种为西北干旱区域大面积栽培的胀果甘草和光果甘草,试验首先采用花盆(高25 cm,上口直径为25 cm,下底直径为15 cm)对穴盘育苗的甘草幼苗进行栽培(基质配比以珍珠岩∶草木灰∶蛭石=3∶2∶5 进行混合),待甘草幼苗发育到3 片叶时,筛选长势基本相同的幼苗进行不同浓度盐(NaCl)胁迫处理试验。设置5 组盐胁迫浓度,分别为0、50、100、150 和200 mmol·L-1, 用S0、S1、S2、S3 和S4 来 代 表, 以Hoagland 全营养液作为对照(CK),每个处理重复4 次,每个品种试验共需要20 株甘草幼苗。待处理时间达到30 d 时取样,并立即在实验室进行鲜样指标的测定,以减少试验误差,确保试验数据的准确性。同时进行其他光合生理指标的测定。
1.2 测定项目与方法
1.2.1 生物量
将甘草植株取样后,使用去离子水冲洗干净,并用剪刀分成根、茎、叶3 部分,将烘箱温度设置为105 ℃,放入样品杀青 30 min;接着将温度调至85 ℃,烘干至恒重,用天平测定干物质量。
1.2.2 叶绿素相对含量(SPAD 值)
采用SPAD-plus 手持叶绿素仪,对每个处理测定SPAD 值,测定部位是倒数第二片叶,重复5次,取均值代表叶片SPAD 值。
1.2.3 荧光参数和光合指标测定采用叶绿素荧光仪OS5p+,测定每个处理植株的倒数第2 片叶,获取基础荧光等参数指标,3 次重复;采用Li-6400XT 便携式光合仪,测定每个处理植株的倒数第2 片叶,获取净光合速率等参数指标,3 次重复。
1.3 数据分析
采用Excel 2010 进行数据处理和图形绘制,采用SPSS 24.0 进行数据方差分析,并利用Duncan 法进行多重比较(P<0.05),使用R 软件进行相关性分析和驱动力分析。
2 结果与分析
2.1 盐胁迫对甘草幼苗生物量及SPAD 值的影响
由表1 可知,不同盐浓度处理下,S2 较S0 处理显著抑制胀果甘草幼苗叶片的SPAD 值,降低幅度 达24.13%,而S2、S3 与S4 处 理 间SPAD 值 无显著性差异;盐胁迫对光果甘草SPAD 值无显著影响。S1 胁迫处理显著抑制了胀果甘草根、茎、叶和总生物量,较CK 处理分别降低15.71%、35.59%、11.77%和18.33%,以S4 处理的生物量最低。与CK 处理相比,S2 处理对光果甘草地上部各器官生物量的积累有显著降低趋势,茎、叶和总生物量分别降低29.73%、27.41%和24.85%,生物量最低的为S3 处理。S1 处理降低根生物量13.54%,与CK处理相比降低显著,对光果甘草其他器官生物量及总生物量的影响不显著。与CK 处理相比,S2、S3、S4 处理显著增加胀果甘草幼苗的根冠比,增加幅度为18.75%~31.25%,S2 与S3 和S4 处理间差异性不显著。S4 处理对光果甘草根冠比促进作用显著,增加比例达28.00%,而其他处理间无显著性差异。
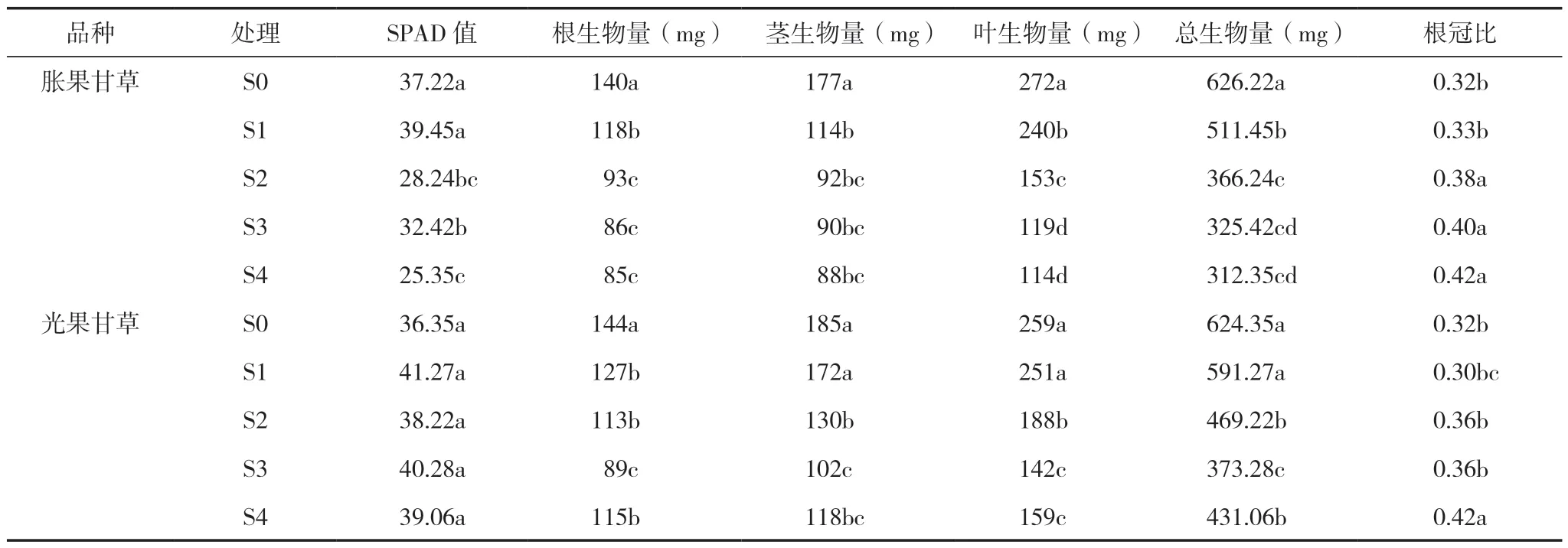
表1 盐胁迫下甘草幼苗生长指标变化
2.2 盐胁迫对甘草幼苗光合特性的影响
如图1 所示,与S0 处理相比,胀果甘草盐胁迫处理的净光合速率(Pn)降低幅度为17.40%~28.98%;气孔导度(Gs)降低幅度为23.58%~87.88%,其中S2 处理降低幅度最为突出,较S0 降低87.88%;蒸腾速率(Tr)降低幅度为29.97%~81.47%,其中S2 处理降低幅度最为突出,较S0 降低81.47%;胞间CO2浓度(Ci)以S2 处理为最低值。S2 处理的Pn、Gs、Tr 与S3、S4处理无显著性差异。光果甘草盐胁迫处理的Pn 较S0 处理降低幅度为14.62%~44.85%,而S1 与S2处理无显著性差异,与S3、S4 处理差异不显著。S3 处理Ci 达最低值,较S0 处理相比降低20.92%。S1 处 理 的Gs 较S0 相 比 下 降34.62%,Tr 较S0 相比下降26.42%,且与S3 和S4 处理的Gs、Tr 均呈显著性差异。
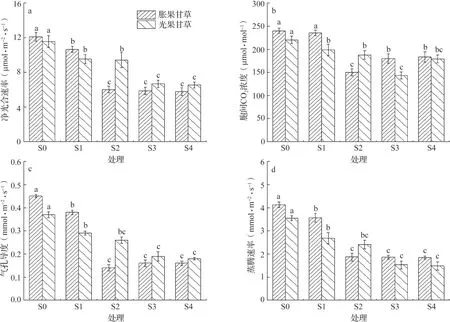
图1 盐胁迫对甘草幼苗叶片光合特性的影响
2.3 盐胁迫对甘草幼苗叶绿素荧光特性的影响
如表2 所示,盐胁迫显著抑制甘草荧光特性。胀果甘草盐胁迫处理的光系统Ⅱ活性(Fv/Fo 值)较S0 处理显著降低8.79%~18.29%,S1、S2 处理的潜在最大光能转换效率(Fv/Fm 值)与S0 相比无显著性差异,而与S3、S4 呈显著性差异,S3、S4 较S0分别下降8.54%、10.98%。光果甘草在盐胁迫处理下的Fv/Fo 值和Fv/Fm 值均无明显变化,与S0 无显著性差异。与S0 处理相比,S1 ~S3 处理的电子传递速率(ETR)无明显变化,而S4 处理显著降低两个甘草幼苗ETR,其中胀果甘草下降14.90%,光果甘草下降7.90%。胀果甘草S1 处理的实际光能转换效率(ΦPS Ⅱ)、光化学猝灭系统(qP)和非光化学猝灭系数(NPQ)与S0 处理的差异不显著,在S2、S3 和S4处理下,叶片FPSII 和qP 随着盐浓度的增大而下降,而NPQ 则显著上升。与S0 处理相比较,光果甘草S4处理的FPSII、qP 显著降低23.53%、14.29%,而盐胁迫对NPQ 无明显影响。
2.4 盐胁迫下甘草幼苗生物量与光合参数相关性分析
由表3 可知,甘草幼苗总生物量与Pn、Tr、SPAD 值、Ci 和Cs 均呈显著正相关关系,其中对Pn 和Tr 的影响最大,其相关性系数分别达0.98、0.97;根冠比与Pn、SPAD 值、Tr 和Cs 均呈显著的负相关关系,也是对Pn 的影响最大,其相关系数可达0.83;Tr 与Pn、Cs、SPAD 值、Ci 均呈显著正相关关系。
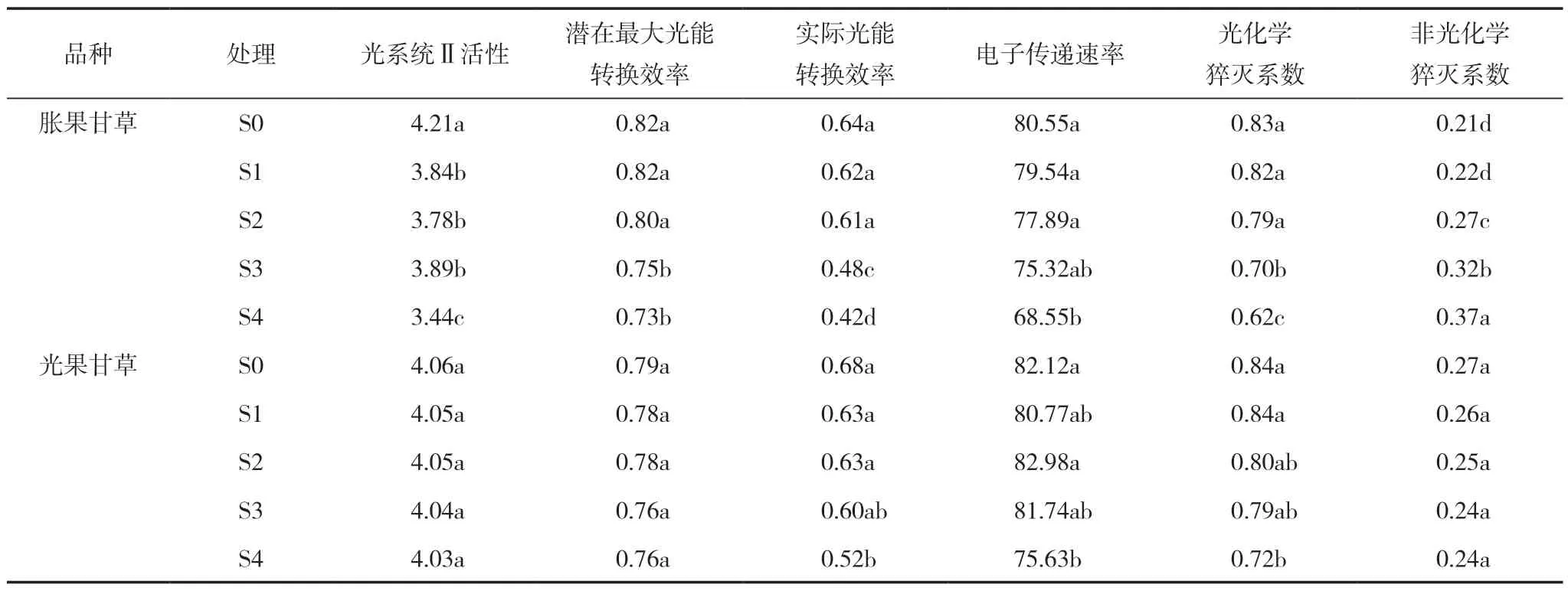
表2 盐胁迫对甘草幼苗叶片荧光参数的影响
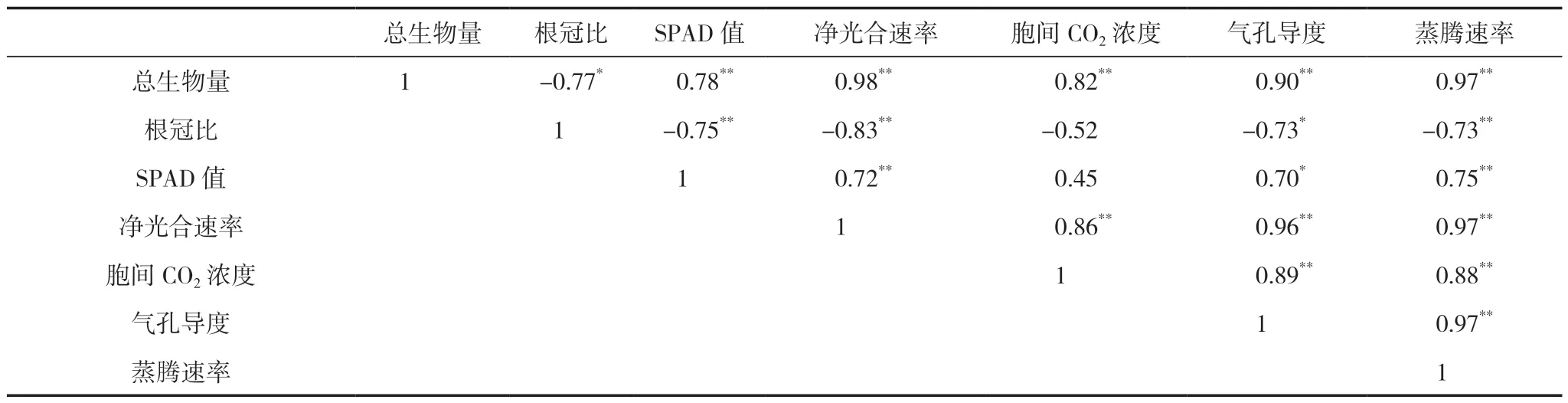
表3 盐胁迫下甘草幼苗生物量与光合参数相关性分析
2.5 盐胁迫、叶绿素含量及光合参数对甘草幼苗生物量变化的贡献
采用R 软件中的BioEnv 程序包进行筛选,发现Pn 和SPAD 值两个光合参数对胀果甘草和光果甘草幼苗生物量变化影响最显著。通过方差分解分析得出盐胁迫、光合参数及二者的共同作用对甘草幼苗生物量变化的贡献(表4)。盐胁迫、SPAD 值和Pn 单因素解释生物量变异的比例分别为-1.15%、4.53%和-2.25%;盐胁迫与Pn 两个因素共解释幼苗生物量变化的比例为8.04%,Pn与SPAD 值两个因素共解释幼苗生物量变化的比例为12.81%,盐胁迫与SPAD 值两个因素共解释幼苗生物量变化的比例为-0.15%,盐胁迫、SPAD值和Pn 3 个因素共解释幼苗生物量变化的比例为25.83%。
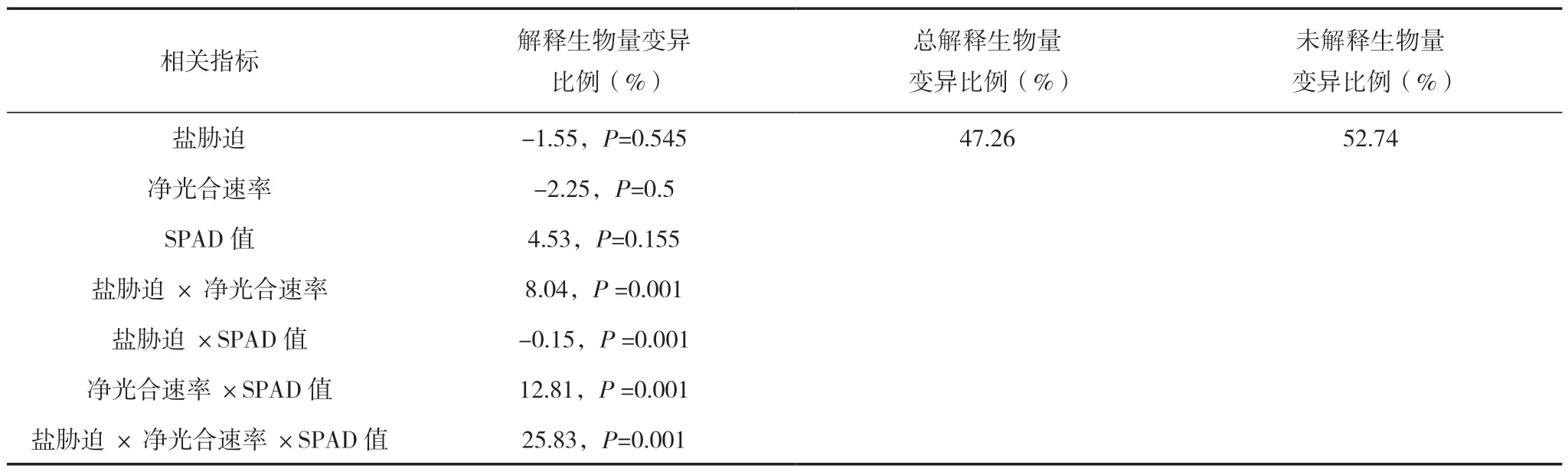
表4 甘草幼苗生物量变化的驱动力分析
3 讨论
生物量是评价盐胁迫程度的重要生长指标[19]。本文的研究结果表明,在不同程度盐胁迫处理下两种甘草幼苗的生物量积累都有所减少(表1),表明甘草幼苗的生物量在盐分胁迫条件下可以通过降低生物量的积累,以更多的资源和能力来对抗高盐分伤害[12]。这与张晓晓等[6]针对白榆、乌凤[12]针对高丛越橘的研究有着类似的结论,进一步表明处于逆境条件下的植物具有调节生物量分配模式的能力[20]。本研究还发现,盐胁迫条件下胀果甘草和光果甘草的根冠比随着盐胁迫含量的提高而增大,高盐浓度处理的甘草幼苗根冠比明显高于CK处理(表1),这表明地上部生长被抑制的程度远高于地下部分,并主要通过降低根系生物量的分配比例,来应对较高的盐分胁迫。
盐胁迫对植物生长的影响是多方面的,特别对光合作用的危害尤为明显[2-6]。有关的研究也证实,在强盐胁迫性环境下,作物叶绿体内部结构受到破坏,并抑制了光合作用的顺利进行[3,5]。本文研究发现,低浓度盐胁迫处理下胀果甘草和光果甘草两种甘草幼苗叶绿素相对含量略有增加,且光果甘草的增幅较大(表1)。随着NaCl 浓度的继续增加,胀果甘草和光果甘草的叶绿素相对含量均有所下降,该结果与前人针对菠萝蜜属植物[9]的研究结果一致。而光果甘草叶绿素相对含量变幅微小,对盐胁迫敏感性不明显。盐胁迫时,植物通常会受到离子的毒害、渗透压胁迫、新陈代谢失调、营养丧失等,进而影响光合作用[19,20-25]。研究表明,盐胁迫影响植株叶片光合作用反应效率的因素,一般包含了由部分气孔封闭所造成的气孔受限,以及由于光合作用反应位点同化能力的下降而造成的非气孔受限[5]。本研究结果表明,胀果甘草叶片Ci、Pn、Gs 均降低(图1),表明胀果甘草的幼苗叶片Pn 减少是受气孔因素的影响;而盐胁迫引起光果甘草叶片的Pn 和Gs 都明显减少,Ci 明显增加,说明光果甘草幼苗的叶片Pn 减少主要限制因素为非气孔因素。这一结果与张晓晓等[6]针对白榆的结论一致,表明盐分胁迫引起植物细胞中盐离子的大量积累,不但使植株体中水势减少,水分效率也下降;同时损坏了叶绿体结构,并引起叶光合器官的损坏,叶肉细胞的光合活力降低。本研究中,其叶绿素相对含量和光合特征等参数均呈现明显正相关关系(表3),这也和先前在黄菠萝属植株上的研究结果一致[5],说明维持较高水平的叶绿素相对浓度可以提高植株干物质量的积累。光合作用对盐胁迫反应极为敏感,而荧光特征参数的变化在植物抗盐能力评价方面应用比较广泛[26-27]。本研究结果表明,胀果甘草在S2 盐浓度处理下其Fv/Fm、ΦPSⅡ、qP 与CK 相比均无显著性差异 (表2),说明胀果甘草是由于非气孔限制因素导致净光合速率的下降。不管是低浓度还是高浓度盐胁迫,光果甘草幼苗的Fv/Fo、Fv/Fm、NPQ与CK 相比均无显著性差异,并且S3 高盐胁迫处理下的ΦPS Ⅱ、ETR、qP 与CK 相比差异不显著,可见,光果甘草净光合速率的下降主要是由非气孔限制因素所造成的,这与前人在其他植物上的研究结果存在一致性[28-30]。
方差分解分析表明,盐胁迫程度、叶绿素相对浓度和Pn 以及交互作用对解释植物幼苗生物量变化的比例影响均达显著性,而后三者的交互作用影响最大(表4)。两种甘草幼苗生物量由于盐胁迫水平的提高而减少,与叶绿素相对含量等光合参数的减少之间存在着密切联系。本文只是利用室内试验研究了盐胁迫梯度对两种甘草幼苗叶片光合荧光参数的影响,而对多品种多环境下的甘草耐盐、敏盐和抗盐机理没有涉及,只有从不同的角度和深度去研究盐胁迫下甘草的表型、内部结构和光合荧光参数变化,才能较全面地理解和明确甘草的盐胁迫机理,从而也是对本研究一个较好的补充。
4 结论
盐分胁迫下胀果甘草光合速率降低主要是受到气孔因素的影响,光果甘草则是非气孔因素起主导作用。高盐胁迫会对胀果甘草幼苗光能转换效率和光系统Ⅱ活性产生抑制作用,可增加光系统Ⅱ非辐射能量的耗散以应对盐胁迫环境。因此,盐分胁迫显著影响胀果甘草,表明其自身调控能力较差,抗盐能力显然低于光果甘草。
