钠离子电池层状氧化物正极材料研究进展
2022-04-07菅夏琰金俊腾沈秋雨刘永畅
菅夏琰,金俊腾,王 瑶,沈秋雨,刘永畅
1) 北京科技大学新材料技术研究院,北京 100083 2) 北京材料基因工程高精尖创新中心,北京 100083 3) 北京科技大学新金属材料国家重点实验室,北京 100083
从煤炭、化石燃料到太阳能、风能、潮汐能,随着人类社会对各类能源需求的不断提升,对储能技术也提出了更高要求.在国家“碳达峰、碳中和”战略目标驱动下,发展高稳定、高安全、高功率、高能量的储能系统显得尤为重要.锂离子电池作为已经成熟的商业化储能器件,极大地改善了人类的生产生活方式,在移动通信、电动汽车等领域展现出巨大活力[1-2].但随着锂资源的大量开发,其储量较少且分布不均的缺点也逐渐暴露,在不远的未来可能失去目前的价格优势.开发新型的可替代电池体系迫在眉睫[3].
钠离子电池的工作原理与锂离子电池相似,二者均为“摇椅型”电池.此外,钠具有丰富的自然储量,且可使用价格更低廉、质量更轻便的铝集流体,这些优势吸引着越来越多的研究人员投入到钠离子电池的研发当中[4-6].然而,钠离子电池也面临一些问题和挑战,例如钠离子(0.102 nm)相比锂离子(0.074 nm)较大的离子尺寸和质量,以及较高的化学活性,会导致电极材料能量密度和功率密度较低、空气稳定性较差[7-9].正极材料作为钠离子电池至关重要的功能组成部分,对改进钠离子电池的性能起着关键作用.目前主流的正极材料包括层状过渡金属氧化物[10]、聚阴离子化合物[11-13]、有机正极材料[14]和普鲁士蓝类似物[15-16]等.其中,层状过渡金属氧化物由于较高的平均电压、高比容量和易于合成等特性,被认为是最具前景的钠离子电池正极材料之一.
开发具有高比能量、高循环稳定性和良好空气稳定性的新型层状氧化物正极材料是钠离子电池研究的一个热点方向.本文从层状氧化物的设计思路出发,重点介绍了成分改性、结构改性和表面改性3个方面的最新进展;最后探讨了不同改性手段的优势和局限性,对未来高性能钠离子电池层状氧化物正极材料的研发方向作了展望.
1 层状氧化物正极材料
层状氧化物正极材料,通式为NaxTMO2(TM指过渡金属),1980年由Delmas等[17]率先提出,如图1所示,按照钠离子配位环境不同可分为P型和O型,P和O分别代表钠离子占据棱柱形(Prismatic)位置和八面体(Octahedral)位置;按照氧层的堆叠顺序不同可进一步分为P2、P3、O3等类型,数字代表氧层在最少重复单元的堆垛层数.由于结构上的不同,三者在电化学性质上存在较大差异.P2型材料具有更宽的钠离子传输通道和较低的钠离子迁移能垒,表现出较快的扩散动力学,但初始容量较低,且容易发生P2→O2相变影响循环稳定性[18-20].与P2型材料相比,O3型材料钠离子含量更高,从而具备更高的初始容量.但是其倍率性能和容量保持率较差[21-22].P3型材料具有比O3型材料更低的钠离子扩散势垒,且烧结温度较低,更符合节约能源的需要;但由于晶体结构对称性较差,钠离子脱嵌过程中过渡金属层滑移矢量增多,容易产生复杂的相变,导致循环过程中出现明显的容量衰减[23-24].

图1 层状氧化物结构示意图.(a)P2 型;(b)O3 型;(c)P3 型Fig.1 Schematic crystal structures of the layered oxides: (a) P2-type;(b) O3-type; (c) P3-type
为了解决上述层状氧化物材料中存在的各种问题,研究者开发出了多种改性手段,如图2所示,通过对材料组分、结构和表面进行设计和优化,可以提升材料的比容量,增强材料的结构稳定性和空气稳定性,进而发掘层状氧化物正极的应用价值.
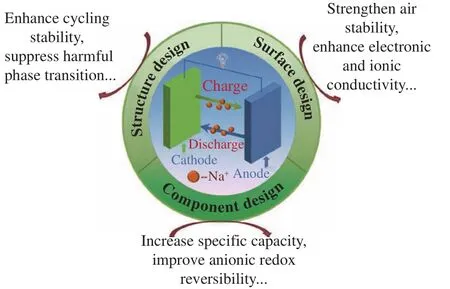
图2 常用的层状氧化物储钠正极材料改性手段示意图Fig.2 Schematic diagram of the commonly used modification methods for layered oxides as Na-storage cathode materials
2 层状氧化物正极材料的组分设计
组分设计是层状氧化物正极材料最常用的改性手段.通过寻找合适的掺杂离子,优化离子掺杂浓度及掺杂位点,可以显著提高正极材料的比容量和循环稳定性[25-26].其中,传统的层状氧化物正极基于阳离子氧化还原过程提供电荷补偿,驱动整个电化学反应并贡献容量.近年来,阴离子氧化还原由于可以提供额外的可逆容量,被视作突破层状氧化物正极理论容量瓶颈的关键[27].
2.1 阳离子氧化还原材料
2.1.1 一元金属基材料
LiCoO2在锂离子电池中取得的巨大成功[28]使得研究人员首先将目光锁定在组分相似的NaCoO2等一元金属基氧化物上[29].Lei等[30]首先研究了P2、O3型NaxCoO2的电化学性质.在充放电过程中,O3-NaxCoO2会发生复杂的相转变,循环稳定性较差.P2-NaxCoO2则表现出更好的循环性能,但钠离子/空位有序的问题影响其动力学性能.相对于较为稀缺的钴资源,铁、锰元素的自然储量更丰富,NaxFeO2[31]、NaxMnO2[32]材料具备更显著的成本优势.其中,α-NaFeO2[33]在3.3 V的充电截止电位下,基于Fe3+/Fe4+氧化还原电对可提供85 mA·h·g-1的可逆容量.但随着截止电压的上升,循环性能逐渐下降.如图3所示,当充电电位上升到3.5 V以上时,大量钠离子脱出,Fe3+向钠层进行不可逆的迁移,阻碍后续放电时钠离子嵌入从而降低可逆容量.P2-NaxMnO2[34]具有大于 130 mA·h·g-1的可逆容量,然而受Mn3+的姜泰勒效应影响[35],其结构随着反复充放电迅速坍塌,影响循环性能.此外,还有其他单金属基材料,如NaxNiO2[36]、NaxVO2[37]等也受到人们关注,并表现出一定的应用潜力.
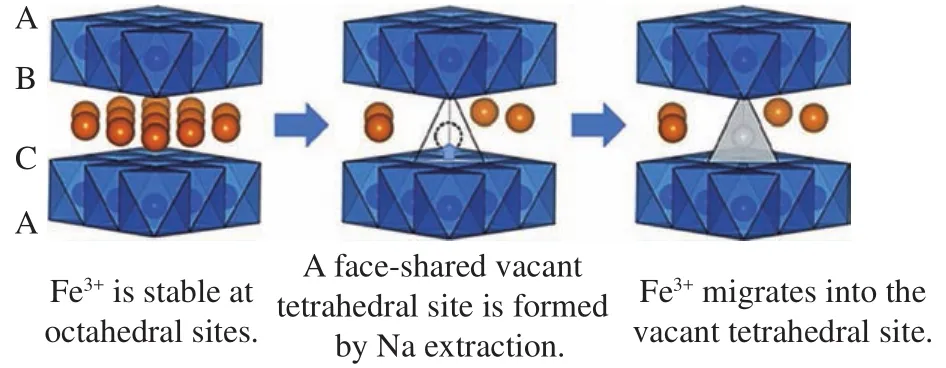
图3 α-NaFeO2在高电压下Fe3+的迁移路径示意图[33]Fig.3 Schematic diagram of Fe3+ migration path under high voltage in α-NaFeO2 [33]
2.1.2 二元及多元金属基材料
在一元金属基氧化物的基础上,为了克服单种金属氧化还原反应的局限性,综合不同金属元素的优点,研究者展开了针对二元金属基氧化物的探索.澳大利亚卧龙岗大学侴术雷教授课题组Liu等[38]研究了P2-Na2/3Ni1/3Mn2/3O2(P2-NaNM)的充放电过程,如图4所示,初始状态镍为二价,锰为四价.在2~4 V循环时,通过Ni2+/Ni3+/Ni3.5+氧化还原电对提供电荷补偿,锰离子则保持四价,Ni2+和Mn4+作为姜泰勒惰性离子,有助于提高P2-NaNM在充放电过程中的结构稳定性,材料在1730 mA·g-1的电流密度下循环1200周,容量保持率可达71.2%,但比容量较低,17.3 mA·g-1电流密度下仅为89 mA·h·g-1;电压窗口扩大后,材料的容量得到一定提升,但受P2→O2相变等因素影响,容量衰减较为严重.
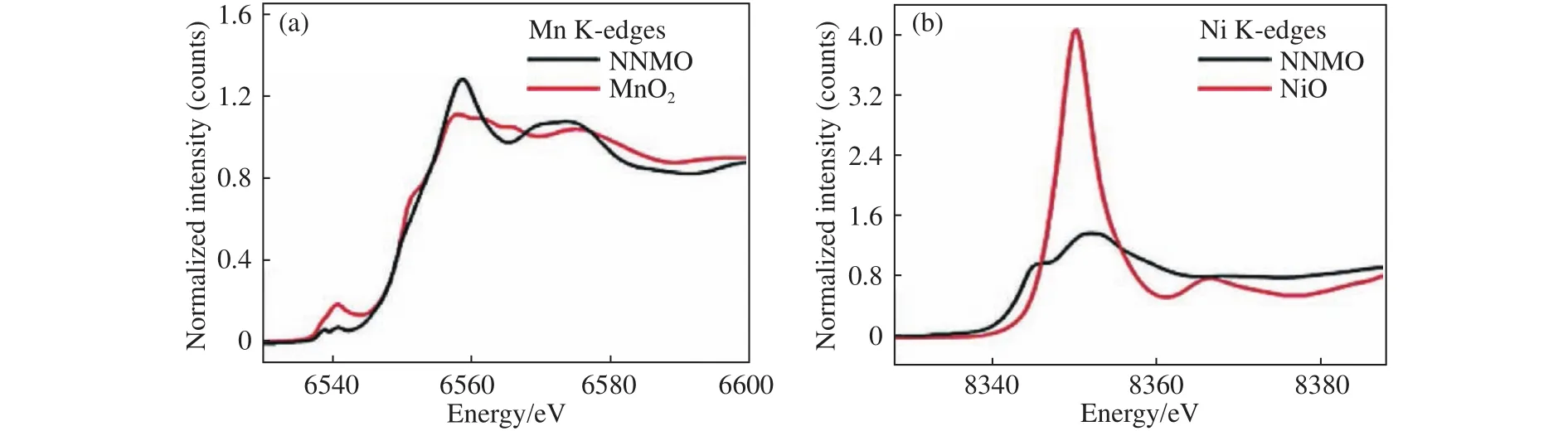
图4 P2-Na2/3Ni1/3Mn2/3O2正极材料的X射线近边吸收结构谱(XANES).(a)Mn K边;(b)Ni K边[38]Fig.4 XANES spectra of the P2-Na2/3Ni1/3Mn2/3O2 cathode material: (a) Mn K edges; (b) Ni K edges[38]
铁和锰在地壳中丰度极高,此外,Fe3+/Fe4+具有高的氧化还原电位,Mn3+/Mn4+可提供出色的比容量,这些优势使得Fe/Mn基氧化物材料受到广泛关注.2012年,Komaba教授小组Yabuuchi等[39]首次报道了P2-Na2/3Mn1/2Fe1/2O2(P2-NaFM)的电化学储钠行为,在1.5~4.3 V的电压区间可释放190 mA·h·g-1的初始放电容量.但是,P2-NaFM却表现出较差的空气稳定性和容量保持率,以及较低的库仑效率.如图5所示,从3.8 V充电至4.2 V后,X射线衍射峰位置和强度发生明显变化,表明存在结构转变.由于初始的钠含量较低,充电后钠离子脱出使得层间剩余钠离子过少,过渡金属层发生滑移导致P2→O2相变.针对各类二元金属基材料出现的问题,可以进一步增加掺杂元素种类,除了Mn、Fe、Ni、Co等电化学活性元素外,还可引入少量电化学惰性元素如Li[40]、Zn[41]、Cu[42]等提高材料的结构稳定性.最近,南开大学陈军院士团队Wang等[43]报道了少量钾掺入钠位点的P2-Na0.612K0.056MnO2正极材料,较大半径的钾离子固定在钠层,稳定了钠层结构,有利于钠离子扩散,而且钾离子附近的Mn—O键增强,抑制过渡金属层滑移,改善了循环稳定性.南开大学焦丽芳教授课题组Jin等[44]开发了高钠含量的P2-Na0.85Li0.12Ni0.22Mn0.66O2,锂掺杂抑制了钠离子/空位有序化,将相变过程转化为体积变化较小的固溶过程,显著提高了材料的倍率性能和容量保持率.此外,还可以制备具有3种或多种过渡金属基的材料,如NaNi0.4Mn0.25Ti0.3Co0.05O2[45],通过结合3种活性金属元素以及惰性的钛元素,协同提升倍率性能和循环稳定性.
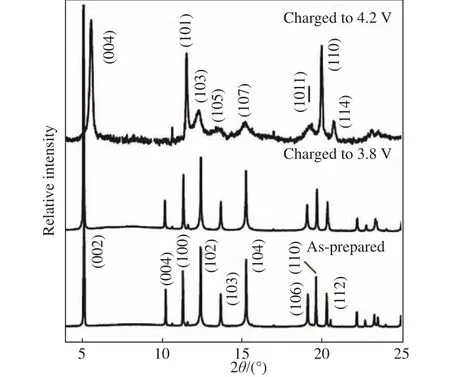
图5 P2-Nax[Fe1/2Mn1/2]O2充电至3.8 V (x = 0.42)和4.2 V (x = 0.13)与初始样品的同步辐射X射线衍射图(SXRD, λ = 0.05 nm)对比[39]Fig.5 SXRD (λ = 0.05 nm) patterns of the P2-type Nax[Fe1/2Mn1/2]O2 cathode materials charged to 3.8 V (x = 0.42) and 4.2 V (x = 0.13) in comparison with the as-prepared sample[39]
2.2 阴离子氧化还原活性材料
除了依靠阳离子氧化还原过程提供电荷补偿,在层状氧化物材料中也发现了由阴离子(主要是氧离子)主导的氧化还原反应,以此为基础可以提供额外的可逆容量[46].在锂离子电池领域由Jean[47]在高价硫系化合物中首次发现并提出,之后在富锂层状氧化物正极材料中得到了广泛研究,研究者认为非键合的氧2p轨道在激发阴离子氧化还原过程中起到关键作用[48].如图6所示,在富锂材料中,随着Li/TM或O/TM化学计量比增加,费米能级附近氧2p轨道增多,O2-的氧化还原活性被激发[49].基于以上理论,在钠离子电池领域,研究者从类似的富钠4d/5d金属基层状氧化物材料中也发现了阴离子氧化还原过程:过量的钠离子进入过渡金属层,导致非键合的氧2p轨道形成进而激发氧反应.但由于钠和锂化学性质的差异,部分机理可能与富锂材料不同[50],且受限于4d/5d金属元素昂贵的价格和贫乏的储量分布,其应用可能受到较大限制.值得注意的是,在钠离子含量较低的P型锰基层状氧化物材料中,也发现了阴离子氧化还原反应的存在[51],通过在其过渡金属层引入其他惰性金属元素或空位可以激发阴离子氧化还原,且相对于富钠材料展现出较大的成本优势.
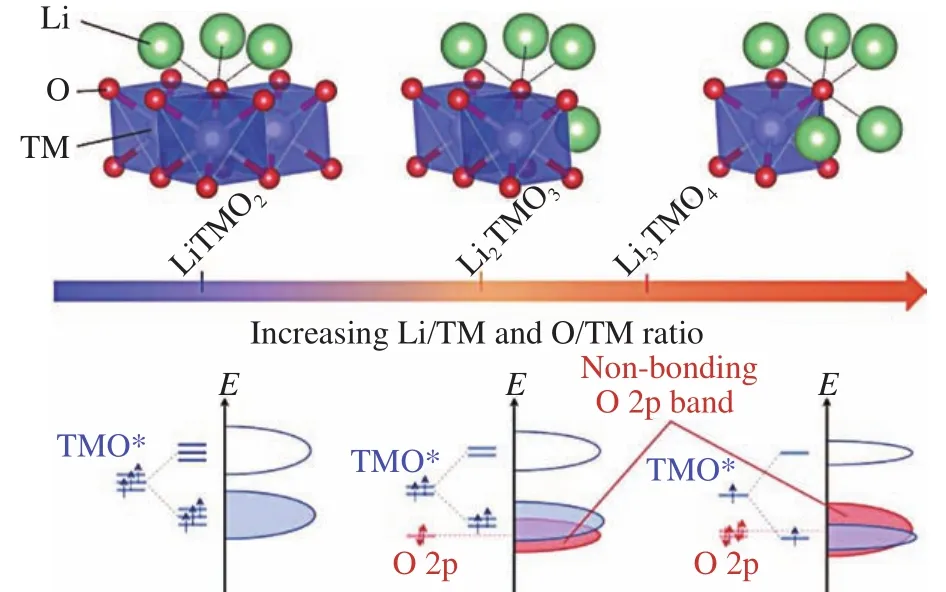
图6 随着Li/TM或O/TM化学计量比增加氧原子配位环境的变化,以及对应氧原子电子结构的变化示意图[49]Fig.6 Local coordination structures around oxygen as a function of the Li/TM or O/TM stoichiometric ratio, along with a schematic diagram of the corresponding electronic structures[49]
2.2.1 富钠层状材料
早期主要在4d/5d金属基O3型富钠材料中发现阴离子氧化还原过程.Yamada团队Mortemard de Boisse[52]报道了阳离子有序的Na2RuO3材料,除了Ru4+/Ru5+氧化还原电对参与电化学反应,阴离子电对(O2-/On-)也可以提供额外电荷补偿,使整体容量上升约 30%(135 mA·h·g-1→180 mA·h·g-1).Perez等[53]报道了富钠的Na2IrO3,每个分子单元可逆循环1.5个钠离子,Ir—O键强的共价性抑制了循环过程中Ir4+的迁移,且没有氧气产生,氧化还原过程具有良好的可逆性.值得注意的是,Nanba等[54]报道了O3-NaFe0.5Ni0.5O2材料,在仅具有3d金属的富钠材料中也发现了阴离子氧化还原,阴离子对容量的贡献超过80%,但导致异常低的 Ni3+/Ni4+工作电势.此外,在 Na3RuO4[55]、Na2ZrO3[56]等富钠材料中也发现阴离子氧化还原的存在.
2.2.2 缺钠层状材料
在缺钠P型氧化物材料的过渡金属层中引入电化学惰性金属离子是激发阴离子氧化还原活性的一种手段.2016年,Du等[57]报道了仅含有活性Mn4+的P3-Na0.6(Li0.2Mn0.8)O2材料,在充放电过程中存在阴离子氧化还原反应,但循环稳定性较差.中科院物理所胡勇胜研究员团队Rong等[58]开发了Na0.72[Li0.24Mn0.76]O2材料,首周循环阴离子反应可提供高达210 mA·h·g-1的充电容量,而且他们发现阴离子氧化还原能够减小材料在循环过程中的体积应变.最近,Song等[59]对P3-Na2/3Mg1/3Mn2/3O2进行了全面研究,该材料在循环过程中阳离子和阴离子电对协同参与氧化还原反应.如图7所示,dQ/dV曲线显示在初始充电过程中,只有阴离子氧化还原参与反应,在随后的放电过程中,氧离子和锰离子都参与电荷补偿,但阴离子氧化还原过程表现出较大的电压滞后,且循环过程中存在Mg2+向钠层的迁移,导致P3到O3相的不可逆转变.Konarov等[60]首次研究了锌掺杂对P2-Na2/3[Mn0.7Zn0.3]O2电化学性质的影响,基于阴离子氧化还原反应(O2-/O-)的初始放电容量约为190 mA·h·g-1,低电压处的容量由Mn4+/Mn3+氧化还原反应提供,循环过程中存在P2→OP4的相变.此外,复旦大学傅正文教授团队Shi 等[61]发现Al3+掺杂的P3-Na0.65Mn0.5Al0.5O2(NMAO)中也存在较为可逆的阴离子氧化还原反应,并指出Al3+和O2-的相互作用产生的准非键合态是激发氧离子活性的根本原因.此外,在Cu2+[62]掺杂材料中也发现了阴离子氧化还原现象.为了实现阴离子氧化还原的实际应用,提高其循环可逆性至关重要.Zhang等[63]报道了锌离子掺杂的 (Na0.833Zn0.0375)[Li0.25Mn0.7125]O2(NLMOZn)正极材料.其中锌离子掺杂在钠位点,有效抑制了氧损失并减少Mn3+的含量以缓解姜泰勒畸变,提高了结构稳定性,表现出可逆的阴离子氧化还原过程.复旦大学周永宁教授课题组Wang等[64]报道了镁离子同时位于钠层和过渡金属层的Na0.7Mg0.05[Mn0.6Ni0.2Mg0.15]O2材料,钠层的镁离子起支柱作用,稳定层状结构,并与过渡金属层中的镁离子一起形成独特的Mg—O—Mg、Na—O—Mg构型,激发可逆的氧反应.中科院化学所郭玉国研究员团队Xiao等[65]报道了P2-Na0.67Mn0.6Ni0.2Cu0.1Mg0.1O2材料,Cu和Mg的共掺杂效应提高了TM—O键的共价性,提升循环过程中晶格氧的比例,增加了阴离子氧化还原的可逆性.
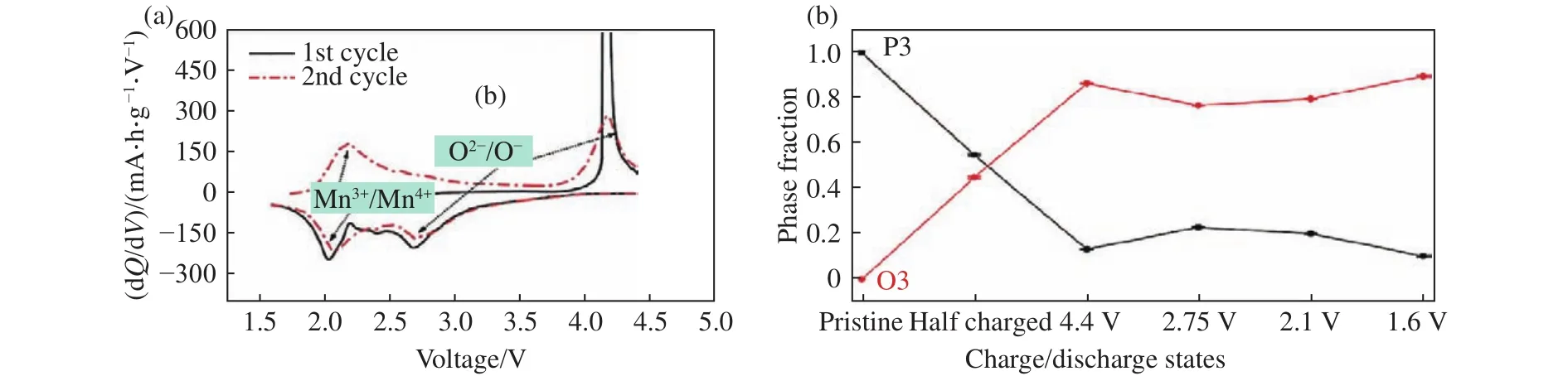
图7 P3-Na2/3Mg1/3Mn2/3O2 (a)在 1.6~4.4 V(vs Na+/Na)电压范围内第一周和第二周的充放电 dQ/dV 图(电流密度为9.7 mA·g-1);(b)不同充放电状态下P3相和O3相的占比分数(采用Rietveld精修方法)[59]Fig.7 (a) dQ/dV plots of P3-Na2/3Mg1/3Mn2/3O2 in the first and second cycles at 9.7 mA·g-1 from 1.6 V to 4.4 V (vs Na+/Na); (b) refined phase fractions of the P3 and O3 phases (using the Rietveld refinement method) at various charge/discharge states of Na2/3Mg1/3Mn2/3O2[59]
同时利用阴离子和阳离子氧化还原可以获取更大的容量.南京大学周豪慎教授和郭少华教授课题组Xu等[66]报道了P2型Na0.67[Li0.21Mn0.59Ti0.2]O2材料,其中锰离子和氧离子均发生可逆的氧化还原反应.掺杂的Ti4+能够稳定材料的结构,并抑制锰离子的迁移.基于阳离子和阴离子氧化还原的协同作用,材料在1.5~4.5 V的电压范围内表现出高达231 mA·h·g-1的可逆容量,且循环性能优异.
阴离子位取代也是可行的策略.最近,华东师范大学胡炳文研究员团队Zhao等[67]报道了F-取代的P2-Na0.65Li0.22Mn0.78O1.99F0.01(NLMOF)材料,如图8所示,首次充电后没有检测到氧气生成,循环性能相较初始的P2-Na0.66Li0.22Mn0.78O2也得到提高,表明F-提升了原材料的结构稳定性和阴离子氧化还原的可逆性.究其原因,Mn—F键较高的离子性增加了Mn—O共价键的柔性,有利于钠离子脱出时的稳定,减少晶格氧损失.
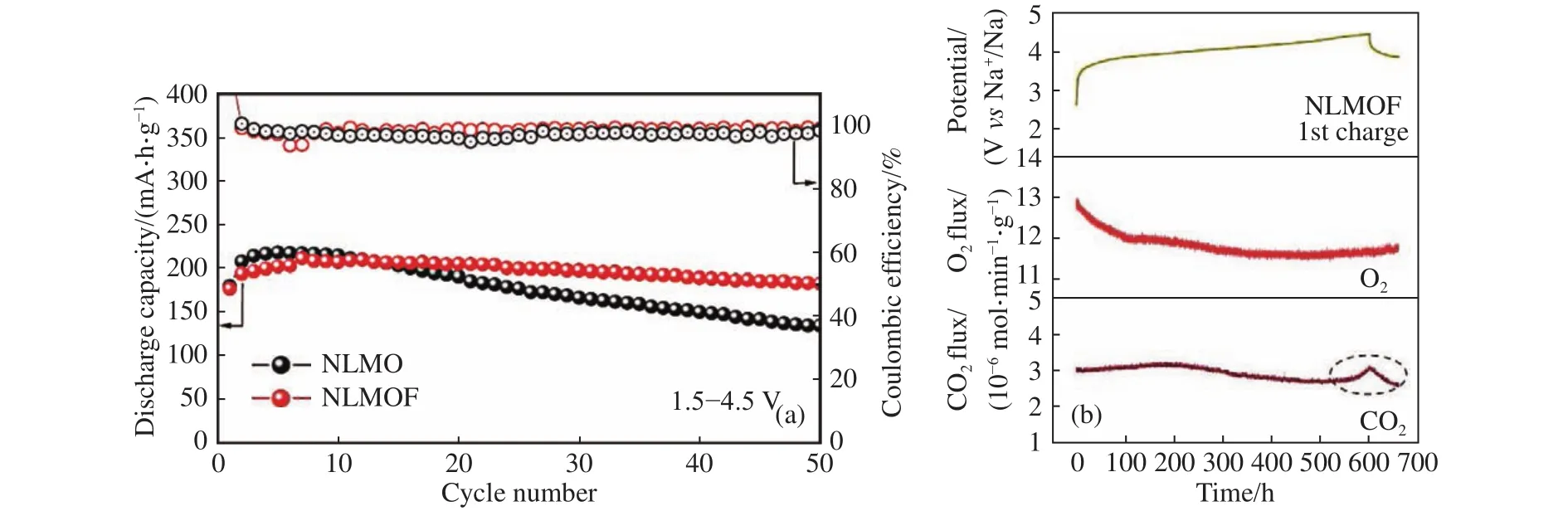
图8 (a)P2-Na0.65Li0.22Mn0.78O1.99F0.01 与 P2-Na0.66Li0.22Mn0.78O2 的循环性能对比(电流密度为10 mA·g-1);(b)P2-NLMOF 首次充电过程的原位差示电化学质谱(DEMS)气体释放结果[67]Fig.8 (a) Comparison of the cycling performance at 10 mA·g-1 between P2-Na0.65Li0.22Mn0.78O1.99F0.01 and P2-Na0.66Li0.22Mn0.78O2; (b) operando DEMS results of gas evolution during the first charge process of P2-NLMOF[67]
3 层状氧化物正极材料的结构设计
制备复合相材料也被视作改善层状氧化物正极材料性能的有效手段.P2结构稳定性较好,但比容量较低;O3结构比容量更高,但循环稳定性较差.因此可以设计两相混合的结构来实现综合性能的提升.Bianchini等[68]率先通过固相法制备了不含钴和镍元素的P2-O3复合相Na2/3Li0.18Fe0.2Mn0.8O2材料,在第一个循环中放电容量达到125 mA·h·g-1(1.5~4.2 V),循环过程中不存在P2→OP4相变,并显示出良好的倍率性能.随后,Yang等[69]通过溶胶凝胶法合成了双相P2(质量分数为34%)/O3(质量分数为60%)Na0.8Li0.2Fe0.2Mn0.6O2正极材料,初始放电容量为174 mA·h·g-1,100 次循环后容量保持率为82%,初始层间钠离子含量的提高使得充放电过程中材料结构更加稳定.以上两种正极材料同时结合了O3相高容量和P2相高循环稳定性的特点,综合提升了电化学性能.
在混合相的基础上,还可以进一步通过微观结构和形貌设计来改善层状氧化物正极的性能.中南大学韦伟峰教授课题组Chen等[70]开发出一种O3/O′3-P2核-壳复合结构材料,如图9所示,电子探针X射线微区分析(EPMA)结果显示Ni、Co在内核浓度相对较高,而Mn在颗粒表面浓度较高,在扫描电镜下显示出明显的核壳结构.该复合材料同时利用O型富镍基核的高比容量和P2型富锰外壳的高结构稳定性,实现循环稳定性和比容量的综合提升.在此基础上还可以制备同相但元素浓度径向梯度分布的材料.在降低整体结构应力的前提下,实现表界面稳定性和内部结构稳定性的提升.北京理工大学曹传宝教授团队Zhao等[71]报道了钛梯度改性的P2-Na0.66Mn0.54Ni0.13Co0.13O2正极材料,在4.7 V截止电压下循环100次后,可提供 133.2 mA·h·g-1的可逆容量,容量保持率为77.9%.表面较高浓度的钛离子取代提高了界面导电性并抑制表面副反应,内部较低浓度的钛离子取代提高了结构稳定性,抑制相变发生.通过与其他材料复合可以同时改善正极材料的电化学性能和机械强度,上海交通大学马紫峰教授课题组Yang等[72]合成了还原氧化石墨烯(RGO)/P2-Na2/3[Ni1/3Mn2/3]O2复合电极,RGO包裹后的材料表现出极佳的柔韧性和导电性,且无需使用黏结剂,材料的倍率和循环性能均有所提升.
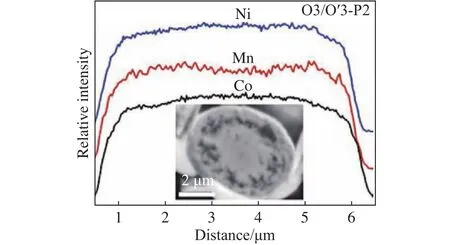
图9 O3/O′3-P2材料的电子探针X射线微区分析(EPMA)线性扫描(插图:横截面扫描电镜图像)[70]Fig.9 EPMA line scan of the O3/O′3-P2 material (Inset: cross-sectional scanning electron microscopy image)[70]
超结构的设计和调控也被证实可以改善阴离子氧化还原可逆性.House等[73]比较了Na0.75[Li0.25Mn0.75]O2和Na0.6[Li0.2Mn0.8]O2两种正极材料,如图10所示,Na0.75[Li0.25Mn0.75]O2具有局部蜂窝状超结构,充放电过程会产生氧气并发生锰离子迁移,最后导致结构改变,造成电压衰减;而Na0.6[Li0.2Mn0.8]O2中局部的带状超结构使得锰离子迁移距离增大,进而抑制锰离子的无序化并减少氧气分子的形成,显著改善了电压衰减的问题.此外,还可以设计层状-隧道状复合结构[74]、运用静电纺丝工艺制备纳米纤维状结构[75-76]来改善材料性能.但值得注意的是,利用精心设计的复合结构虽然可以实现明显的性能提升,多种结构会导致材料复杂的反应方式和相变过程,增大了内在反应机理的表征和研究难度.
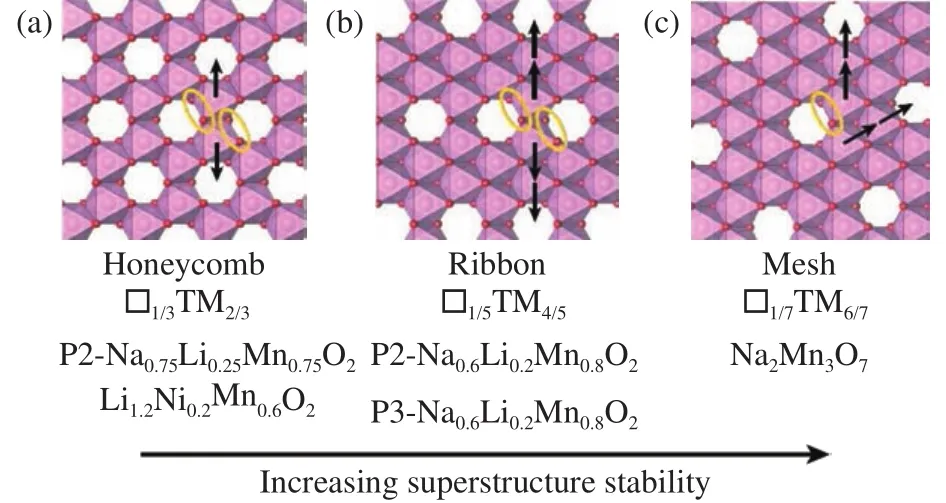
图10 充电状态下在具有(a)蜂窝状,(b)带状,(c)网状超结构的TM层中形成O2分子(橙色椭圆形)时面内Mn3+迁移路径(箭头所示),□代表过渡金属层的空位[73]Fig.10 In-plane Mn3+ migration paths (shown by the arrow) in the (a)honeycomb, (b) ribbon, and (c) mesh superstructures in TM layers when O2 molecules (orange ellipse) are formed during charging, □ represents the vacancies in the TM layer [73]
4 层状氧化物正极材料的表面设计
一般来说,层状氧化物正极容易受到大气(尤其是潮湿空气)或电解液的腐蚀,发生结构变化造成容量衰减,或者产生固体-电解质(SEI)界面层,影响钠离子传输[77].可以采用表面改性的方法来缓解或解决此类问题[78],特别地,在层状氧化物表面包覆其他材料能够有效增强电极的结构稳定性.厦门大学杨勇教授课题组Zuo等[79]采用原子层沉积技术将3 nm厚的Al2O3包覆在P2-Na0.67Zn0.1Mn0.9O2正极材料表面,使得电化学循环过程中形成均匀、稳定的正极-电解液界面(CEI)层,阻止了有机电解液的进一步分解,提高了材料的循环稳定性.采用其他金属氧化物(如MgO[80])进行表面包覆也能达到类似的效果.
金属磷酸盐也可以作为电极表面的包覆材料,Li等[81]使用NASICON型NaTi2(PO4)3涂层包覆P2-Na0.67Co0.2Mn0.8O2,有效减轻了循环过程中电解液副产物HF对电极的侵蚀,并促进电解液中钠离子向正极内部扩散,实现循环稳定性和倍率性能的综合提升.除了包覆其他材料,也可以通过构造人工界面层来达到改性的目的.最近,Moeez等[82]通过电化学预放电(预嵌钠)在O3-NaFe0.5Ni0.5O2(NFNO)表面构筑人工电极-电解质界面层(ACEI),如图11所示,微量嵌入的钠离子和部分分解的电解液形成的ACEI层可以有效防止过渡金属的溶解,抑制Ni4+的迁移,提高了NaFe0.5Ni0.5O2正极材料的界面稳定性,进而提升材料的循环性能和空气存储稳定性.此外,表界面结构设计对阴离子氧化还原也有一定影响,Wang等[83]采用共沉淀法将AlPO4和Mg3(PO4)2包覆在P3-Na0.65Mn0.75Ni0.25O2表面,显著提升了材料的循环性能,且表面的磷酸盐层可以抑制高电压下不可逆的晶格氧损失,提高阴离子氧化还原的可逆性.然而,其内部的影响机制还需要进一步研究.
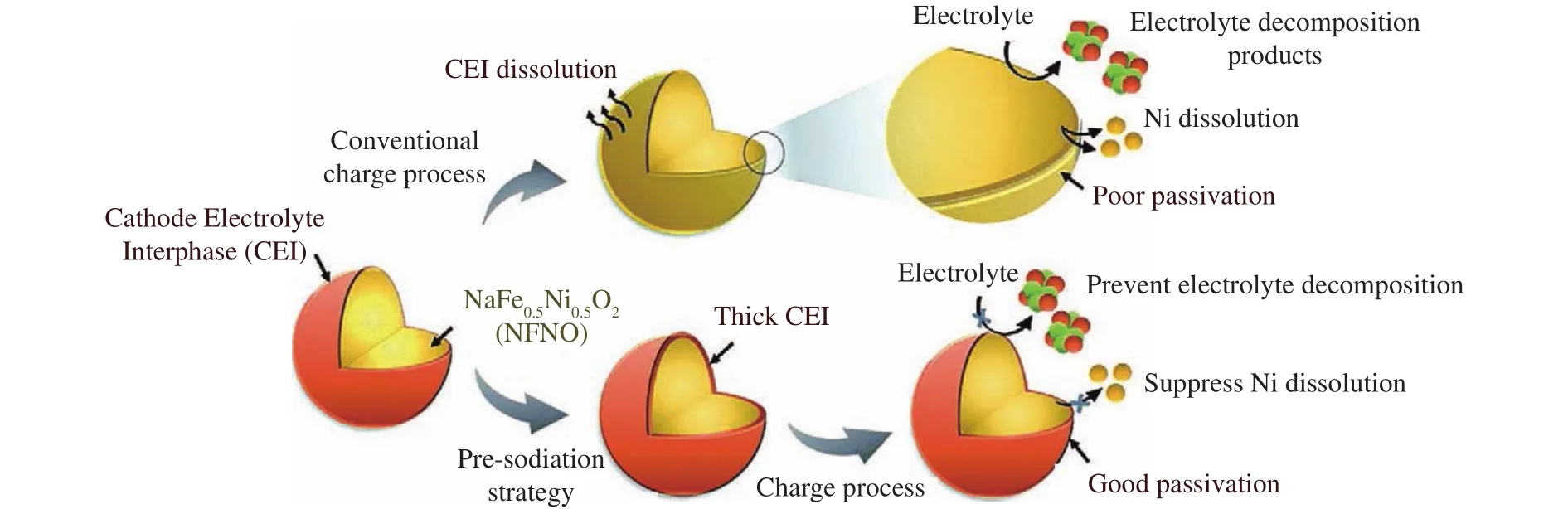
图11 利用预嵌钠策略在NaFe0.5Ni0.5O2 (NFNO)表面构筑人工电极-电解质界面层(ACEI)的原理示意图[82]Fig.11 Schematic illustration of the preparation of ACEI on the NaFe0.5Ni0.5O2 (NFNO) cathode through a presodiation strategy[82]
5 总结与展望
钠离子电池层状氧化物正极材料具有成本低廉、比容量较高、合成简便等优点,近年来受到研究人员的广泛关注.但是受其结构限制,较难在比容量、循环稳定性、倍率性能上实现综合提升,为此开发了多种改性手段.阳离子取代是最常用的方法,传统的一元金属基材料依靠单一阳离子氧化还原过程来提供容量,其循环性能有待提升.结合多种金属元素,依靠不同阳离子氧化还原电对的特性互补可以很大程度地改善材料性能,掺杂惰性金属则可以提高材料的结构稳定性,由此诞生了二元、三元和多元金属基材料.近年来,最引人瞩目的是阴离子氧化还原的利用,通过阴离子的变价来提供电荷补偿,突破了层状氧化物正极材料的容量限制.在钠含量较高的富钠层状氧化物中率先发现较为可逆的阴离子氧化还原过程,但受4d/5d金属的价格限制,其实际应用较为困难.在钠含量较低的缺钠层状氧化物材料中,通过向过渡金属层引入惰性金属元素或空位也可以激发阴离子氧化还原活性,并可采用更为廉价的3d过渡金属元素,但其循环性能有待改善.为此,研究者提出了多种提升阴离子反应可逆性的方法,如过渡金属层或钠层离子掺杂,阴离子位取代等.此外,还可以通过结构调控来优化层状氧化物的电化学性能,复合相、核壳结构、梯度结构、微钠结构已经被广泛讨论和研究.表面设计也可以有效提升氧化物正极材料的结构稳定性,增加其应用潜力.除了上述改性方法,合成和加工工艺的改进、内部反应机理的深入研究、耐高压电解液的开发,对于层状氧化物正极材料的实际应用也有着重要意义.在现有研究基础上,未来还可以从以下几个思路进一步优化层状氧化物储钠正极材料:
(1)探究各类元素对层状氧化物储钠行为的影响机制,利用材料基因组计算辅助筛选可行的多元素组合、配比方案,协同提升电化学性能.
(2)利用阴离子氧化还原过程是提升容量的有效途径,但其可逆性和动力学性能必须得到改善.基于已有的非键合O2p轨道理论,提高TM—O键的共价性是减少晶格氧损失的一种措施.此外,超结构优化、表面包覆也可以提高阴离子反应的可逆性.未来的关键在于进一步理解阴离子氧化还原的反应机理,是否存在反键态轨道机制、还原耦合机制等仍需深入研究,以便更好地对其改性.
(3)将多种改性手段有机结合起来,综合各自优势,是未来层状氧化物正极研发的大势所趋.但多重结构与掺杂可能会导致作用机理的复杂化,增加表征分析的难度.
(4)发展先进的表征手段,有助于挖掘材料的深层次反应机理和构效关系,也是层状氧化物正极取得更大突破的关键.
