胰尾原发罗道病1例报告并文献复习
2022-04-07邓攀肖广发毛雅琪罗凤球刘冬保申帅刘轩
邓攀,肖广发,毛雅琪,罗凤球,刘冬保,申帅,刘轩
(湘雅常德医院普通外科,湖南常德415000)
罗道病(Rosai-Dorfman disease,RDD)是一种病原不明,易复发、易误诊的良性组织细胞增生性疾病,又称窦组中细胞增生伴巨淋巴细胞病[1],是由Rosai和Dorfman于1969年首次描述的一种临床病理实体,各个系统均可发生[2]。RDD主要累及青少年及儿童,常见的临床症状为双侧颈部大量无痛性淋巴结,偶可见血沉、发热、中性粒细胞增多,高球蛋白血症等[3]。根据病变累及范围,RDD可分为淋巴结型、淋巴结外型和混合型[4],以淋巴结型最为常见[5],主要累及双侧颈部的淋巴结,表现为巨大的无痛性肿块,单发无淋巴结病变的RDD不足20%。淋巴结外型RDD与实体瘤相似,主要累及骨骼、颅脑、鼻腔、乳腺等,但临床表现差异性较大,需要根据病变部位的临床特点并结合辅助检查进行诊断和鉴别诊断[6-7]。RDD在消化系统中较少发病,累及胰腺的更为罕见[8]。现报道1例湘雅常德医院普通外科收治的胰尾原发RDD病例,并结合文献进行综合分析,以期为临床诊治提供借鉴。
1 资料与方法
1.1 病例资料
患者男,64岁。因发现胰腺肿物4个月余,于2020年4月13日入院。入院时查体:双侧颈部未扪及肿大淋巴结,双侧腹股沟未扪及肿大淋巴结;腹部体格检查无明显异常。CEA,CA19-9均未见明显异常。2020年4月14日行CT胰腺平扫双期增强三维胰周血管成像CTA、CTV,结果提示:胰尾肿块,脾动静脉供血,胰腺来源?良恶性待定。腹腔及腹膜后未见肿大淋巴结(图1)。磁共振胰胆道造影+平扫增强结果:胰尾区占位,性质待定,偏恶性;大网膜区结节;脾脏切除呈术后改变;脾动脉中段假性动脉瘤,腹腔及腹膜后亦未见肿大淋巴结(图2)。2020年4月13日肺部CT平扫结果示:慢性支气管炎,肺气肿;右上肺后段小结节,LU-RADS 2类。双下肺少许间质性炎症。纵隔未见肿大淋巴结。2020年4月14日肝胆胰+门静脉系彩超:胰尾部实质性结节性质待定(20 mm×25 mm低回声结节,形态规则,边界清,内回声欠均匀)。结合患者病史及相关辅助检查结果,仍无法排除胰腺恶性肿瘤。为明确诊断及治疗方案,经患者及家属同意,我院多学科讨论后决定于全麻下行胰体尾切除、腹腔粘连松解术,手术顺利。术后病理结果提示:(胰尾部)送检组织见大量泡沫样组织细胞瘤样增生、聚集,间质纤维化,少量组织细胞内可见浆细胞、淋巴细胞及粒细胞被吞噬现象,形态结合免疫组化结果分析,考虑为RDD(属淋巴组织细胞增生性疾病)。免疫组化结果显示:CK18(-),CK20(-),CK7(-),P53(野生型),CA125(-),CEA(-),MUC2(-),MUC5AC(-),CD68(+),AACT(+),CgA(-),Syn(-),CKpan(-),S-100(部分+),Vimentin(+),PAX-2(-),PAX-8(-),SF-1(-),EMA(-),CD163(+),Ki-67(约5%+),特殊染色结果显示:PAS(-),消化PAS(-)(图3A-D)。术后请肿瘤及相关科室行多学科会诊,讨论一致认为无需进一步辅助治疗。患者于术后第13天出院,目前随访1年,患者一般状况良好,无腹痛,血糖正常、CEA、CA19-9未见异常,彩超未见胰腺结节及肿物。
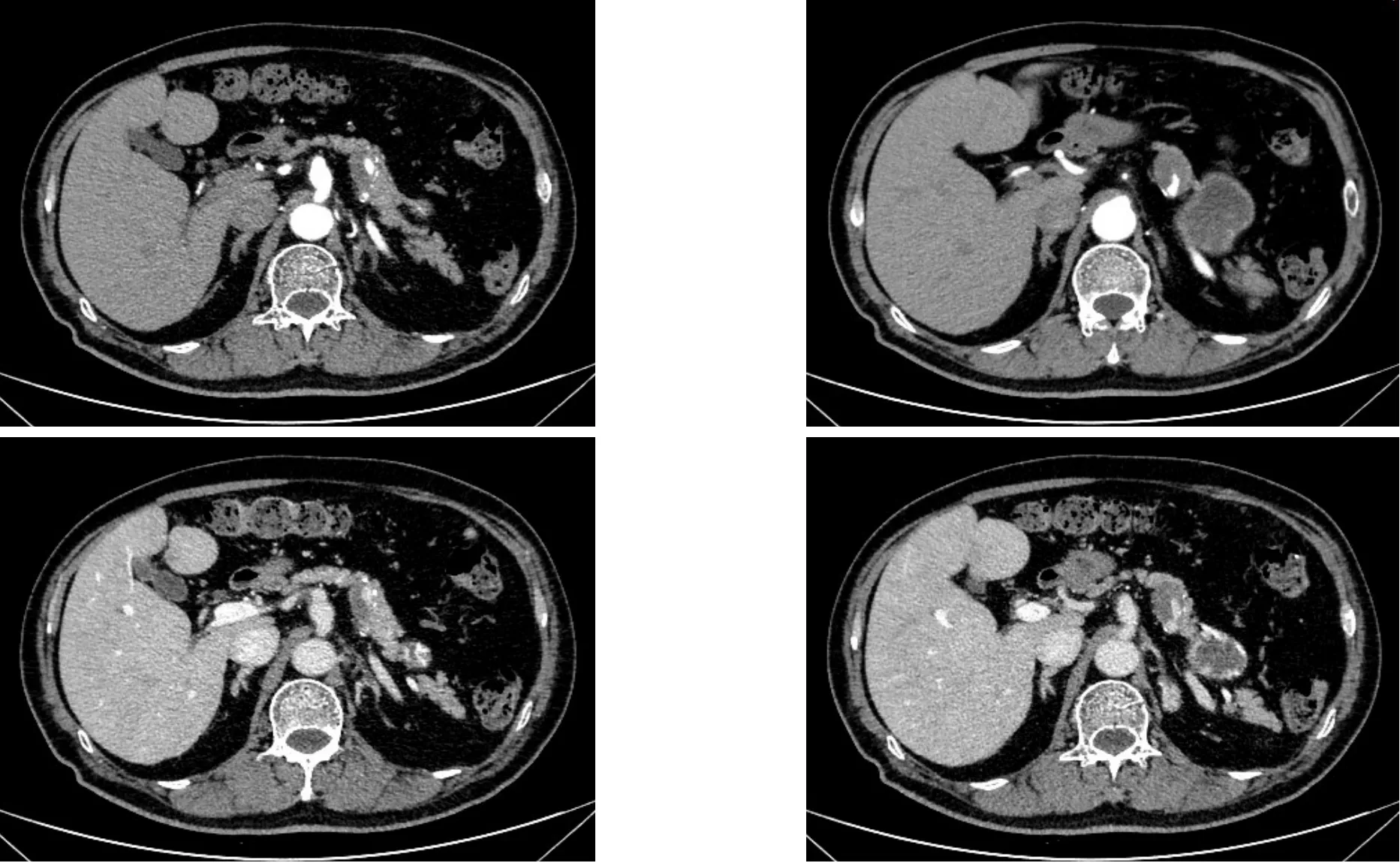
图1 胰腺CT增强和胰腺CTA、CTV影像胰尾区可见类圆形稍低密度灶,增强后大小约27 mm×33 mm,增强后呈明显延迟强化

图2 MRI的T2与T1影像胰尾区可见类圆形稍长T1和稍长T2信号灶,大小约27 mm×33 mm,DWI呈稍高信号灶,ADC呈低值,增强后可见不均匀强化

图3 术后病理图片A:显微镜下见大量泡沫样组织细胞瘤样增生、聚集,间质纤维化(HE×100);B:少量组织细胞内可见浆细胞、淋巴细胞及粒细胞被吞噬现象(HE×400);C:CD68免疫组化染色呈阳性(×100);D:可见S-100免疫组化染色部分阳性(×100)
1.2 文献资料
胰腺RDD极为罕见,因此病例报道数量非常少。通过检索中英文数据库发现,11例报道来自国外,1例来自中国台湾[8,12,14-25](表1)。

表1 胰腺RDD病例文献报道
2 讨论
查阅自1990年至今文献发现,87.3%的患者有颈部淋巴结肿大[12]。Gaitonde等[13]发现仅23%的患者出现淋巴结外表现,而消化系统受累出现胃肠道症状的不足1%。胰腺相关病例文献回顾发现,胰腺RDD发病例数女性多于男性(11∶1),这与其他系统RDD的病例报道不一致,此结论可能与现有报道病例数有限有关,有待日后进一步验证。在12例累及胰腺的RDD中,7例患者同时有2个或多个部位受累,常见的受累部位有脊髓、肝脏、胸腺、眼、结肠等。12例患者中有9例行手术治疗,切除了病变的胰腺,2例患者接受药物治疗,1例患者治疗情况不详。
在一些非典型的病例中,淋巴结外型的RDD与各种恶性肿瘤的临床表现和影像学表现极为相似,借助影像学难以确诊。有文献[22]报道尝试使用细针细胞穿刺用于诊断RDD,但对于淋巴结外型RDD较为困难。淋巴结外型的RDD通常组织比较致密,细针穿刺后组织较少,难以获得典型的Rosai-Dorfman组织细胞。RDD的实验室检查通常无特异度,文献[26]报道RDD是由细胞因子介导的单核细胞迁移至细胞或组织并积累所致,因此,病理及免疫组化检查是目前诊断RDD的金标准。RDD组织通常被淋巴细胞和浆细胞所浸润,在HE染色的光镜下可见淋巴细胞的特征性表现“伸入运动”或吞噬现象,RDD组织中的细胞胞质空泡中具有浆细胞和淋巴细胞,而这些能保护浆细胞和淋巴细胞不被细胞溶解酶降解,免疫组化中可见CD68(+)、S-100(+)和CD1a(-)[27]。有文献[28]报道RDD的病例中,CD68可呈阴性,CD1a可呈弱阳性,因此S-100(+)更具有特征性的诊断意义。本例患者S-100(部分+),CD68(+),同时发现送检的胰尾组织见大量泡沫样组织细胞瘤样增生、聚集,间质纤维化,少量组织细胞内可见浆细胞、淋巴细胞及粒细胞被吞噬现象。未做CD1a染色的情况下,CD68(+)和S-100(部分+)提示组织细胞增殖反应较强。同时血清检测IgG4/IgG比率较低,进一步说明表达IgG,能排除IgG4相关疾病,因此本例符合胰尾RDD的诊断。
CT和MRI对于胰腺RDD具有一定的诊断价值,但无法与胰腺肿瘤进行区分。CT能描述RDD肿块的具体位置,MRI在T2WI上可见高或中等信号,似胰腺肿瘤表现,能帮助区分是否有邻近血管或胰管侵犯[29]。本例患者CT显示胰腺RDD位于胰尾区,呈类圆形稍低密度灶,与边界欠清增强后大小约27 mm×33 mm,增强后延迟明显强化。MRI T2WI胰尾区肿块呈中等信号灶,类圆形大小约27 mm×33 mm,DWI高信号,ADC呈低值。综合CT及MRI等,在尚未得到病例及免疫组化的情况下胰腺恶性肿瘤不能排除。总体来说胰腺的RDD诊断难度较大,需借助更多的检查技术进行联合诊断才能进行鉴别。
尽管RDD被认为是一种良性疾病,但预后需根据疾病部位而定,据文献[12]报道发现在病程为1年以上的238例RDD患者中,约20%的患者经过治疗后可完全好转,但有4例患者死于RDD,持续随访发现13例患者死于RDD所致相关性疾病。虽然RDD通常具有自限性,50%的病例可以缓解,但RDD的病程无法预知,有些患者仅表现为淋巴结肿大,随之自发消退;而有些患者出现免疫异常,淋巴结增生甚至导致死亡,还有一些患者病程长期处于缓解-复发循环之间[30]。还有文献[31]报道散发的RDD并发感染、淀粉样变性等并发症时,可导致10%的患者死亡。对于单发能切除的RDD建议行手术切除,而多灶性不可切除的、合并其部位侵犯的RDD可能需要全身治疗,但目前无标准化方案,建议的治疗方法包括激素治疗、化学治疗,免疫抑制治疗等[32]。
本文对结合相关病例并回顾性分析了文献报道的12例胰腺RDD病例,其中大部分都累及2个或2个以上部位,单发胰腺的RDD鲜有报道。胰腺RDD的治疗根据病情的表现和严重程度而定,但单发的淋巴结外型的胰腺RDD行手术切除是目前公认的治疗方案。尽管目前影像学已经取得很大进步,但仍无法鉴别胰腺RDD和胰腺恶性肿瘤,还需结合病理及免疫组化检查等检查技术进行联合诊断进行诊断、鉴别。本病例发现胰腺占位无法排除恶性肿瘤的前提下行胰尾切除术,并取得较好效果,虽符合目前的诊疗宗旨,但若怀疑或发现胰腺占位,应仔细与鉴别其良恶性以指导后续治疗。
利益冲突:所有作者均声明不存在利益冲突。
