腹腔镜胰十二指肠切除术疗效与安全性的单中心回顾性分析
2022-04-07冯道夫李琪沙元朴李楠杨学武田伟军
冯道夫,李琪,沙元朴,李楠,杨学武,田伟军
(天津医科大学总医院普通外科,天津300052)
胰十二指肠切除术(pancreatoduodenectomy,PD)已被普遍认为是外科手术根治胰头部肿瘤、胆总管远端肿瘤、壶腹周围恶性肿瘤的主要方法。1898年Codivilla第一次描述该术式,1935—1940年Whipple等进一步规范手术流程,提出一期完成手术的方案,这一改进使得患者术后的并发症及病死率大大降低[1]。近年来,随着微创外科、快速康复等先进理念的引入,外科医生更加期望通过微创的手术方式完成这一复杂且具有挑战性的手术,同时获得更短的恢复时间,达到良好的肿瘤治疗效果[2]。随着微创外科技术不断发展,不仅使得手术视野清晰,而且极大减轻术后患者的疼痛感,让伤口外观看起来更加美观,因此其广泛应用于腹部外科治疗。Gagner于1994年第一次完成腹腔镜胰十二指肠切除术(LPD),随着该术式在我国的逐渐推广,卢榜裕等[3]作为开拓者也成功实施该手术,开创了中国实施LPD的先河。LPD需要外科医师同时具备开腹胰十二指肠切除(open pancreatoduodenectomy,OPD)经验以及熟练的腹腔镜技术。
PD作为普外科最具挑战性的手术,其手术方式一直存在广泛争议,有学者[4-5]认为采用腹腔镜技术实施该手术完全可以达到与开腹手术相同的肿瘤学根治效果,并且术后恢复时间明显缩短;反之,部分学者[6]则认为LPD比OPD的手术病死率及并发症发生率更高,而且手术时间较长。因此目前LPD术式大多在水平相对较高的医院实施,并未得到普遍推广。笔者回顾性分析本中心近年来实施PD的患者资料,将LPD患者与OPD患者相关临床数据进行比较,进一步评价LPD的近期疗效与安全性,为临床推广LPD提供一定的理论基础和参考指标。
1 资料与方法
1.1 研究对象
收集2019年2月—2021年9月就诊于天津医科大学总医院普通外科行PD术患者的临床资料进行回顾性分析。纳入标准:⑴术前经过影像学或内镜检查初步诊断为壶腹周围、十二指肠、胆管下端或胰头部肿瘤;⑵一般状况可,美国东部肿瘤协助组(Eastern Cooperative Oncology Group,ECOG)评分为0或1分,无心、肝、肺、肾、脑等重要器官功能障碍;⑶年龄18~75岁,术前完善手术风险告知并签字同意。排除标准:⑴需要行胰体尾切除,胰腺中段切除或全胰切除,而非PD手术;⑵术前评估存在远处转移或有动脉侵犯的患者;⑶无法耐受手术者;⑷术中探查发现无法行根治性手术而实施姑息手术的患者;⑸同时发现其他部位有恶性肿瘤;⑹怀孕患者;⑺接受新辅助治疗患者;⑻ASA评分超过4分。
1.2 手术方法
1.2.1 术前准备术前完善血常规、血生化、电解质、凝血功能、肿瘤标志物、胸腹部增强CT、MR、心脏彩超、肺功能等检查,询问既往有无腹部手术史,有无心肺等重要脏器疾患,充分评估患者一般状况,必要时术前行多学科会诊进一步明确肿瘤位置,以及有无重要血管侵犯,向患者家属交代具体的手术方式及术后可能出现的并发症,为手术提前做好充分准备。
1.2.2 手术操作LPD组建立气腹,采用“五孔法”分布置入穿刺套管,从脐孔将腹腔镜经套鞘插入腹腔。并于左右侧腹分别行小切口置入另外4枚锥鞘。采用“双主刀”模式进行手术操作[7]。OPD组使用手术刀及电刀沿前正中线依次切开皮肤、皮下组织。入腹探查:探查发现腹腔、盆腔无远处转移。游离并清扫淋巴结:打开Kocher切口,将结肠肝曲进行游离,完全游离十二指肠,打开胃结肠韧带,使用切割吻合器离断远端胃,清扫第8组淋巴结,解剖肝十二指肠韧带,清扫第12组淋巴结。通过术前三维重建,明确肝动脉是否存在变异,小心游离肝固有动脉。于十二指肠上横行切断胆总管,近端动脉夹夹闭,远端结扎。清扫周围淋巴结,距Treitz韧带10 cm处离断空肠,离断近端空肠系膜,将近侧空肠自系膜后引入右上腹。钝性游离肠系膜上静脉-门静脉与胰颈部之间隙,打通胰后隧道后,提拉带贯穿胰后隧道,提起胰腺颈部,沿肠系膜上静脉-门静脉走行电刀纵行切断胰腺,分次分离、结扎后剪断肠系膜上静脉右后侧向胰头部之分支,向内侧翻转肠系膜上静脉-门静脉,可见肠系膜上动脉,切开动脉鞘,沿其右侧缘离断向胰头及钩突部之分支,移出标本。采用Child法行消化道重建,即行胰腺-空肠吻合、胆管-空肠吻合、胃-空肠吻合,吻合毕,观察各吻合口无张力,通畅,无扭曲。大量温蒸馏水清洗腹腔,于胰肠吻合口及胆肠吻合口上、下处置入引流管。左侧引流管主要经过胃肠吻合口后方,放置在胰肠吻合口的前下方;右侧引流管经过胆肠吻合口,放置在胰肠吻合口的后上方。
1.3 术后快速康复管理
术后第1天拔除尿管、胃管,嘱患者试饮水,予补液、抗感染、止痛、抑酶等对症支持治疗,并予以开塞露塞肛,鼓励患者尽早下床活动。术后第3天留取双侧引流液,若无明显腹痛、腹胀不适,嘱患者进流食并逐步过渡至正常饮食,早期可通过鼻肠营养管持续提供肠内营养,定期复查血常规、血生化、电解质等检查,必要时适当补充白蛋白,纠正水电解质紊乱。
1.4 观察指标
术前指标:包括年龄、性别、体质量指数(BMI)、白蛋白、胆红素、肿瘤标志物等;术中指标:包括输血率、出血量、病灶大小、淋巴结清扫数、淋巴结阳性率、手术时间等;术后指标:住院时间、术后第3天引流液淀粉酶含量、并发症发生率、病理类型、并发症分级。
1.5 术后并发症评价标准及处理方案
术后主要并发症包括胰瘘、胆汁漏、肠瘘、出血、肠梗阻、胃排空障碍、腹腔感染、二次手术以及死亡。采用Clavien-Dindo并发症分级系统对PD患者术后情况进行分级[8]。术后胰瘘(postoperative pancreatic fistula,POPF)分级标准采用国际胰瘘研究组(the international study group of pancreatic fistula,ISGPF)对胰瘘进行的定义[9]。A级胰瘘的处理主要需进行充分引流,并予以生长抑素抑制胰液分泌。B或C级胰瘘需要立即干预,进行液体复苏,一般先进行介入处理,如果介入效果不理想,应立即行二次手术[10]。术后引流管引流出胆汁样液体,或患者出现局限性腹膜炎,复查B超发现术区积液,行腹腔穿刺引流,引流液呈胆汁样液体,以上均可诊断为术后胆汁漏发生,若胆汁漏引起患者发热、腹痛等症状,应积极通畅引流并予抗感染治疗,适当补充白蛋白减轻吻合口水肿,促进组织生长加固吻合。PD术后胃排空障碍也较为常见,据文献[11]报道其发病率为7%~45%。根据国际胰腺小组对其定义为:⑴术后需留置胃管时间超过3 d;⑵拔管后因呕吐等原因需再次置管;⑶术后7 d仍不能进食固体食物。胃瘫的患者主要需要足够的时间进行空肠营养处理,观察胃液的量,必要时可进行消化道造影或内镜治疗。
1.6 统计学处理
用SPSS 25.0统计软件进行数据统计和比较分析。计数资料采用例数(百分比)[n(%)]形式表示,组间比较采用χ2检验;计量资料采用均数±标准差(±s)或中位数(四分位间距)[M(IQR)]的形式表示,组间采用独立样本t检验或秩和检验进行比较分析。所有P值均为双侧检验的结果,检验水准α=0.05。
2 结果
2.1 患者一般资料
共纳入160例患者,其中57例行LPD(LPD组),103例行OPD(OPD组)。LPD组与OPD组患者的平均年龄、性别构成、术前BMI、肿瘤标志物水平以及术前检验指标方面差异均无统计学意义(均P>0.05)(表1)。
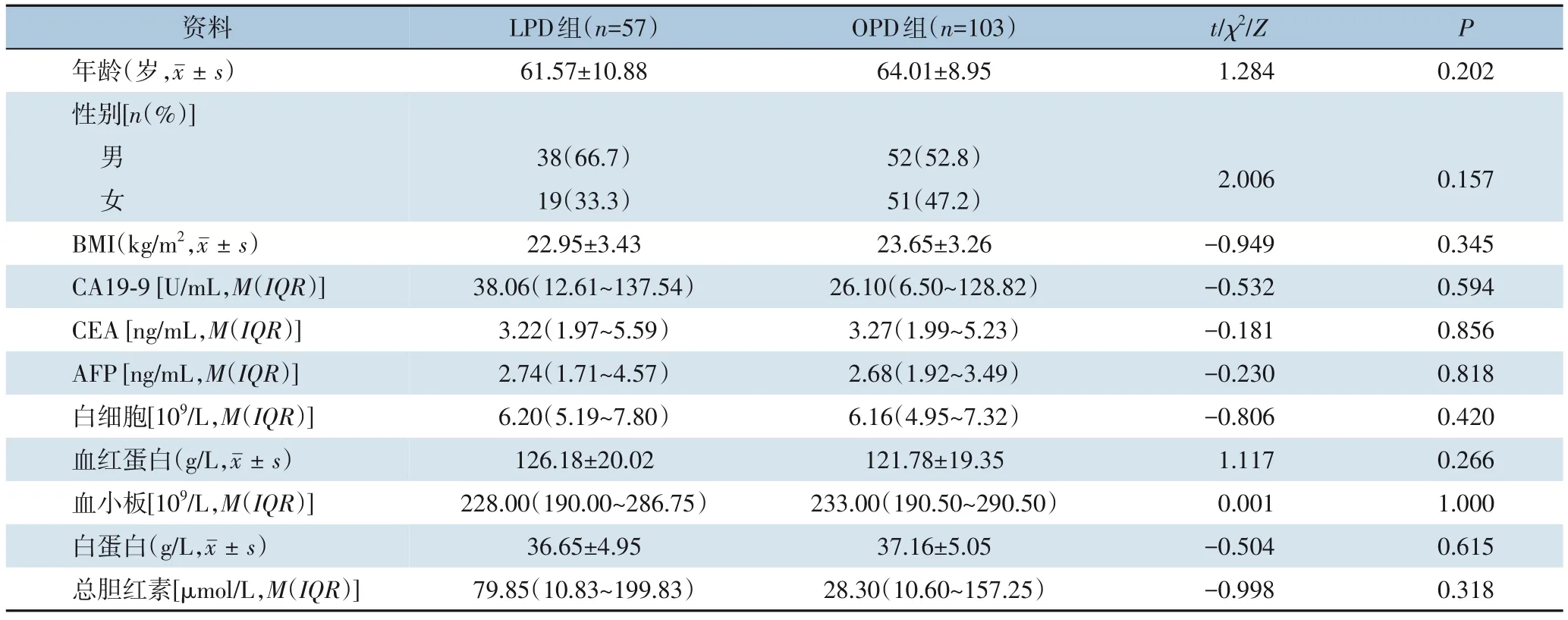
表1 LPD组与OPD组患者一般资料Table 1 The general data of patients in LPD group and OPD group
2.2 LPD组与OPD组术中资料比较
术中探查发现LPD组病灶大小为2.5(2.0~3.5)cm,OPD组病灶大小为3(2.0~5.0)cm,差异无统计学意义(P=0.575);LPD组手术时间长于OPD组(P<0.05),但两组的术中出血量与输血率差异均无统计学意义(均P>0.05)(表2)。

表2 LPD组与OPD组患者术中资料比较Table 2 Comparison of theintraoperativevariablesbetween patientsin LPD group and OPD group
2.3 BMI对手术操作的影响
根据中国标准,BMI超过24 kg/m2,即为超重。故以BMI 24 kg/m2为分界,分析BMI与术中临床资料的关系,结果显示,BMI对两种术式的术中出血量、输血率以及手术时间均无明显影响(均P>0.05)(表3)。

表3 不同BMI患者与术中资料比较Table 3 Comparison of theintraoperativevariablesbetween patientswith different BMIvalues
2.4 LPD组与OPD组术后资料比较
LPD组术后住院时间为12(8~26)d,OPD组为27(17~45)d,两组间差异有统计学意义(P<0.001)。两组术后第3天淀粉酶水平差异无统计学意义(P>0.05)。术后病理方面,两组的病理类型、淋巴结清扫数及阳性淋巴结数差异均无统计学意义(均P>0.05)。两组在术后胰瘘、胆汁漏、腹腔感染、出血、肠瘘、二次手术及死亡等方面的差异均无统计学意义(均P>0.05),LPD组胃排空障碍发生率明显低于OPD组(5.6%vs.33.7%,P=0.002)(表4)。
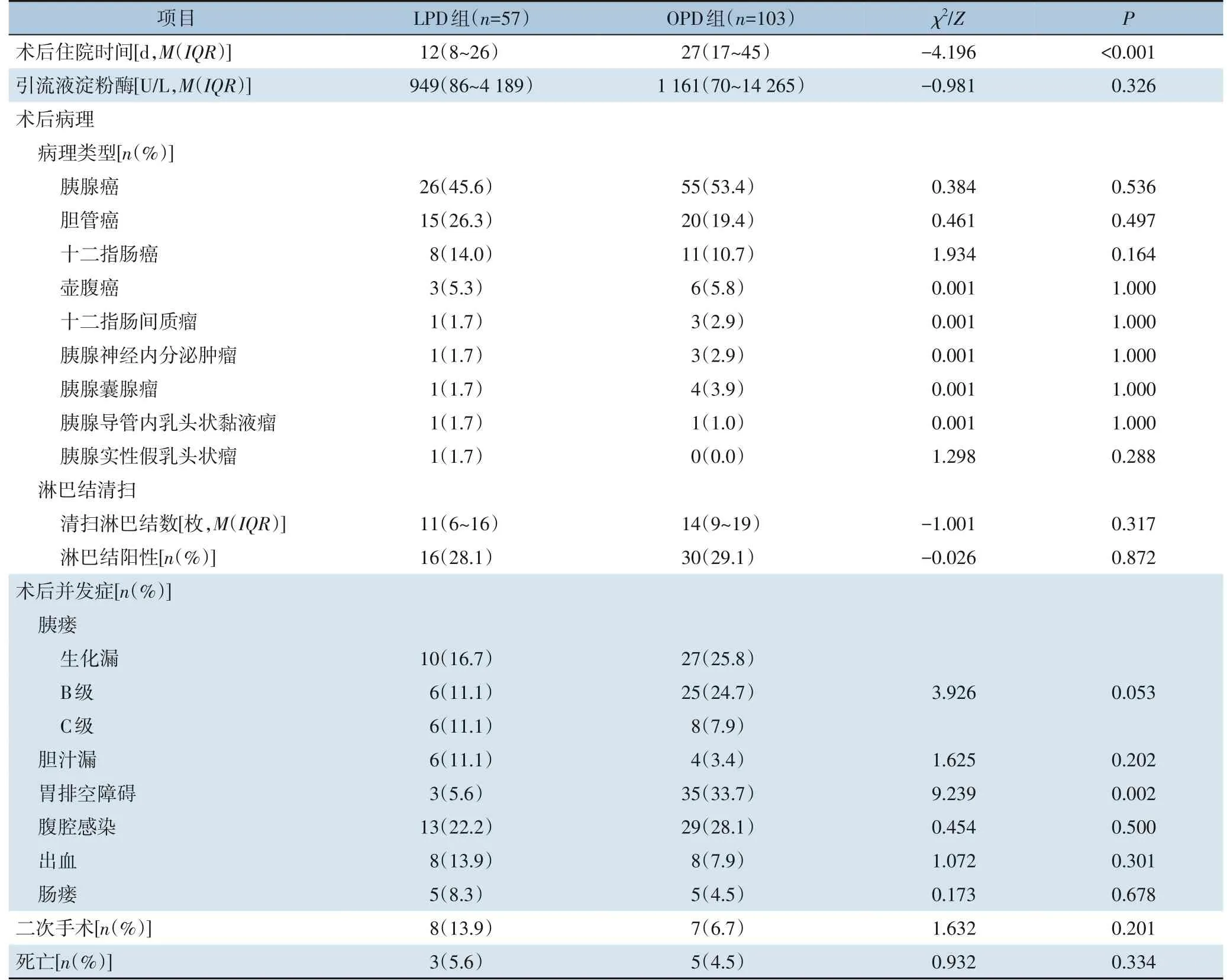
表4 LPD组与OPD组患者术后资料比较Table 4 Comparison of the postoperativedata between patientsin LPD group and OPD group
2.5 LPD组与OPD组中门静脉切除重建患者的资料比较
PD术中探查发现需要在完整切除病灶基础上进行门静脉重建时,LPD组与OPD组均成功完成了血管重建,共完成20例,其中OPD组12例,LPD组8例。LPD组与OPD组门静脉重建患者比较,前者在手术时间和住院时间方面均长于后者,出血量大于后者(均P<0.05)(表5)。
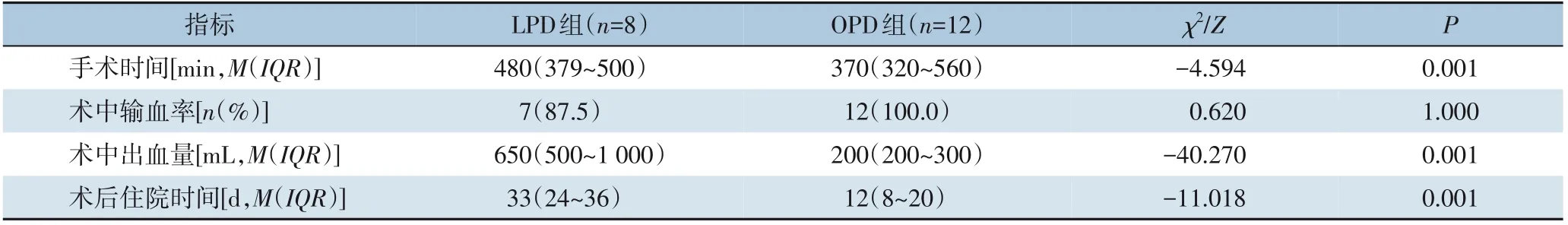
表5 LPD组与OPD组门静脉切除重建患者术中、术后资料比较Table 5 Comparison of the intra-and postoperative data between patientsundergoing portal vein resection and reconstruction LPDgroup and OPDgroup
3 讨论
PD是一种非常具有挑战性的手术,因为胰腺位置深处腹膜后区域,并且周围存在重要血管,造成术中暴露病灶相对困难;再者,其涉及复杂的消化道重建,包括胰管-空肠吻合、胆管-空肠吻合、胃-空肠吻合,这些对手术医师的技术要求较高。近年来,随着腹腔镜技术在消化道系统的应用日益成熟[12]。3D腹腔镜的应用与能量平台的充分发挥,无论是在手术的精细操作方面,还是淋巴结清扫方面(包括血管的骨骼化以及海德堡三角的清扫),能够充分体现腹腔镜所带来的优势。但其需要达到一定的学习曲线,且与术者的熟练程度以及是否存在血管或胰腺组织变异有关[5,13-15],Al-Taan等[16]认为,虽然LPD手术复杂并且时间可能相对较长,但富有经验的外科医生完全可以安全地完成手术,在学习曲线初期,因为手术操作的熟练度不够以及解剖层次的把控,LPD往往需要更多的手术时间来完成,这就意味着患者可能面临更多的风险。本研究中采取“双主刀”模式进行LPD,结果显示,虽然LPD组手术时间更长,但两组术中输血率、术中出血量无明显差异,并且术中淋巴结清扫以及术后并发症发生率方面两者并无明显差异,这与国内外大多数研究结果基本一致,充分体现腹腔镜手术的安全性及“双主刀”模式的优势。同时,本研究也发现,BMI不会影响手术操作难度。
PD术后并发症一直是研究者关注的热点[17-24],本研究结果显示LPD组与OPD组术后并发症胰瘘、胆汁漏、腹腔感染、出血、肠瘘、二次手术及死亡等方面的发生率差异无统计学意义,但LPD组胃排空障碍发生率显著低于OPD组,与其他研究结果一致[25-27],也体现腹腔镜的微创优势。两组淋巴结清扫范围与淋巴结阳性比例,均无显著性差异,且病理回报均为R0切除。但LPD组在与OPD组获得相同的肿瘤根治效果同时,还具有其独特优势,3D腹腔镜视野能够更好地分辨组织结构,并具有放大视野的效果,尤其是钩突部与肠系膜血管之间的关系。本研究中,LPD组术后住院时间较OPD组明显缩短,开腹手术因创伤较大,包括腹部切口大与拉钩的牵引副损伤,所以患者恢复时间也相对较长。
近年来,很多学者[28-33]开始尝试在腹腔镜下进行血管切除与重建,Geers等[34]对26例胰腺癌患者实施了联合血管切除重建的LPD,中位手术时间为340 min,R0切除率为81%,术后仅1例患者因术后第1天肺静脉血栓形成再次行手术干预,证明LPD联合血管切除重建治疗胰腺癌具有安全性,但以上研究鲜有提到长期静脉通畅性的随访结果。为了更好地在腹腔镜下完成血管重建,外科医师需要在独立完成OPD的基础上兼具娴熟的腹腔镜技术,术后还需要关注静脉通畅性。Dokmak等[35]使用壁腹膜作为静脉补片,报道了术后1年的静脉通畅率为50%,提出若患者出院后没有出现剧烈腹痛、憋气等血栓形成症状,没有必要进行与静脉血栓形成相关的干预治疗。本研究LPD组中有8例进行了联合静脉切除重建并获得成功,OPD组完成了12例门静脉切除重建。LPD组手术时间长于OPD组,术中出血量多于OPD组,这与腹腔镜下使用器械血管吻合困难密不可分。两组手术预后差异无统计学意义。对于腹腔镜操作较为熟练的术者而言,联合静脉切除重建的LPD是安全可行的。
本研究具有一定的局限性,包括疾病的异质性以及仅在单中心开展回顾性分析。此外,因为统计的是近2年的病例,因此,对于胰腺癌患者分析5年生存率还为时过早。未来仍需开展LPD与OPD安全性、有效性对比的大型前瞻性临床研究。
综上所述,LPD与OPD具有相同的近期疗效和安全性,并且LPD在术后住院时间、术后并发症胃排空障碍发生率方面显著优于OPD。但LPD手术时间更长,尤其在需进行血管重建时,术中出血量更大,术后住院时间更长。因此,其对术者手术操作技术上要求较高,这也给了外科医师极大动力去进一步探索并规范化这一复杂术式,使更多患者因此受益。
利益冲突:所有作者均声明不存在利益冲突。
