青藤碱抑制胰腺癌细胞迁移和侵袭及其与NF-κB信号通路的关系
2022-04-07陈伟毅洪炼哲彭靖陈延唐峰陈立军
陈伟毅,洪炼哲,彭靖,陈延,唐峰,陈立军
(1.常德职业技术学院,湖南常德415000;2.湖南医药学院,湖南怀化418000)
胰腺癌是一种常见的恶性程度极高的消化系统肿瘤,起病隐匿,进展迅速,预后很差[1-2]。据统计[3-4],胰腺癌患者5年生存率不超过8%,平均中位生存期短于6个月。化疗是主要治疗方法之一,但胰腺癌化疗耐药性很高,治疗效果很不理想[5-6]。因此,寻找新的高靶向性药物,提高胰腺癌的化疗效果,是目前治疗胰腺癌的紧迫需要。
青藤碱(sinomenine)是从防己科防己属植物青风藤及毛青藤的干燥藤茎中提取的生物碱单体,具有镇痛、抗炎、免疫抑制等药理作用[7]。多篇文献[8-10]报道青藤碱可以抑制肺癌、乳腺癌、胃癌等肿瘤细胞的转移,但对胰腺癌的作用尚未明确。本研究从核因子κB(NF-κB)信号通路探讨青藤碱对胰腺癌Capan-1细胞迁移和侵袭的影响,为青藤碱应用于临床抗胰腺癌治疗提供理论依据,并为研究青藤碱抗肿瘤作用机制提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 药物与试剂盐酸青藤碱(湖南正清制药有限公司,纯度>98%),DMEM、胎牛血清(美国Gibco公司),Matrigel基质胶(美国BD公司),结晶紫染色试剂(上海碧云天生物技术公司),Transwell小室(美国Corning公司),Histone H3 antibody、NF-κB p65 antibody、ICAM-1 antibody、VCAM-1 antibody、β-actin(货号分别为9715、4764、4915、32653、4970,美国CST公司)。
1.1.2 仪器CB060型CO2细胞培养箱(德国Binder公司),BX63型荧光显微镜(日本Olympus公司),AE2000型光学倒置显微镜(美国Motic公司),Mini-PROTEAN Tetra型聚丙烯酰胺垂直电泳系统、ChemiDoc XRS+型凝胶成像系统(美国Bio-Rad公司)。
1.2 实验方法
1.2.1 细胞及培养人胰腺癌Capan-1细胞购于中科院上海细胞库,用含有10%胎牛血清的DMEM,培养于37℃、5%CO2孵箱中,每48 h用0.25%的胰酶消化传代进行后续实验。
1.2.2 细胞处理取对数生长期的胰腺癌Capan-1细胞,分别用3个浓度青藤碱(400、800、1 600 mg/L)处理[7],或用青藤碱1 600 mg/L+TNF-α20 mg/L处理,以无处理的Capan-1细胞作为对照。
1.2.3 划痕愈合实验检测细胞迁移率将对数生长期的Capan-1细胞以每孔5×105/mL,2 mL/孔接种在6孔板中,常规培养细胞达到80%融合状态,弃DMEM,PBS洗3次,用含有1%胎牛血清的DMEM培养细胞,使细胞饥饿过夜,弃掉DMEM,PBS再洗3次,用无菌的10μL Tip头在6孔板的底部划一字形痕,根据实验分组加入含有不同浓度的青藤碱、TNF-α和1%胎牛血清的DMEM,在37℃、5%CO2细胞培养箱继续培养,于0、16 h拍照,采用Image J软件计算细胞迁移率=(0 h划痕距离-16 h划痕距离)/0 h划痕距离×100%。
1.2.4 Transwell实验检测迁移细胞数和侵袭细胞数迁移实验:取对数生长期的Capan-1细胞,用不含有胎牛血清的DMEM配制成浓度为5×105/mL的单细胞悬液,取200μL悬液加入Transwell小室上室,下室加入600μL含10%胎牛血清和不同浓度青藤碱、TNF-α的DMEM,放入37℃、5%CO2细胞培养箱中培养24 h。取出小室,用PBS洗3次,晾干,固定染色,采用Image J软件计算细胞数。侵袭实验:将Matrigel基质胶与无胎牛血清的DMEM按1∶8比例混合,取100μL平铺于小室上室中,在细胞培养箱中温育4~5 h,使其凝固成胶状,后续操作步骤与迁移实验一致。
1.2.5 Western blot检测蛋白表达分别提取细胞核蛋白、细胞浆蛋白和细胞总蛋白,采用BCA法测量蛋白浓度,每组取50μg蛋白样品进行聚丙烯酰胺凝胶电泳,然后将蛋白转移到NC膜上,封闭后加入一抗4℃过夜,再加入二抗孵育2 h,曝光显影,以β-actin、Histon H3为内参,检测蛋白相对表达量,采用Quantity one软件分析数据。
1.3 统计学处理
采用SPSS 26.0软件进行统计分析,实验数据均以均数±标准差(±s)表示,组间比较采用ANOVA进行统计学检验,P<0.05为差异有统计学意义。
2 结果
2.1 青藤碱对胰腺癌Capan-1细胞迁移的影响
采用划痕愈合实验检测不同浓度青藤碱作用Capan-1细胞后细胞迁移率,结果显示,孵育16 h后,对照组与低、中、高浓度青藤碱处理组的细胞迁移率分别为(26.70±1.34)%、(18.75±2.05)%、(12.50±1.23)%、(12.12±1.08)%,与对照组比较,3个浓度青藤碱处理组的细胞迁移率均明显降低(P<0.05或P<0.01)(图1)。采用Transwell实验检测不同浓度青藤碱作用Capan-1细胞后迁移细胞数,结果显示:孵育24 h后,对照组与低、中、高浓度青藤碱处理组的迁移细胞数分别为(414±26)、(338±34)、(286±20)、(207±18)个,与对照组比较,3个浓度青藤碱处理组的迁移细胞数均明显减少(P<0.05或P<0.01)(图2)。

图1 青藤碱对胰腺癌Capan-1细胞迁移率影响Figure 1 Influence of sinomenine on migration rate of pancreatic cancer Capan-1 cells
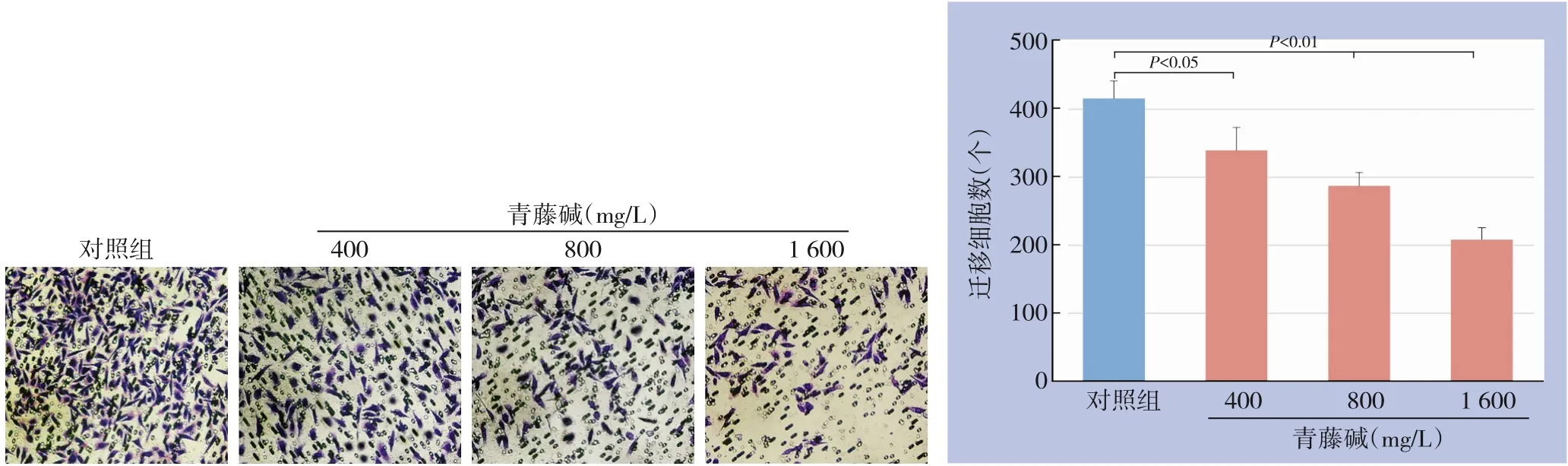
图2 青藤碱对胰腺癌Capan-1迁移细胞的影响Figure2 Influenceof sinomenineon migration number of pancreatic cancer Capan-1 cells
2.2 青藤碱对胰腺癌Capan-1细胞侵袭的影响
采用Transwell实验检测不同浓度青藤碱作用Capan-1细胞后侵袭细胞数,结果显示,孵育24 h后,对照组与低、中、高浓度青藤碱处理组的侵袭细胞数分别为(211±17)、(168±11)、(139±14)、(118±12)个,与对照组比较,3个浓度青藤碱处理组的侵袭细胞数均明显减少(P<0.05或P<0.01)(图3)。

图3 青藤碱对胰腺癌Capan-1细胞侵袭力的影响Figure 3 Influence of sinomenine on invasion ability of pancreatic cancer Capan-1 cells
2.3 青藤碱对胰腺癌Capan-1细胞NF-κB信号通路的影响
采用Western blot检测不同浓度青藤碱作用Capan-1细胞后细胞浆、细胞核NF-κB蛋白的表达,结果显示,孵育24 h后,对照组与低、中、高浓度青藤碱处理组细胞浆NF-κB蛋白表达量分别为0.54±0.026、0.68±0.035、0.73±0.048、0.76±0.041;细胞核NF-κB蛋白表达量分别为1.46±0.036、1.29±0.042、1.13±0.029、1.02±0.021,与对照组比较,3个浓度青藤碱处理组细胞浆NF-κB蛋白表达量均明显上调,而细胞核NF-κB蛋白表达量均明显下调(P<0.05或P<0.01)(图4)。
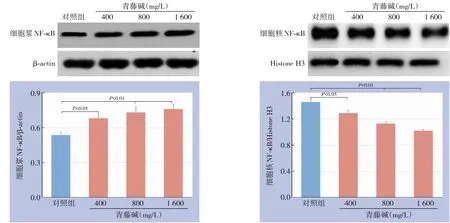
图4 青藤碱对胰腺癌Capan-1细胞NF-κB信号通路的影响Figure 4 Influenceof sinomenineon NF-κBsignaling pathway in pancreatic cancer Capan-1 cells
2.4 青藤碱对胰腺癌Capan-1细胞ICAM-1、VCAM-1表达的影响
采用Western blot检测不同浓度青藤碱作用Capan-1细胞后ICAM-1、VCAM-1的表达,结果显示,孵育24 h后,中、高浓度青藤碱作用Capan-1细胞24 h后,ICAM-1、VCAM-1表达明显下降,与对照组有明显差异(P<0.05或P<0.01)(图5)。
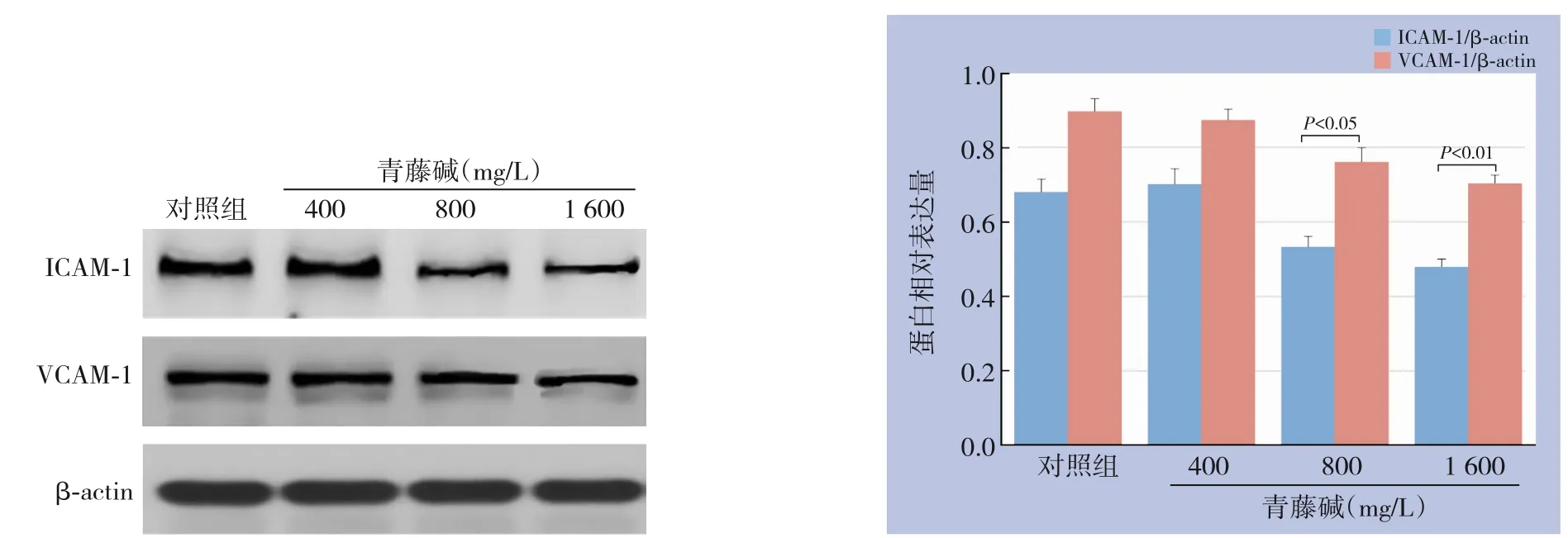
图5 青藤碱对胰腺癌Capan-1细胞ICAM-1、VCAM-1的表达的影响Figure5 Influenceof sinomenineon expressionsof ICAM-1 and VCAM-1 in pancreatic cancer Capan-1 cells
2.5 TNF-α逆转青藤碱对胰腺癌Capan-1细胞迁移的抑制作用
TNF-α是NF-κB信号通路激活剂,为了明确NF-κB信号通路是否介导了青藤碱对胰腺癌Capan-1细胞迁移的抑制作用,采用划痕愈合实验检测TNF-α和青藤碱作用Capan-1细胞后细胞迁移率。结果显示:青藤碱1 600 mg/L组细胞迁移率低于对照组(P<0.01),青藤碱1 600 mg/L+TNF-α20 mg/L组细胞迁移率高于青藤碱1 600 mg/L组(P<0.05)(图6)。为了明确NF-κB信号通路是否介导了青藤碱对胰腺癌Capan-1细胞迁移的抑制作用,采用Transwell实验检测TNF-α和青藤碱作用Capan-1细胞后迁移细胞数,结果显示,青藤碱1 600 mg/L组迁移细胞数低于对照组(P<0.01),青藤碱1 600 mg/L+TNF-α20 mg/L组迁移细胞数高于青藤碱1 600 mg/L组(P<0.05)(图7)。

图6 TNF-α逆转青藤碱对胰腺癌Capan-1细胞迁移率的降低作用Figure 6 Migration rate inhibitory action of sinomenine on Capan-1 cells reversed by TNF-α

图7 TNF-α逆转青藤碱对胰腺癌Capan-1迁移细胞数的降低作用Figure7 Migration number inhibitory action of sinomenineon Capan-1 cellsreversed by TNF-α
2.6 TNF-α逆转青藤碱对胰腺癌Capan-1细胞侵袭的抑制作用
为了明确NF-κB信号通路是否介导了青藤碱对胰腺癌Capan-1细胞侵袭的抑制作用,采用Transwell实验检测TNF-α和青藤碱作用Capan-1细胞后侵袭细胞数。结果显示,青藤碱1 600 mg/L组侵袭细胞数低于对照组(P<0.01),青藤碱1 600 mg/L+TNF-α20 mg/L组侵袭细胞数高于青藤碱1 600 mg/L组(P<0.05)(图8)。

图8 TNF-α逆转青藤碱对胰腺癌Capan-1细胞侵袭的抑制作用Figure8 Invasion inhibitory action of sinomenineon Capan-1 cellsreversed by TNF-α
2.7 TNF-α逆转青藤碱对胰腺癌Capan-1细胞ICAM-1、VCAM-1表达的下调作用
为了明确NF-κB信号通路是否介导了青藤碱对胰腺癌Capan-1细胞ICAM-1、VCAM-1表达的下调作用,采用Western blot实验检测TNF-α和青藤碱作用Capan-1细胞后ICAM-1、VCAM-1的表达。结果显示,青藤碱1 600 mg/L组ICAM-1、VCAM-1表达低于对照组(P<0.01),青藤碱1 600 mg/L+TNF-α20 mg/L组ICAM-1、VCAM-1表达高于青藤碱1 600 mg/L组(均P<0.05)(图9)。

图9 TNF-α逆转青藤碱对胰腺癌Capan-1细胞ICAM-1、VCAM-1表达的下调作用Figure 9 Effectsof sinomenine down-regulating ICAM-1 and VCAM-1 expressions in Capan-1 cells reversed by TNF-α
3 讨论
本研究发现青藤碱通过抑制NF-κB信号通路激活下调ICAM-1、VCAM-1表达,抑制胰腺癌Capan-1细胞迁移和侵袭。通过划痕愈合实验和Transwell实验首先发现青藤碱抑制胰腺癌Capan-1细胞迁移和侵袭。通过Western blot实验发现青藤碱抑制胰腺癌Capan-1细胞NF-κB信号通路激活,下调ICAM-1、VCAM-1表达。为了明确NF-κB信号通路是否介导了青藤碱对胰腺癌Capan-1细胞的作用,采用NF-κB信号通路激活剂TNF-α干预,结果表明TNF-α可以逆转青藤碱对胰腺癌Capan-1细胞迁移和侵袭的抑制作用,以及对ICAM-1、VCAM-1表达的下调作用。因此,笔者认为青藤碱通过抑制NF-κB信号通路下调ICAM-1、VCAM-1表达,抑制胰腺癌Capan-1细胞迁移和侵袭。
现代药理学研究证明,青藤碱具有镇痛、抗炎、免疫抑制、镇静、抗类风湿性关节炎等药理作用[11]。目前已有毛青藤碱片、青藤碱缓释片、盐酸青藤碱注射剂、正清风痛宁片等多种制剂应用于临床,在治疗类风湿性关节炎等各种风湿病以及心律失常取得较好的疗效[12]。Gao等[13]发现青藤碱可以通过调节miR-29/PDCD-4轴来抑制乳腺癌MDA-MB-231细胞的增殖、迁移和侵袭。Xu等[14]发现青藤碱通过降低miR-23a表达抑制前列腺癌P3细胞增殖、迁移和侵袭。Zhao等[15]表明青藤碱通过减少Smad蛋白产生减轻EMT抑制肾透明细胞癌细胞迁移和侵袭。Li等[16]发现青藤碱能以剂量依赖的方式通过调控原癌基因MCM2和Wnt/β-catenin信号通路来抑制卵巢癌细胞IGROV1和HeyA8转移。本研究表明青藤碱通过抑制NF-κB信号通路激活下调ICAM-1、VCAM-1表达,抑制胰腺癌细胞迁移和侵袭。上述证据表明青藤碱具有抗肿瘤活性,可能通过多种途径抑制肿瘤细胞迁移和侵袭,是一种潜在的抗肿瘤药物。
NF-κB是一种真核生物中广泛存在的细胞核转录因子,参与调控多种炎症因子的转录。活化的NF-κB能与多种细胞因子基因的启动子或增强子区NF-κB结合位点特异度结合,调控其转录和表达,进一步影响细胞的周期、衰老、自噬、凋亡、免疫应答和炎症反应等病理生理过程[17]。NF-κB信号通路与肿瘤发生发展中起着很重要的作用,Jain等[18]发现采用脂多糖(lipopolysaccharide,LPS)激活NF-κB信号通路后,可以促进前列腺癌细胞转移,Geng等[19]表明选用RNF183激活NF-κB信号通路后,可以刺激多功能趋化因子IL-8的转录,进而促进大肠癌细胞转移,Sun等[20]认为抑制NFκB信号通路激活可以抑制乳腺癌细胞转移,其机制与减轻EMT有关,He等[21]发现减少NF-κB信号通路激活可以抑制胃癌细胞转移,其原因与下调基质金属蛋白酶MMP-2、MMP-7、MMP-9有关。本研究发现抑制NF-κB信号通路激活可以下调ICAM-1、VCAM-1表达,抑制胰腺癌细胞转移。上述资料表明NF-κB信号通路可以通过调控多种因子、蛋白表达影响肿瘤转移,是抗肿瘤治疗的一个潜在的重要靶点。
青藤碱可以抑制NF-κB信号通路激活,Yao等[22]报道青藤碱可以抑制人成纤维样滑膜细胞NF-κB的表达,减轻炎症反应,Shen等[23]表明青藤碱通过抑制人骨肉瘤MG-63细胞NF-κB信号通路,调节儿童踝关节骨折的炎症反应,Xiong等[24]研究发现青藤碱可以通过抑制结肠黏膜NF-κB信号通路的激活,减少结肠黏膜炎症,治疗实验性结肠炎。而在本研究首先发现青藤碱可以抑制NF-κB信号通路激活,并同时抑制胰腺癌细胞迁移和侵袭。而采用TNF-α激活NF-κB信号通路后,可以逆转青藤碱对胰腺癌细胞迁移和侵袭的抑制作用。
TNF-α是一种具有广泛生物学功能的细胞因子,参与机体多种生理和病理过程[25]。首先TNF-α的表达受NF-κB信号通路的调节,在TNF-α的基因启动子区域有NF-κB结合位点,NF-κB进入细胞核后,可以与TNF-α基因启动子结合,促进TNF-α的表达,引起炎症反应[26]。同时TNF-α是诱导NF-kB活化的重要细胞因子。在TNF-α的作用下,位于细胞质内的NF-κB会与抑制蛋白(inhibitory protein of NF-κB,IκB)解聚分离,从而使NF-κB被释放出来,被释放出来的NF-κB随即从细胞质进入细胞核,又进一步刺激TNF-α等细胞因子的分泌,参与炎症反应,同时通过正反馈作用,进一步激活NF-κB,引起级联反应,促进和扩大炎症反应。阻断NF-κB信号通路后可以显著抑制TNF-α所介导的炎症反应[27]。因此,TNF-α和NF-κB二者相互依赖,相互制约,共同参与机体对各种刺激因素的反应。
黏附分子是细胞在炎症反应过程中所释放的一类糖蛋白分子,包括ICAM-1、VCAM-1等。ICAM-1是人体内广泛分布的一种细胞间黏附分子,它可以介导细胞和细胞、细胞外基质与细胞的结合和黏附[28]。VCAM-1广泛表达于成纤维细胞、活化内皮细胞、骨髓基质细胞等细胞表面,参与调节炎症反应、细胞和组织的分化、发育、免疫应答等[29]。ICAM-1和VCAM-1在介导肿瘤的转移和侵袭中起着重要作用,有研究[30]表明ICAM-1通过与其受体的特异度结合,使肿瘤细胞之间的黏附力降低,促使肿瘤细胞与血管内皮细胞发生黏附并向血管外基质迁移,介导肿瘤细胞的侵袭和转移。也有研究[31]发现VCAM-1通过与VLA-4相互结合,促进肿瘤细胞与内皮细胞黏附从而增强肿瘤细胞的转移。本研究发现采用青藤碱抑制NF-κB信号通路激活后,可以下调ICAM-1、VCAM-1表达,从而抑制胰腺癌细胞转移,提示青藤碱可能通过调控NF-κB/ICAM-1、VCAM-1通路,增强肿瘤细胞与细胞之间的黏附,减少肿瘤细胞与细胞外基质之间的黏附,从而减少肿瘤细胞的转移。
综上所述,本研究发现青藤碱通过调控NF-κB信号通路下调ICAM-1、VCAM-1表达抑制胰腺癌Capan-1细胞迁移和侵袭,为胰腺癌的治疗找到一种潜在有效药物,并从NF-κB信号通路探讨了青藤碱的抗肿瘤作用,为研究青藤碱抗肿瘤机制提供了新的思路。由于青藤碱是一种中草药,来源广泛、价格低廉、毒副作用少,因此具有良好的开发前景[32]。但本研究只进行了细胞实验而未进行动物实验,青藤碱除了抑制胰腺癌Capa-1细胞外,是否抑制其他胰腺癌细胞系尚未明确,除了通过NF-κB信号通路抑制胰腺癌细胞迁移和侵袭外,是否还有其他通路,还需进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
