地塞米松通过PKA信号通路调控水通道蛋白2的分子机制
2022-04-07朱玲丽杨建环王德选陈敏广
朱玲丽,杨建环,王德选,陈敏广
温州医科大学附属第二医院育英儿童医院 儿童肾内科 温州市儿童泌尿生殖系统疾病重点实验室,浙江 温州 325027
随着新一代利尿剂,即加压素V2受体拮抗剂的问世,水通道蛋白2(aquaporin 2, AQP2)已成为当前的一个研究热点[1]。作为抗利尿激素的主要靶蛋白,AQP2不仅在维持哺乳动物体内水稳态方面起着至关重要的作用,而且在促进肾脏上皮细胞迁移以及维持肾脏结构和功能的完整性方面也起着至关重要的作用,与多囊肾、肾病综合征等多种疾病的发病密切相关[2-3]。目前糖皮质激素(glucocorticoids, GCs)在AQP2调控机制中的作用尚未得到明确[4],但越来越多的研究已证实GCs对AQP2具有显著的调控作用,有研究显示GCs有抑制AQP2作用[5],更多的研究结果则提示GCs对AQP2具有上调效应[6-8],其确切的作用有待进一步明确。目前对GCs调控AQP2的具体机制仍不清楚,针对性的研究很少,有待进一步深入探讨。
作为一种膜蛋白,目前已知蛋白激酶A(protein kinase A, PKA)的活化和AQP2 COOH末端的磷酸化是AQP2实现细胞内转运并发挥生物学作用的关键环节[4,9-14];此外,有研究也证实:在APQ2的调控中,存在除PKA外的其他激酶诱导的磷酸化通路[15]。鉴于GCs与PKA密切相关,二者具有协同作用[16-18],我们推测在AQP2的调控中,GCs很可能与PKA协同发挥作用,其过程依赖于PKA信号通路。为了进一步明确GCs对AQP2的调控作用及其机制,我们以PKA为参照,观察了GCs的代表药物地塞米松(Dex)对体外培养细胞表达AQP2膜蛋白和总蛋白的直接调控效应。同时通过构建独特的AQP2突变质粒(突变了AQP2 C末端4个公认的磷酸化位点),阻断PKA信号通路,评估了Dex的上述调控效应对PKA信号通路的依赖程度。
1 材料和方法
1.1 材料 DMEM培养基、胎牛血清和非血清减血清培养基、脂质体2000购自美国Invitrogen公司;QIAGEN质粒小量提取试剂盒购自德国QIAGEN公司;Dex、赖氨酸购自美国Sigma公司;TNT偶联网织红细胞裂解液系统、PKA催化亚基购自美国Promega公司;蛋白A珠、EZ-Link磺基-N-羟基琥珀酰亚胺二硫化物-生物素、链霉亲和素-琼脂糖珠购自美国Pierce公司。γ-32P ATP购自美国PerkinElmer公司;AQP2、GAPDH抗体购自美国Santa Cruz公司,次生辣根过氧化物酶偶联的山羊抗兔IgG、增强化学发光(ECL)试剂盒购自美国Amersham公司;T7体外转录试剂盒购自美国Ambion公司;PVDF膜购自美国Bio-Rad公司。HEK293细胞、爪蟾卵母细胞和PKA质粒由美国埃默里大学医学院肾脏生理系陈广平教授惠赠。
1.2 方法
1.2.1 质粒构建与扩增:参照cDNA文库,通过RTPCR方法扩增大鼠AQP2 cDNA基因。AQP2基因序列(登录号:NM 012909)设计引物,将限制性内切酶的酶切位点BamHI位点引入正向引物AQP2 a:5’-CGGGAT CCGGAGCAGCATGTGGGAACTCAGATCC-3’,将限制性内切酶的酶切位点XbaI位点:GCTCTAGAGGGAGCTCAGGCCT TGCTGCCGCGG添加到反向引物。用BamHI/XbaI消化,再克隆到哺乳动物表达载体pcDNA3(pcDNA3-AQ2)或卵母细胞表达载体pGH19(pGH19-AQP2)中。通过定点突变使AQP2 C末端4个磷酸化位点突变。所构建质粒通过核苷酸序列分析验证后采用QIAGEN质粒小量提取试剂盒扩增。
1.2.2 AQP2的体外翻译和PKA磷酸化检测:通过TNT偶联网织红细胞裂解液系统与兔网织红细胞裂解液进行AQP2及其突变体的体外翻译。用25 μL网织红细胞裂解液,2 μL 10×反应缓冲液,1 μL 1 mmol/L 氨基酸混合物(不含蛋氨酸),1 μL 1 mmol/L蛋氨酸,1 μg DNA模板(AQP2或AQP2突变体)和1 μL T7 RNA聚合酶,最终体积为50 μL。将混合物在30 ℃ 下孵育45 min。合成的AQP2蛋白通过AQP2抗体和蛋白A珠进行免疫沉淀。沉淀物洗涤后重悬并与 50 μL含1 μL γ-32P ATP和0.5 μL PKA催化亚基或 0.5 μL H2O作为对照,在30 ℃下处理10 min,终止反应,用35 μL Laemmle缓冲液在100 ℃洗脱5 min。 将样品用4%~15% SDS-PAGE凝胶电泳,并通过放射自显影分析蛋白质的磷酸化。用AQP2抗体通过蛋白质印迹(Western blot)法检测AQP2总蛋白表达水平。
1.2.3 细胞培养、转染和干预:HEK293细胞在含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养液中于37°C,5% CO2条件下培养。通过脂质体2000将质粒转染细胞,分成6组,即野生型组,野生型+PKA组,野生型+Dex组,突变型组,突变型+PKA组,突变型+Dex组。干预组分别用Dex (0.1 μmol/L)处理或与pcDNA3-PKA共转染。2 d后,收集细胞行Western blot分析。
1.2.4 细胞表面蛋白生物素化:细胞干预后,将细胞与新鲜制备的1.0 mg/mL EZ-Link磺基-N-羟基琥珀酰亚胺二硫化物-生物素在硼酸盐缓冲液中 4 ℃下孵化30 min,共2遍,后用0.1 mmol/L赖氨酸淬灭生物素反应5 min;PBS洗涤,RIPA缓冲液(含150 mmol/L NaCl,10 mmol/L Tris-HCl,pH 7.5, 1 mmol/L EDTA,1% Triton X-100、1%脱氧胆酸钠,0.1% SDS和蛋白酶抑制剂)裂解,之后与25 μL链霉亲和素-琼脂糖珠在4 ℃室温下温和摇动过夜。次日洗涤后生物素标记的蛋白在35 μL Laemmli样品缓冲液中洗脱,Western blot分析AQP2表达。
1.2.5 细胞裂解和Western blot:收集细胞匀浆;4 ℃ 10 000 r/min离心10 min后,收集上清液。BCA蛋白测定法测定蛋白浓度,行Western blot分析。将蛋白通过10% SDS-PAGE分离,然后电转移到PVDF膜上;5%牛奶/PBST封闭,加入一抗(AQP2抗体)孵育过夜。次日,用二抗(HRP酶偶联的山羊抗兔IgG)孵育1 h,通过ECL试剂盒检测蛋白质。实验使用了以下抗体:AQP2、GAPDH及HRP偶联的山羊抗兔IgG。
1.2.6 爪蟾卵母细胞分离、cRNA制备、显微注射和药物干预:采用T7体外转录试剂盒,用T7聚合酶从线性化的pGH19-AQP2转录修饰过的AQP2 cRNA。向卵母细胞注射2 ng野生型或突变的AQP2 cRNA,对照组注射等量蒸馏水。1 d后卵母细胞用0.1 μmol/L Dex处理48 h,行Western blot或水通透生物学功能检测。
1.2.7 爪蟾卵母细胞透水试验:卵母细胞从OR3培养基取出后立即置于ND96(200 mOsm)中10 min,后置于2倍稀释的ND96蒸馏水(100 mOsm)中。通过显微镜计数低渗溶液中每个卵母细胞破裂时间。
1.3 统计学处理方法 采用SPSS25软件进行统计学分析,计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P< 0.05为差异有统计学意义。
2 结果
2.1 Dex和PKA均显著上调了AQP2膜蛋白和总蛋白的表达 分别采用Dex和PKA体外直接干预转染AQP2质粒的HEK293细胞,结果显示,与野生型组相比,野生型+Dex组和野生型+PKA组的AQP2总蛋白和膜蛋白表达显著上调(P<0.01),见图1。
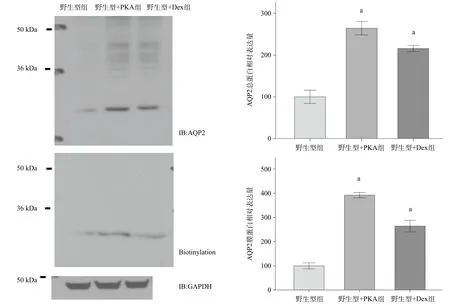
图1 Dex和PKA对HEK293细胞表达AQP2膜蛋白和总蛋白的影响
2.2 PKA磷酸化位点突变显著抑制体外PKA直接诱导的AQP2磷酸化及其蛋白表达 通过采用丙氨酸取代4个丝氨酸残基,将AQP2 C末端4个PKA磷酸化位点突变(见图2A)。与野生型组相比,PKA干预显著增强AQP2磷酸化,突变型组AQP2磷酸化水平显著降低(P<0.01),见图2B。与野生型组相比,突变型组AQP2膜蛋白和总蛋白的表达显著下调(P<0.01),见图2C。
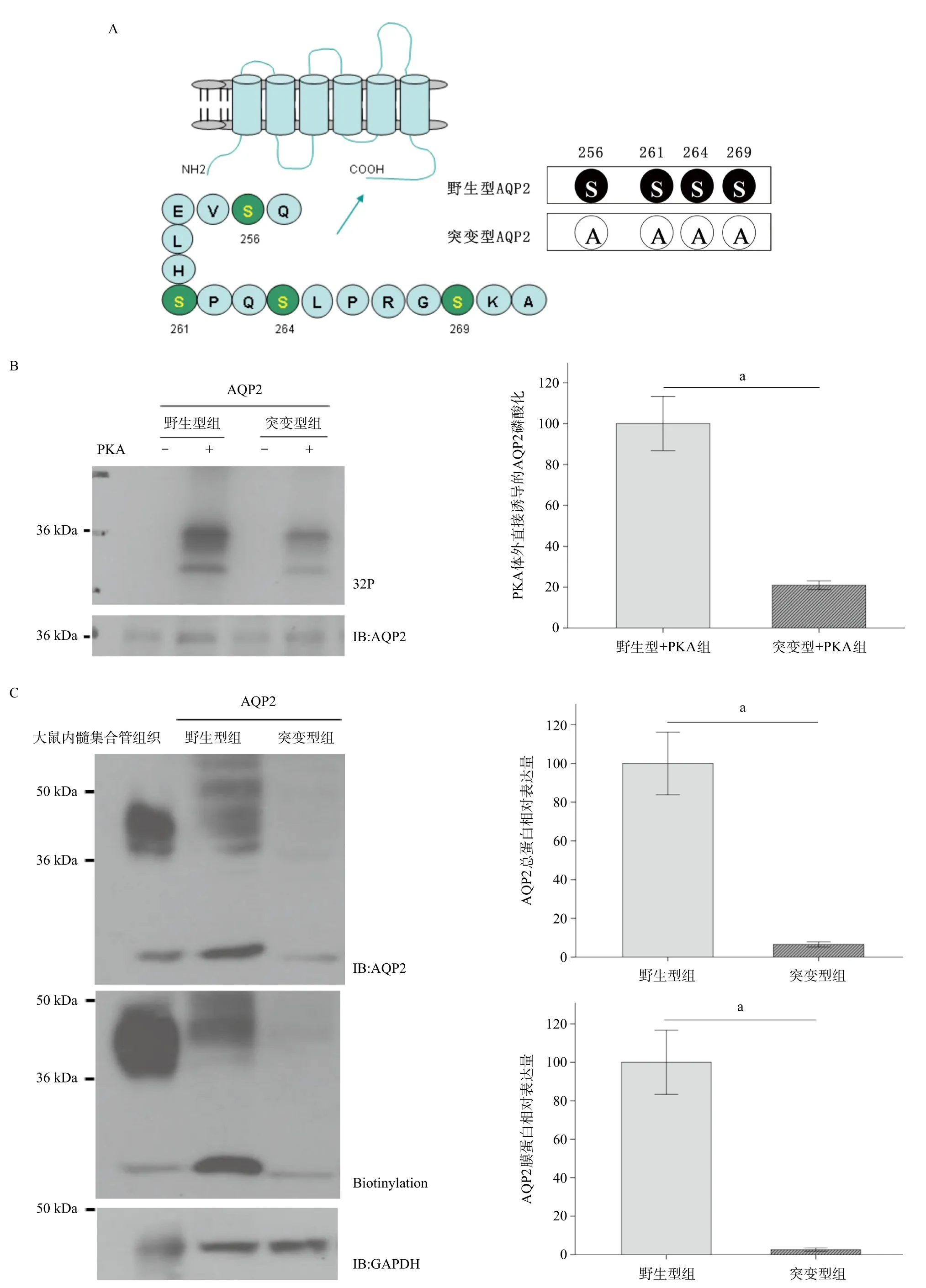
图2 PKA磷酸化位点突变对体外PKA直接诱导的AQP2磷酸化及其蛋白表达的影响
2.3 阻断磷酸化通路显著抑制Dex及PKA介导的AQP2膜蛋白和总蛋白的上调效应 与野生型组相比,PKA明显上调AQP2的总蛋白和膜蛋白表达(P<0.01)。突变型组PKA对AQP2的上述作用被显著抑制 (P<0.01),见图3A。与野生型组相比,Dex明显上调AQP2的总蛋白和膜蛋白表达(P<0.01)。突变型组Dex对AQP2的上述作用被显著抑制(P<0.01),见图3B。
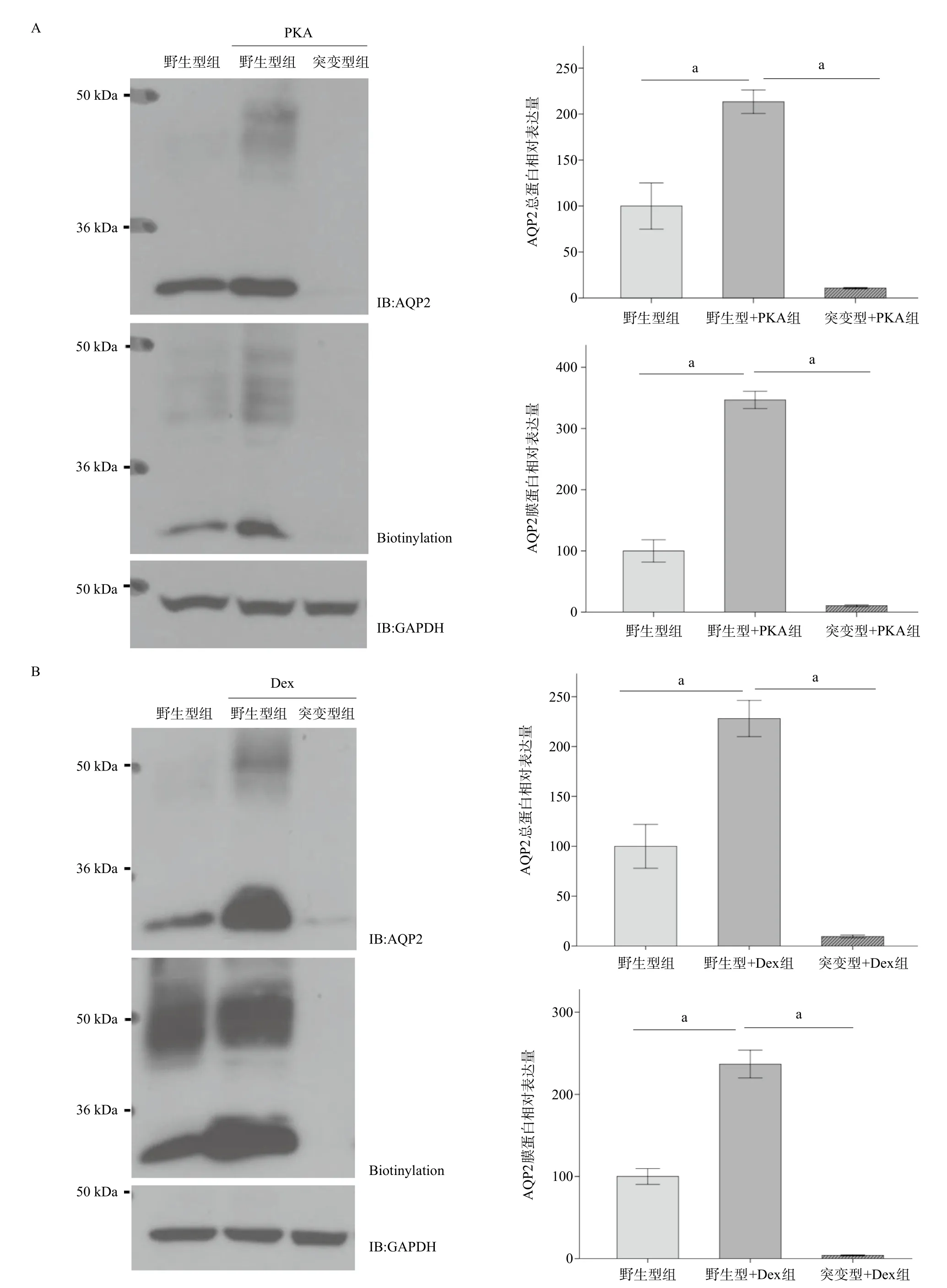
图3 阻断PKA磷酸化通路对Dex及PKA介导的AQP2膜蛋白和总蛋白表达的影响
2.4 阻断PKA磷酸化位点显著抑制了卵母细胞中地塞米松和蛋白激酶A介导的AQP2水通透生物学活性 蒸馏水组平均细胞破裂时间较AQP2野生型组显著延长(P<0.01)。野生型+PKA组细胞破裂时间显著短于未干预组(P<0.01)。磷酸化位点突变后PKA干预组细胞破裂时间显著延长(P<0.01);野生型+Dex组细胞破裂时间显著短于未干预组(P<0.01)。突变后Dex干预组细胞破裂时间显著延长(P<0.01),见图4。

图4 爪蟾卵母细胞透水试验结果
3 讨论
AQP2是一种水通道,作为AVP最重要的靶蛋白,AQP2通过在肾脏集合管的主细胞顶膜介导水的重吸收,在维持哺乳动物的水代谢稳态、细胞迁移和上皮形态发生中起重要作用[2]。目前已经明确AQP2的结构与功能异常与许多水代谢紊乱疾病如尿崩症、肾囊肿、慢性心力衰竭、肝硬化和肾病综合征等的发病密切相关[3-4,19]。
越来越多的证据显示GCs参与了AQP2的调节,但现有研究结果存在争议。有研究结果显示GCs对AQP2存在抑制作用,如SAITO等[5]发现:与对照大鼠相比,糖皮质激素缺乏大鼠肾脏中AQP2 mRNA和蛋白的表达分别增加了1.6倍和1.4倍。更多的研究则提示GCs能上调AQP2的表达,如CHEN等[6]证实Dex增加了肾上腺电化大鼠内髓质中AQP2的表达,KUO等[7]证实Dex以剂量和时间依赖性方式在mRNA 和蛋白质水平上增强加压素诱导的AQP2基因表达。我们先前的研究也证实Dex在体外实验中可以直接上调AQP2的蛋白表达[8]。但迄今为止,关于GCs调控AQP2的确切效应仍有待进一步证实,其调控的具体机制仍不清楚,在近年来总结的AQP2调控机制中未提及GCs的内容[4,20]。
GCs与PKA具有协同作用[16],如Dex可通过PKA信号通路诱导胰腺β细胞凋亡[17],也可通过PKA催化亚基激活GCs受体来与cAMP相互作用[18]。我们推测Dex与PKA对AQP2很可能有协同的调控效应。本研究结果证实了我们的推测,Dex和PKA均显著上调了AQP2膜蛋白和总蛋白的表达。
作为一种膜蛋白,AQP2的膜转运及其降解机制一直是研究的重点。目前已知PKA信号通路是AQP2发挥生物学作用的关键途径,在AQP2 C末端有4个AVP调节的PKA磷酸化位点(S256、S261、S264和S269),AQP2的膜积聚及活性受到其C末端磷酸化的严格调控,其中以S256最重要。PKA的活化和AQP2 COOH末端的磷酸化是AQP2实现细胞内转运并发挥生物学作用的关键环节[4,9-14]。此外,最近的研究也显示,在AQP2的调控中还存在除PKA外的其他激酶诱导的磷酸化通路[4,15,21]。
为了进一步明确Dex对AQP2的调控是否依赖PKA信号通路实现。我们在本实验中设计了独特的AQP2质粒,突变了AQP2 C末端4个磷酸化位点,结果显示突变后体外PKA直接诱导的AQP2磷酸化及其蛋白表达被显著抑制,证实该方法可有效阻断PKA磷酸化信号通路。进一步的研究显示,阻断PKA磷酸化信号通路后,Dex及PKA介导的AQP2上调效应均被显著抑制。透水实验证实Dex及PKA介导的AQP2水通透生物学活性增加被显著抑制,以上结果支持Dex依赖于PKA信号通路实现对AQP2的调控效应。
综上所述,本研究结果证实Dex能显著上调AQP2的总蛋白和膜蛋白表达,并且该作用高度依赖于PKA磷酸化信号通路。
志谢衷心感谢美国埃默里大学医学院肾脏生理系陈广平教授对本研究的帮助和指导。
