基于临床及影像组学构建中轴性脊柱关节病支持向量机预测模型
2022-04-07缪寿亮林婷婷肖琴琴陈丹叶鲁思郑祥武
缪寿亮,林婷婷,肖琴琴,陈丹,叶鲁思,郑祥武
温州医科大学附属第一医院,浙江 温州 325015,1.放射科;2.风湿免疫科
中轴型脊柱关节病(axial spondyloarthritis,axSpA)是一个异质性很强的疾病,临床表现主要为慢性腰背痛,常累及40岁以下的年轻男性,主要侵犯骶髂关节,受累关节可逐渐发生结构损害、新骨形成、关节融合而致关节活动受限、功能减退,从而严重影响患者工作及生活质量,具有较高致残 性[1-3]。然而,axSpA的临床表现及实验室检查指标缺乏特异性,影像学CT检查早期也可呈阴性表现,导致该病常易被延迟诊断[4],早期诊断axSpA并有效干预,可阻止患者关节结构损害及延缓其影像学进展,减少疾病的致残率。本研究探讨基于CT影像组学和临床危险因素的支持向量机(support vector machine, SVM)对axSpA的诊断价值,旨在提升其诊断效能。
1 资料和方法
1.1 一般资料 收集2012年10月至2019年2月在温州医科大学附属第一医院因腰背痛就诊568例患者,最终临床诊断axSpA 319例,非axSpA 249例,按7:3随机将患者分为训练组与验证组。所有患者均有骶髂关节CT资料,临床资料包括年龄、性别、HLA-B27、血沉、C反应蛋白和疾病持续时间。纳入标准:①风湿病学专家利用国际脊椎关节炎学会(ASAS)分类标准[5]来诊断为非axSpA或axSpA;②骶髂关节CT检查均为同一台机器;③CT检查和实验室检查相隔不超过1周。排除标准:CT图像或临床资料不完整。本研究获得温州医科大学附属第一医院伦理委员会批准。
1.2 CT检查方法与图像处理 采用美国GE Bright-Speed 16排CT行骶髂关节常规扫描,扫描参数:管电压120 kV,电流10~300 mAs,扫描层厚5 mm。所有图像均由2名对患者临床资料不知情的放射科医师进行分析,在连续6个最大骶髂关节横断位层面上,使用ITK-SNAP软件(版本3.4.0,http://www.itksnap.org/)沿着骶髂关节关节面下1 cm以及包含关节间隙逐层手动勾画感兴趣区(volume of interest, VOI),然后合成三维VOI,见图1。导入GE公司的Artificial Intelligence Kit(A.K)软件进行影像组学特征提取,自动提取出1 316个定量特征。特征可分为7类:①一阶直方图参数(n=252);②形状参数(n=14);③灰度共生矩阵(gray-level co-occurrence matrix, GLCM)(n=336);④灰度差值法(gray-level difference method, GLDM)(n=196);⑤灰度运行长度矩阵(gray-level run length matrix, GLRLM)(n=224);⑥灰度尺寸区域矩阵(gray-level size zone matrix, GLSZM)(n=224);⑦邻域灰度差值矩阵(neighborhood gray-tone difference matrix, NGTDM)(n=70)。利用组间相关系数(intraclass correlation coefficient, ICC)评估每类特征的观察者间一致性,ICC大于0.75表明所提取的特征具有高度稳定性。
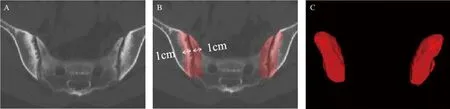
图1 骶髂关节VOI勾画示意图
1.3 CT影像判读 由2名放射科医师在不了解患者临床资料情况下对骶髂关节CT影像学改变根据修正纽约标准进行0~4分级[6]。意见不一致时相互讨论,得出统一结果记录。影像学上骶髂炎定义为双侧骶髂关节大于或等于2级,或单侧骶髂关节大于3级。
1.4 模型的构建与验证 使用最小冗余最大相关性(minimum redundancy maximum relevance,mRMR)和最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法对1 316个影像组学特征进行降维,挑选出最有预测价值的特征,并利用其相关系数计算影像组学评分,见图2、图3。采用SVM构建临床、影像组学及临床-影像组学诊断模型。

图2 影像组学特征LASSO回归降维过程
1.5 统计学处理方法 采用R语言(版本3.6.3,https://www.r-project.org/)进行统计学分析。正态分布计量资料以±s表示,用Studentt检验;非正态分布资料用M(P25,P75)表示,用Mann-WhitneyU检验或Wilcoxon秩和检验;计数资料用Pearson χ2检验或Fisher精确检验;用“glmnet”软件包进行LASSO算法;用Logistic回归模型分析相关临床因素,筛选临床独立危险因素;应用受试者工作特征(receiver operating characteristic,ROC)曲线分析和曲线下面积(area under curve,AUC)评估模型的效用,并采用Delong检验评价模型间效能的差异。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 根据ASAS分类标准,共收集568例腰背痛患者,年龄14~84(41.7±13.4)岁,男351例,女217例,最终诊断axSpA患者319例,非axSpA患者249例。非axSpA主要诊断包括类风湿性关节炎、非特异性腰背痛、痛风性关节炎、退行性骨关节炎、致密性骨炎、外周型脊柱关节病、感染、腰椎间盘突出及骨折等。与非axSpA组患者比,axSpA组患者更年轻,HLA-B27阳性率、男性比例、血沉和C反应蛋白水平更高,差异均有统计学意义(P<0.05)。训练组和验证组患者临床特征差异无统计学意义(P>0.05),见表1。多因素Logistic 回归分析显示,年龄、男性、HLA-B27和血沉水平是axSpA的临床独立预测因素(P<0.05),见表2。

表1 axSpA组与非axSpA组、训练组与验证组间临床特征和影像组学评分比较
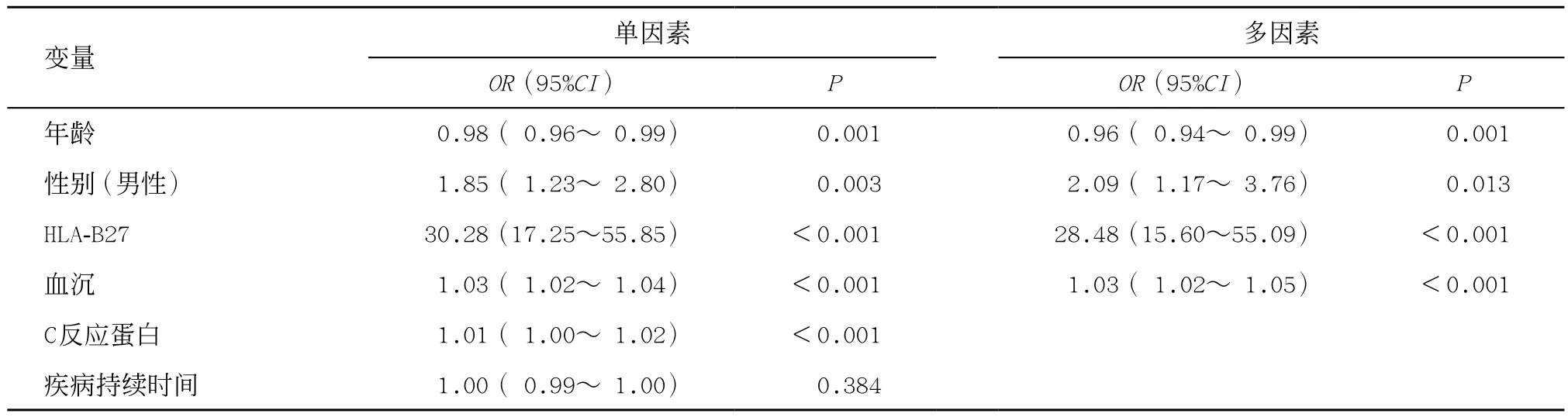
表2 axSpA临床预测因素的单因素和多因素Logistic回归分析
2.2 影像组学特征 基于骶髂关节CT图像提取影像组学特征,首先采用mRMR对组学特征进行初步筛选,保留20个有最大预测效能的特征,然后将剩余的影像特征作LASSO回归分析,通过10折交叉验证筛选LASSO回归模型的最优参数λ值,最后选出最优15个影像组学特征并计算相关系数,见图3。15个影像组学特征观察者间均大于0.860,具有良好的重复性,然后利用其相关系数计算影像组学评分。结果显示,非axSpA与axSpA组间的影像组学评分差异有统计学意义(P<0.001);而训练组和验证组间影像组学评分差异无统计学意义(P>0.05),见表1。

图3 最具预测性的影像组学特征相关系数
2.3 模型构建及效能评价 训练组与验证组中临床-影像组学联合模型都具有最佳AUC值,其诊断效能高于临床模型、影像组学模型和CT影像判读,差异均有统计学意义(均P<0.05)。训练组中临床模型、影像组学模型诊断效能也高于CT影像判读,差异均有统计学意义(均P<0.05);而临床模型与影像组学模型间诊断效能差异无统计学意义(均P> 0.05)。验证组中临床模型、影像组学模型和CT影像判读的诊断效能两两间差异无统计学意义(均P>0.05)。训练组中临床-影像组学联合模型的准确性、特异度、阳性预测值及阴性预测值高于影像组学模型;临床-影像组学联合模型的准确性、灵敏度及阴性预测值高于CT影像判读;临床模型的准确性、灵敏度及阴性预测值高于影像组学模型;临床模型的灵敏度及阴性预测值高于CT影像判读;CT影像判读的特异度高于影像组学模型;验证组中临床模型的灵敏度高于影像组学模型,差异均具有统计学意义(均P<0.05),见表3和图4。

图4 各组模型预测axSpA效能的ROC曲线

表3 不同模型对中轴性脊柱关节病的诊断效能
3 讨论
本研究基于临床危险因素和骶髂关节CT影像组学建立SVM模型,并评估其在axSpA中的诊断效能。结果表明,临床-影像组学SVM联合模型的诊断效能优于影像组学、临床模型及影像判读,在axSpA的诊断中具有较好的应用价值。
在7个潜在的临床危险因素中,发现年龄、性别、HLA-B27及血沉水平是axSpA的独立预测因素。其中HLA-B27一直被认为是与axSpA患者密切相关的临床指标,在本研究中axSpA患者HLA-B27阳性率达到91.2%,这与之前的研究结果一致[7]。此外, axSpA通常发生在年龄小于45岁的人群中,且在男性中更为常见[8-9],这同样支持本组研究中axSpA患者较非axSpA患者的年龄更低和男性患病率更高的结果。另外,有研究表明血沉水平升高可用于评估axSpA疾病活动情况[10],在本组研究中血沉也被证明是axSpA诊断的重要组成部分。
除了临床危险因素外,影像学评估也是诊断axSpA的关键,影像检查方法主要包括X线、CT及MRI,一般推荐使用MRI。然而,MRI在诊断骶髂关节炎中特异性仅为60%~70%[11]。虽然在MRI上骶髂关节的骨髓水肿表现与疾病早期诊断密切相关,但其假阳性率高且有一定主观性,会造成病变定性及诊断困难。目前,CT作为鉴别诊断axSpA中结构病变的金标准越来越受到重视。值得注意的是,虽然CT诊断axSpA的敏感性略低于MRI,但其特异性优于X线和MRI[12]。临床实践中,由于MRI价格贵、检查等待时间长,而CT也可以观察骶髂关节早期结构变化,所以对于腰背部疼痛的患者临床医师会优先选择CT检查[13]。然而,由于传统影像检查技术的局限性及诊断的主观性,axSpA的诊断存在延迟和误诊的情况[4,14];金笛儿等[15]对原诊断axSpA的患者进行再评估,发现放射学阴性axSpA其误诊率高达69.81%,强直性骶髂关节炎误诊率为34.48%,其中主要原因为骶髂关节影像学误读。
与之相比,影像组学可以从影像图像中提取海量的肉眼不能观察的特征来量化疾病[16],已逐渐应用于各种肿瘤的研究中,包括肿瘤的定性、临床分级分期、疗效评估、预后分析及基因分析等[17-19]。 由于axSpA也具有肿瘤样异质性,基于影像组学对这类疾病的研究也已有少数文献报道。TENORIO 等[20]基于MRI进行了影像组学分析来帮助骶髂关节炎的诊断和SpA的分类。CASTRO-ZUNTI等[21]利用基于CT的纹理特征对强直性骶髂关节炎进行早期检测。然而,目前国内外基于影像组学机器学习方法在axSpA诊断上应用尚未见有文献报道。SVM属于监督式学习,是一种在对给定的数据进行精度与函数相结合来寻求最佳比例的机器学习模型,其泛化错误率低,具有良好的学习能力,且学到的结果具有很好的推广性[22-23]。目前文献报道该模型可应用于肺癌的诊断[24]、肾癌的分期预测[25]以及胃癌的疗效评估[26]等方面。本组研究构建影像组学、临床及联合三个SVM模型,结果显示影像组学模型AUC值略高于影像主观判读,而联合模型在构建上包含了影像组学特征及临床因素,其AUC值为0.91,其效能优于临床模型、影像组学模型和CT影像主观判读,对axSpA具有较高的诊断价值。
本研究尚有一些不足之处。首先,本研究是回顾性分析,不可避免地存在选择偏倚,因此需要前瞻性研究。其次,本研究结果为单中心研究,需多中心或外部验证以检验模型的可重复性。第三,人工对VOI的分割费时复杂,自动化程度低,在一定程度上也会受到主观因素的影响。从骶髂关节CT图像中提取的影像组学特征有助于诊断axSpA。此外,临床-影像组学联合SVM模型对axSpA具有较高的诊断效能,有助于临床中减少axSpA的误诊或漏诊。
