磁共振2018版与超声造影2017版肝脏影像报告数据系统对肝细胞癌的诊断效能对比
2022-04-07李芳齐信王汤力宇刘烨鼎肖扬锐陈潇王祖飞张坤李炳荣
李芳,齐信王,汤力宇,刘烨鼎,肖扬锐,陈潇,王祖飞,张坤,李炳荣
丽水市中心医院,浙江 丽水 323000;1.肝胆外科;2.超声科;3.放射科 浙江省影像诊断及介入微创重点实验室
肝脏影像报告和数据系统(liver imaging reporting and data system, LI-RADS)是一个对肝细胞癌(hepatocellular carcinoma, HCC)高危风险患者肝内病灶进行分类管理的主流系统,基于超声造影和基于磁共振的LI-RADS文档已分别更新至2017版(CEUS LI-RADS v2017,以下简称CEUS v2017)和2018版(MRI LI-RADS v2018,以下简称MR v2018)。虽然CEUS v2017与MR v2018具有相同的基本概念且目前多数关于两者的研究均收获了良好应用反馈[1-2],但基于CEUS的LI-RADS与基于MRI的LI-RADS之间存在一些明显的差异,例如成像技术、对比剂性质及具体评估细则等[3],因此这些差异对LI-RADS分类和准确性的影响仍需要开展进一步的研究验证[4],而国内外关于MR v2018与CEUS v2017的同一组内、前瞻性诊断效能对照研究鲜见报道,因此本研究通过对比入组病例的MR v2018和CEUS v2017评估结果,探讨两者对HCC的诊断效能差异,以期为高危风险患者肝内病灶进行更好的分类及临床管理提供一些应用经验。
1 资料与方法
1.1 一般资料 本研究为前瞻性研究,获得丽水市中心医院伦理委员会批准(伦审审查编号:2019第169号)及患者知情同意。研究对象为2019年8月至2021年7月间在丽水市中心医院就诊且存在肝内实质性病灶的患者,在10 d之内完善磁共振增强(contrast-enhanced magnetic resonance, CEMR)和超声造影(contrast-enhanced ultrasonography,CEUS)检查,并通过手术、穿刺活检或复查获得病灶的病理或临床诊断结果,以病理或临床诊断结果为标准对比MR v2018与CEUS v2017对HCC的诊断效能差异。
纳入标准:①患者具有HCC高危风险,符合LIRADS适用标准;②肝内实质性病灶的数量不超过2个,且单个病灶的长径不超过6 cm(因为超声评估主要是基于一个切面下的动态观察过程,病灶过大可能影响超声评估的准确性);③病灶在MR及常规超声检查中均能够被显示。排除标准:①在行CEUS与CEMR检查前,病灶接受过针对性介入治疗;②有静脉内癌栓及肝外转移征象;③中途退出研究的病例。
最终153例患者完成了研究,其中男116例,女37例,平均年龄(58.1±12.0)岁;153例患者中142例有乙肝病史,其他非乙肝的高危因素共11例。共评估173个病灶,依病理/临床诊断结果分为HCC组(119例,有13例为临床诊断,其余为病理证实)、其他肝脏恶性肿瘤(other hepatic malignancy, OM)组(20例,包括2个混合性肝癌,11个肿块型胆管细胞癌,1个胆管囊腺癌,6个转移性肿瘤,均为病理证实)、良性病变组(34例,包括病理证实的10个局灶性结节增生,6个炎性结节,5个血管瘤,4个肝硬化再生结节,1个胆管腺瘤和8个为复查显示病灶无变化、缩小或消失经临床诊断的良性病变)。MR测量的病灶平均长径为(2.5±1.3)cm,超声测量的病灶平均长径为(2.6±1.4)cm。
1.2 影像检查方法 MR检查采用德国Siemens Area 1.5 T超导MR成像仪进行扫描。参数:①T2WI, TR 3 500 ms,TE 90 ms,FOV 38 cm×38 cm,矩阵320×320;②双回波T1WI,TR 120.0 ms,TE 2.4、 4.8 ms,FOV 38 cm×38 cm,矩阵256×256;③DWI, b=0、800 mm2/s,TR 5 000 ms,TE 70 ms,FOV 38 cm×38 cm,矩阵128×128;④增强扫描采用三维容积内插法,TR 4.1 ms,TE 1.8 ms,FOV 38 cm× 38 cm,矩阵320×320,对比剂采用Gd-DTPA,剂量 0.1 mmol/kg,流率2 mL/s,于25、60、180 s采集获得动脉期、门静脉期和平衡期图像;所有序列的层厚为5~6 mm,层间距1 mm。
超声检查采用GE Logiq E9超声诊断仪,探头C5-1,选择造影模式,造影剂采用SonoVue(声诺维)干粉造影剂,1瓶冻干粉加入5 mL 0.9%氯化钠溶液摇匀。经肘静脉快速推注同时启动机器上的录像键开始采集动态影像,动态观察病灶强化情况,直至造影剂在病灶内廓清,总观察时间4~5 min;定义10~40 s为动脉期,40~120 s为门脉期,大于 120 s为延迟期。廓清相关定义:病灶在注射造影剂后<60 s开始廓清为早期廓清;≥60 s开始廓清为晚期廓清;在注射造影剂后2 min以内病灶表现为“黑洞”为显著廓清;病灶较周边肝实质呈低增强但不呈“黑洞”表现则为轻度廓清,≥2 min表现为“黑洞”也为轻度廓清。
1.3 影像分析 MRI的评估分析由2名具有13年以上工作经验(均为副高级职称)的诊断医师共同阅片达成一致意见,若有分歧则由第3名更高年资(20年以上、正高级职称)的医师进行裁决。超声的评估分析由2名分别具有7年(中级职称)、10年以上(副高级职称)工作经验的医师共同观察达成一致意见,若有分歧则由第3名更高年资(20年以上、副高级职称)的医师进行裁决。评估者将依据MR v2018或CEUS v2017指南评估病灶MR征象或超声征象并判定LI-RADS类别。考虑到两套LI-RADS系统的评估细则及超声与放射工作者间的专业差异,因此本研究中评估者均不允许使用辅助征象调整LR类别(因为依据指南,评估者可根据自身经验自行决定是否使用辅助征象调整LR类别)。病灶的LI-RADS类别包括LR-M(可能或肯定是恶性肿瘤,但不是HCC典型表现)和LR 1~5,LR-1为肯定良性,LR-2为可能良性,LR-3为不确定良恶性,LR-4为很可能是HCC,LR-5为肯定是HCC。
1.4 统计学处理方法 采用SPSS21.0统计学软件进行处理。以Kolmogorov-Smimov检验评价计量资料是否符合正态分布,符合正态分布的计量资料以±s表示,不符合正态分布的以中位数表示。同一LR类别中MR v2018与CEUS v2017两组间关于HCC、OM与良性病变的数量差异比较采用χ2检验;HCC或OM在两套系统中的LI-RADS分类结果差异比较均采用Mann-WhitneyU检验;两套系统LR-M、LR-4/5、LR-5标准的灵敏度、特异度与准确度对比采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 病灶的MRI影像特征 非环状动脉期显著强化(arterial phase hyperenhancement, APHE)、非环状廓清、假包膜征三种HCC主要征象在HCC组中出现的例数分别为99例、77例、58例,在OM组分别为5例、1例、0例,在良性病变组分别为15例、0例、3 例。LR-M征象和其他辅助征象情况见表1。
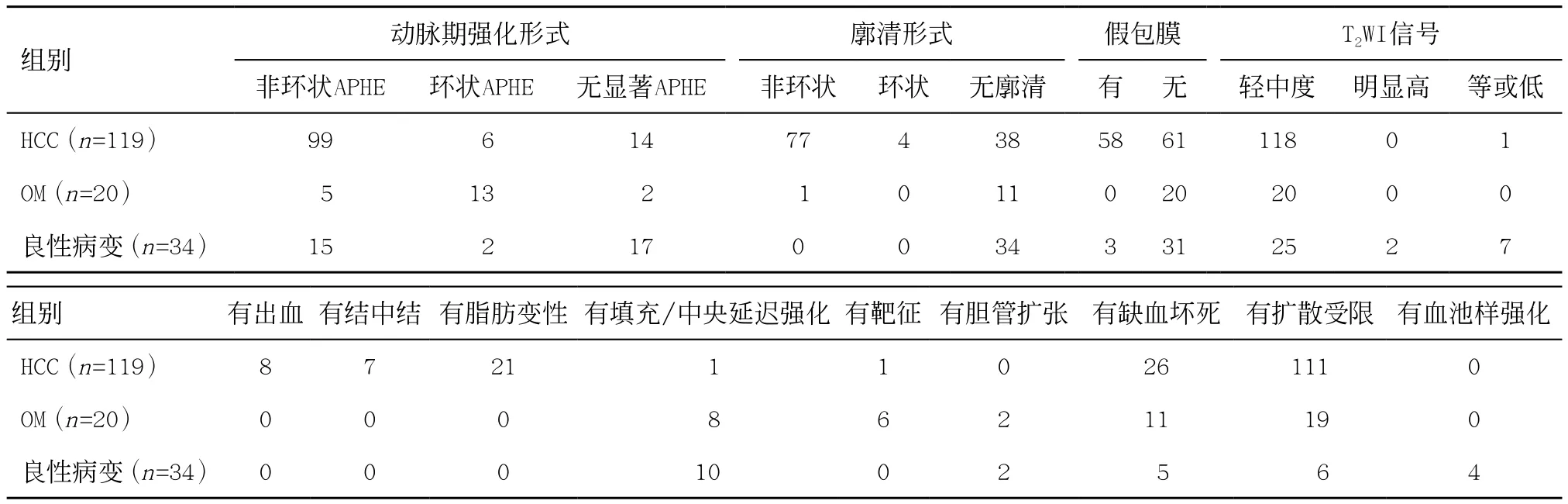
表1 病灶的MRI影像特征(例)
2.2 病灶的超声造影特征 非环状、非周边不连续结节状高增强和晚期且轻度廓清两种HCC主要征象在HCC组中出现的例数分别为108例、81例,在OM组分别为12例、5例,在良性病变组分别为12例、3 例。LR-M征象和其他辅助征象情况见表2。

表2 病灶的超声造影特征(例)
2.3 CEUS v2017与MR v2018的LI-RADS分类结果对比 HCC(见图1)、OM与良性病变(见图2)的CEUS v2017和MR v2018类别评估结果详见表3,在归类为LR-3的病变中HCC、OM与良性病变的例数差异有统计学意义(P=0.020);在其他LR类别中HCC、OM与良性病变的例数差异无统计学意义(P>0.05)。两套系统中HCC的LI-RADS分类结果差异无统计学意义(Z=-0.363,P=0.717);两套系统中OM的LI-RADS分类结果差异亦无统计学意义(Z=-1.705,P=0.088)。MR v2018与CEUS v2017中各LR标准诊断相应疾病的灵敏度、特异度和准确度见表4,两套系统在LR-4/5标准诊断HCC特异度中的对比结果MR v2018高于CEUS v2017,差异有统计学意义(P=0.001);在LR-1/2标准诊断良性病变灵敏度的对比结果中MR v2018高于CEUS v2017,差异有统计学意义(P= 0.021);其余对比结果差异均无统计学意义(P>0.05)。
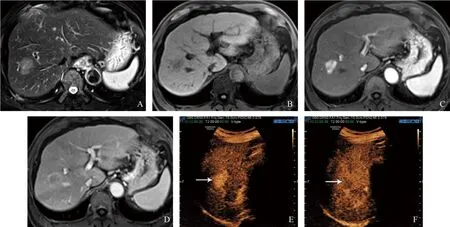
图1 HCC的MRI与CEUS图像

图2 肝硬化结节的MRI与CEUS图像

表3 CEUS v2017与MR v2018的LI-RADS分类结果对比(例)

表4 MR v2018与US v2017中各LR标准对诊断相应疾病的灵敏度、特异度和准确度(%)
3 讨论
3.1 MR v2018与CEUS v2017对HCC的诊断与鉴别效能差异分析 自MR v2018与CEUS v2017发布以来,许多研究已表明两套系统各自的LR-5标准及LR-M标准均具有很高的诊断特异度[5-7]。本研究表明两套系统的LR-5标准对HCC具有相类似的诊断效能,而LR-M标准对诊断OM的效能也相当,这与近来类似的回顾性研究[8-11]结论相同。部分超声学者尝试对CEUS v2017的LR-M标准进行改良[1]可能给今后MR v2018的LR-M标准细化提供了借鉴,例如“若病灶(呈环状增强)内的非增强区域有明确边界且没有穿孔外观,则可视为LR-5”[11],这提示MR v2018中病灶若存在边界清晰的坏死区(尤其是出血性坏死)但无中央延迟/填充强化时(即便该病灶另具有环状APHE、环状廓清或靶征等LR-M征象)应改判为LR-4或5。
本研究还表明在不使用任何辅助征象时,MR v2018中LR-4/5标准对HCC的诊断特异度要明显高于CEUS v2017。尽管CEUS被认为比MRI能够“更准确地评估是否存在APHE和廓清”[12],但从本次的征象对比结果来看,诚然纯动态观察下的CUES能够检出少部分仅在动脉早期强化的HCC(MR扫描动脉晚期,此类病灶可能被判为无APHE而无法达到LR-5标准),然而同样也有部分在MR中呈现“环状APHE”的OM将在CUES中改现为“非环状、非周边不连续结节状高增强”;同时,部分在MR中无明显廓清的OM以及良性病变也将在CUES中出现不同形式的廓清;这势必提升了OM与良性病变被CEUS v2017归类为LR-4或5的概率并降低了LR-4/5的诊断特异度。由于MRI是提供辅助特征最多的成像技术[12],且MR v2018的辅助特征能够在很大比例的观察中修改了最终类别并使LR-4标准在保持对诊断HCC具有高特异度的同时提升了灵敏度[13],而CEUS v2017中的辅助征象很少且对诊断HCC的应用价值非常有限[14],因此笔者认为若辅助征象被允许使用,MR v2018的LR-4/5标准对HCC的诊断效能将进一步高于CEUS v2017。
“如何确定LR-3类别病灶的补充检查策略以期能够确定病灶的性质”是LI-RADS指南的致力方向及近来的研究热点[4,15]。本研究表明对于同样被归为LR-3的HCC、OM与良性病变,两套系统的评估结果将产生明显差异;之前有研究表明“经CEUS v2017评估为LR-3的病灶往往是良性的”[16-17],笔者支持上述结论;只有5.9%(7/119例)的HCC在本次被CEUS v2017归类为LR-3,其比率较明显低于MR v2018的相应评估结果(18.5%,22/119例);这也提示对经MR v2018评估为LR-3的病灶继而再行CUES v2017评估确有意义[18],因为相当一部分被MR v2018评估为LR-3的HCC将在CUES v2017评估中达到LR-4/5标准[19]。
最后,本次病理结果中4个肝硬化结节均在MR v2018评估中被归类为LR-2,而在CEUS v2017中这4个结节均被归类为LR-3或4,提示MR对肝硬化结节的识别将会优于超声。
3.2 本研究的局限性 本研究为单中心性研究,具有一定选择偏倚。本次仍有少部分病例是通过临床诊断,可能会存在一定偏倚。本研究采用共识评估,因此没有分析不同观察者间的评估一致性;但很多研究也表明LI-RADS是一种较好的高危患者标准化分类系统,在受过LI-RADS培训的医师间LR的分类结果可能不会存在明显差异[20-23]。
综上所述,MR v2018与CEUS v2017的LR-5标准诊断HCC、LR-M标准诊断OM均具有相近的高特异度,而MR v2018的LR-4/5标准诊断HCC的特异度要高于CEUS v2017;对经MR v2018评估为LR-3的病灶继而再行CUES v2017评估有助于HCC的检出。
