长期高盐饮食对小鼠血糖及粪便代谢产物的影响
2022-04-07谢伟郑巨佳李芩耀甘静林灼锋
谢伟,郑巨佳,李芩耀,甘静,林灼锋
1.温州医科大学 药学院,浙江 温州 325035;2.温州医科大学附属第二医院 肾内科,浙江 温州 325027
糖尿病是由多因素引发的一种慢性代谢性疾病,调查显示,中国糖尿病的估计患病率从2013年的10.9%增加到2018年的12.4%,而糖尿病前期的估计患病率从2013年的35.7%增加到2018年的38.1%[1]。糖尿病与肾衰竭、失明、心血管疾病、非酒精性脂肪性肝病密切相关[2]。研究发现,除高糖高脂饮食能诱导动物形成糖尿病外,长期高盐饮食也会对血糖造成影响[3-4]。尽管食盐作为一种必不可少的调味品有助于提高饮食的愉悦度和满意度,但许多指南都推荐糖尿病患者进行食盐限制[5-6],膳食钠摄入量与普通人群的血压升高呈正相关[7],且高钠饮食是中风和心血管疾病的既定风险因素[8]。 然而,膳食盐和葡萄糖稳态之间的联系仍不清楚,且没有像高血压那样受到重视。大多数饮食干预并不关注盐/钠摄入量与糖尿病之间的关系。基于糖尿病的危害性,我们亟需对高盐诱导糖尿病的机制进行研究。因此我们假设“盐/肠道代谢物/高血糖”三者存在某种联系,肠道代谢物可能在高盐饮食小鼠高血糖进程中具有重要作用。
1 材料和方法
1.1 材料
1.1.1 动物:取8只8周龄的雄性C57BL/6J野生型小鼠,分成高盐组(HSD组)和对照组(NSD组),每组4只。HSD组给予高盐饲料(含8% NaCl),NSD组给予普通饲料(含0.5% NaCl),干预22周。小鼠由温州医科大学实验动物中心提供,SPF级环境饲养,室温(22±1)℃,湿度(50±10)℃,自由摄食饮水。
1.1.2 主要仪器及试剂:全自动样品快速研磨仪(JXFSTPRP-24/32,上海净信实业发展有限公司),台式高速冷冻离心机(TGL-16MS,上海卢湘仪离心机仪器有限公司),高分辨质谱仪(AB Triple TOF 5600,美国AB SCIEX公司),高效液相色谱仪(Waters ACQUITY UPLC,北京国谱科技有限公司),色谱柱[Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm),北京国谱科技有限公司]。甲醇、甲酸(德国CNW Technologies公司),纯水、乙腈(上海生工生物工程股份有限公司),LysoPC17:0(美国Avant公司)。
1.2 方法
1.2.1 葡萄糖耐受实验(glucose tolerance test,GTT):小鼠禁食16 h后,在其尾巴末端1~2 mm处取血,测定空腹血糖(fasting plasma gulcose,FPG),记该时刻为0 min。让小鼠适应30 min之后,用0.9%的NaCl配置20%的葡糖糖溶液,按0.01 mL/g 的剂量进行腹腔注射并开始计时。在10、20、30、45、60、75、90 min时检测血糖值并记录。
1.2.2 胰岛素耐受实验(insulin tolerance test,ITT):小鼠禁食16 h后,尾巴末端1~2 mm处剪一刀取血,滴血测定FPG,记该时刻为0 min。让小鼠适应30 min之后,按0.5 U/kg的胰岛素剂量对小鼠进行腹腔注射并开始计时。在15、30、45、60、90 min 时检测血糖值并记录。
1.2.3 小鼠尾动脉血压测定:采用BP2000仪器通过尾套法测定小鼠尾动脉血压,每天在同一时间点将小鼠放入仪器进行测量,使其熟悉检测环境,减少环境因素的影响。干预第22周时检测小鼠尾动脉血压并记录。每只小鼠测量5组数据,取平均值。
1.2.4 实验动物处理:干预22周后称量小鼠体质量,用1%戊巴比妥(0.1 mL/10 g)进行麻醉,处死小鼠。用75%乙醇消毒胸毛,轻轻剪开胸部表皮,在二、三肋间进行心脏取血,并在4 ℃,3 000 r/min离心10 min,并将血清分装于-80 ℃保存。取血后,剪开胸腔,用0.9%的NaCl对小鼠进行左心室灌流后,取下并称量小鼠的心、肝、肾、皮下脂肪、附睾脂肪、肾周脂肪和褐色脂肪组织,并在无菌条件下取出肠道粪便,所有组织分装后于-80 ℃保存。
1.2.5 粪便样本预处理:将-80 ℃冻存的粪便解冻, 各样本称取60 mg,置于1.5 mL EP管中,加入20 μL 甲醇配置的内标(L-2-氯苯丙氨酸,0.3 mg/mL; Lyso PC17:0,0.01 mg/mL),加入600 μL的甲醇水溶液(体积比:CH3OH:H2O=4:1)。加入2个干净小磁珠,-20 ℃预冷2 min,60 Hz研磨2 min,冰水浴中超声提取10 min,-20 ℃静置30 min,4 ℃、13 000 r/min 离心10 min。取200 μL上清液,过滤后移至进样瓶。另从8个样本的提取液中等体积提取液体混匀制备质控样本(QC),控制QC进样量与样本进样量相同。
1.2.6 液相色谱-质谱(liquid chranatography-mass spectrometry, LC-MS)分析:采用超高效液相串联AB Sciex Triple TOF 5600高分辨质谱仪组成的液质联用系统进行实验。采用色谱柱分析粪便标本;柱温为45 ℃;流动相组成:A-0.1%甲酸水溶液,B-乙腈/甲醇(2/3)(v/v)(含0.1%甲酸);流速为 0.3 mL/min;进样体积为5 μL。梯度洗脱程序见表1。
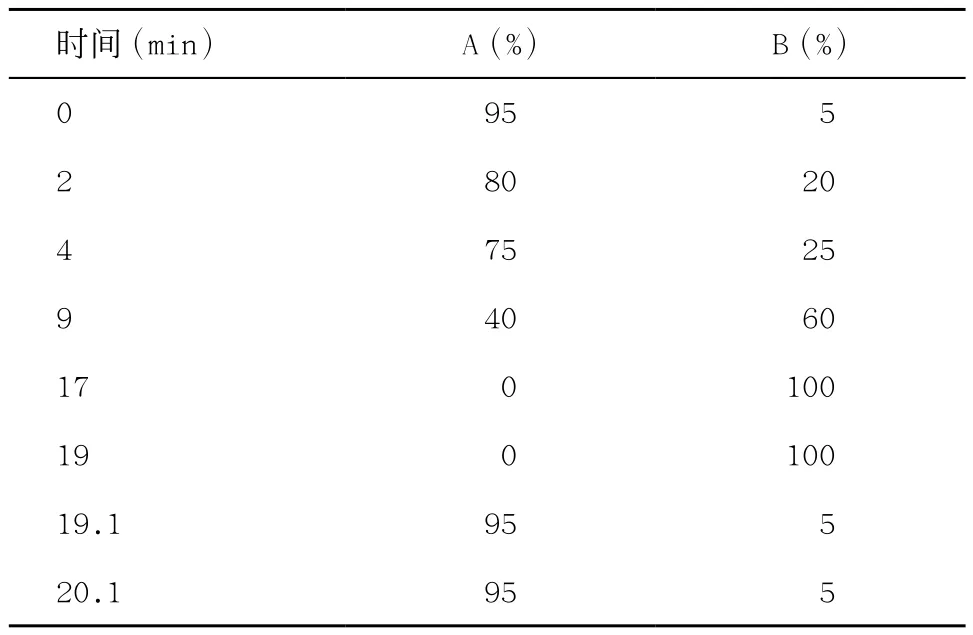
表1 梯度洗脱程序
1.2.7 代谢组学数据分析:样本经LC-MS分析后,采用UNIFI 1.8.1软件用于原始数据的采集,数据预处理在进行模式识别之前,原始数据经代谢组学处理软件Progenesis QI v2.3软件(英国Nonlinear Dynamics公司)进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化。使用SIMCA软件对数据进行处理和自动建模分析,模式识别采用PCA分析。化合物的鉴定基于精确质量数、二级碎片以及同位素分布,使用HMDB和Lipidmaps(v2.3)以及METLIN等数据库鉴定潜在标志物。
1.3 统计学处理方法 采用SPSS24.0软件进行分析。计量资料以±s表示,2组间比较采用独立样本t检验。GTT和ITT实验的曲线下面积(area under curve,AUC)根据公式计算:AUC=0.5×(血糖 0 min+血糖30 min)/2+0.5×(血糖30 min+血糖60 min)/2+1×(血糖60 min+血糖90 min)/2。在代谢组学分析中,同时采用多元变量统计模型的变量权重(variable important in projection, VIP)值和单变量统计t检验的P值来筛选差异代谢物。采用多元统计分析结果中的VIP值来衡量各代谢物的表达情况对各组样本分类判别的影响强度,筛出组间的差异代谢物,VIP>1的代谢物被认为是差异代谢物。在单变量统计分析中,用t检验和变异倍数(fold change, FC)分析来筛选2组之间的差异代谢产物,以FC>2.0且P<0.05作为筛选标准。P<0.05为差异有统计学意义。
2 结果
2.1 长期高盐饮食对小鼠机体组分的影响 长期高盐饮食可显著抑制雄性C57BL/6J小鼠体质量增加(P<0.05),同时显著增加小鼠心脏、肾脏比重 (P<0.05),但小鼠的皮下脂肪、附睾脂肪、肾周脂肪及棕色脂肪比重显著降低(P<0.01),而对小鼠肝脏比重无影响(P>0.05),见表2。
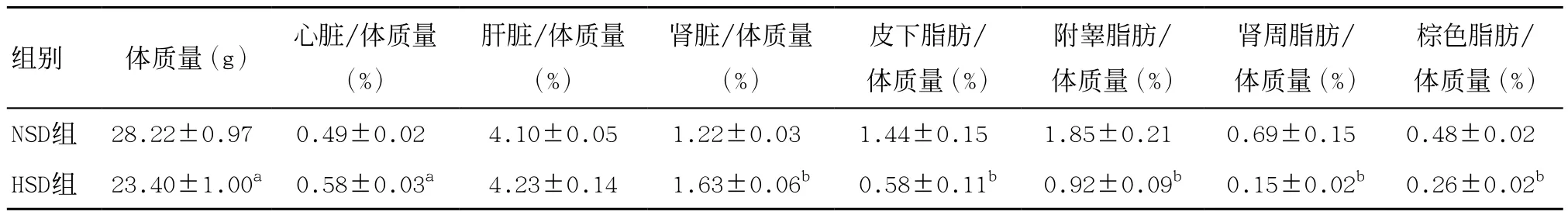
表2 长期高盐饮食对各组小鼠机体组分的影响(每组n=4)
2.2 长期高盐饮食对小鼠血糖代谢及血压的影响 与NSD组相比,HSD组收缩压显著升高(P<0.01);舒张压差异无统计学意义(P>0.05);HSD组FPG显著升高(P<0.05);GTT曲线结果显示,HSD组AUC值明显高于NSD组,且HSD组血糖峰值显著大于NSD组(P<0.05);ITT曲线结果显示,2组的AUC值差异无统计学意义。见图1。

图1 长期高盐饮食可升高小鼠血糖及血压
2.3 长期高盐饮食对小鼠粪便代谢组学的影响
2.3.1 质控结果:采用LC-MS检测分析每个样品,得到两个原始质谱文件(正离子模式和负离子模式)。QC样本正负离子检测模式下的每组样品的质谱总离子流图出峰保留时间和峰面积重叠均较好,提示仪器稳定。
2.3.2 模式识别结果:各组血清样本分布PCA得分总体较清晰(见图2),表明各组代谢表型差异较明显。

图2 NSD组、HSD组及QC样本的PCA分析
2.3.3 长期高盐饮食干预后差异代谢物:根据差异代谢物的精确相对分子质量和二级质谱图鉴定差异代谢物,鉴定出12种差异代谢物包括:3-羟基辛烷基肉碱(3-hydroxyoctanoyl carnitine)、2-辛烯酸(2-otenedioic acid, 2-octenoate)、地红霉素(drithromycin)、NBD-硬脂酰-2-花生四烯醇-sn-甘油(NBD-stearoyl-2-arachidonoyl-sn-glycerol)、20-乙基-前列腺素E2(20-ethyl-PGE2)、甜菊苷(stevioside)、双哌啶(biperiden)、lysyl-蛋氨酸(lysyl-Methionine)、去甲胆酸(norcholic acid)、三萜醇黄皮萜醇(lansiol)、7,8,7’,8’-四脱氢黄质(7,8,7’,8’-tetradehydroastaxanthin)、磷脂酰甘油磷酸甲酯(PGP-Me),见表3,各个差异代谢物在各组中的峰面积变化见图3。HSD组小鼠粪便中的地红霉素、NBD-硬脂酰-2-花生四烯醇-sn-甘油、20-乙基-前列腺素E2、双哌啶、去甲胆酸、三萜醇黄皮萜醇及磷脂酰甘油磷酸甲酯代谢物含量高于NSD组,差异有统计学意义(P<0.05);HSD组小鼠粪便中的3-羟基辛烷基肉碱、2-辛烯酸、甜菊苷、lysyl-蛋氨酸及7,8,7’,8’-四脱氢黄质代谢物含量低于NSD组,差异有统计学意义(P<0.05)。
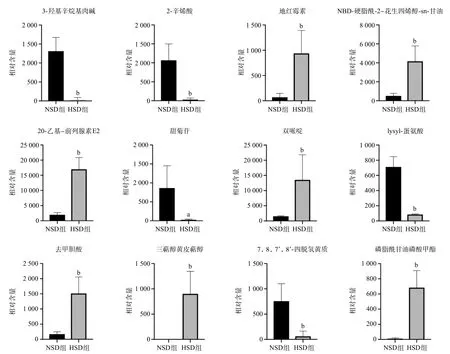
图3 2组小鼠12种差异代谢物的峰面积变化

表3 长期高盐饮食干预后差异代谢物鉴定结果
3 讨论
研究发现,甜菊苷、黄连素、姜黄素和辣椒素等多种天然分子对胰腺β细胞具有再生和抗凋亡作用,还可通过刺激胰腺β细胞来增加胰岛素分泌[9]。甜菊苷除了具有降低血糖、促进胰岛素分泌、改善胰岛素抵抗等功效外,还具有降低血压的作用[10]。体内外研究发现甜菊糖苷可通过增加葡萄糖转运体4(glucose transporter 4, GLUT4)的合成,有效促进糖尿病肌肉中的葡萄糖摄取(glucose uptake,GU)和氧化,其方式与二甲双胍类似[10]。机制上讲,甜菊糖苷与胰岛素受体底物-1(insulin receptor substrate-1, IRS-1)和GLUT4的结合亲和力较高。甜菊糖苷通过激活IR/IRS-1/Akt/GLUT4通路,有效抑制氧化应激,促进糖尿病腓肠肌GU。甜菊醇和甜菊苷在糖尿病诱导的L6和3T3L1细胞中表现出胰岛素模拟特性的分子证据[11]。甜菊糖苷被认为是一种很有前途的治疗2型糖尿病的植物药物[10,12]。经过PCA分析,结合图谱表明,与对照组相比,高盐饮食小鼠体内甜菊苷代谢物的含量明显降低。结合以上研究基础,推断高盐的摄入可能影响着甜菊苷的吸收,进而影响了血糖,导致GTT值升高。
氨基酸失衡与高血压及其并发症关系密切。除低钠低胆固醇饮食外,适当增加摄入同型半胱氨酸的前体物质蛋氨酸,对减轻体质量,降低血压、血糖、血脂,抗脂质过氧化,预防动脉硬化均有益处,而高水平的蛋氨酸摄入会产生不良反应,如高同型半胱氨酸血症、体质量下降和胆固醇水平升高,因此,安全剂量的蛋氨酸具有一定的药用价值[13]。在糖尿病中,高硫氨基酸(包括蛋氨酸和半胱氨酸)饮食与糖尿病死亡风险的增加有关,而将摄入量降低至推荐膳食允许水平可导致终生风险的降低[14]。在1型糖尿病大鼠中,给予L-蛋氨酸喂养8周,可显著改善血糖和胰岛素水平,下调胰高血糖素和Bax表达。适当补充蛋氨酸是一种减轻糖尿病诱导的β细胞死亡的新治疗方法[15]。在其他疾病方面,有学者认为限制蛋白质和蛋氨酸摄入可改善健康和衰老代谢相关的神经退行性疾病,并可能与成纤维细胞生长因子21、mTOR和自噬有关,改善线粒体功能和氧化应激[16]。本研究中,小鼠GTT值较对照组显著升高,蛋氨酸含量显著下调,推测高盐饮食可能改变了肠道微生态,从而干扰了小鼠对氨基酸物质如蛋氨酸的吸收,高盐饮食条件下,适当增加蛋氨酸的摄入是否能够改善小鼠血糖及糖耐量情况,值得进一步探讨。
胰岛中前列腺素E(prostaglandin E, PGE)是花生四烯酸的代谢产物,主要由4种特异的膜G蛋白偶联前列腺素E受体亚型(EP1、EP2、EP3和EP4)调控发挥生物作用[17]。PGE产量的增加和EP3的表达是导致2型糖尿病β细胞功能障碍的重要因素。然而,肥胖中存在许多相同的病理生理条件,而关于PGE的产生和信号传导途径如何影响非糖尿病β细胞的功能,目前知之甚少。研究表明,白细胞介素-6(interleukin-6, IL-6)和环氧合酶-2(cyclooxygenase-2, COX-2)mRNA水平与人体体质量指数(body mass index, BMI)呈正相关,而EP3 mRNA水平也与BMI呈正相关。此外,IL-6的表达也与COX-2等PGE合成途径基因的表达密切相关。使用EP3特异性拮抗剂的胰岛素分泌测试证实了PGE产生的功能相关上调,胰岛素含量随供体BMI和胰岛COX-2表达量的增加而增加,而EP3表达量则不受影响[18]。与非糖尿病对照组相比,从动物或人类器官供体分离的小鼠和人类胰岛中,胰岛EP3和PGE合成酶的表达和(或)PGE排泄本身都出现上调。2型糖尿病小鼠的全身代谢参数的改变与EP3介导的β细胞功能障碍的改善相关[19]。推测胰岛PGE生成上调可能是胰岛β细胞对肥胖和胰岛素抵抗的适应反应的一部分,只有当配体和受体在2型糖尿病中都高表达时才会功能失调。综上研究,在给予小鼠长期高盐饮食后,小鼠GTT值较对照组显著升高,PGE2含量显著上调,推测高盐饮食显著增加了雄性C57BL/6J小鼠的胰岛PGE对盐负荷的反应。
有学者认为2型糖尿病患者的血糖与血钠存在密切关系,高盐的摄入可能影响着葡萄糖的吸收,进而影响血糖值[20]。体外实验发现,高盐溶液刺激胰岛Min6细胞后能显著抑制其胰岛素分泌功能[21]。 体内研究发现,大鼠给予高盐饮食3周后,即可发现血糖升高[22]。临床研究发现,长期高盐饮食能增加糖尿病的患病率[23],且高盐摄入是一项糖尿病发生的独立危险因素[24]。机制上,高盐饮食可能是通过肾脏皮质近端小管上皮细胞的钠-葡萄糖协同转运蛋白2调节血糖稳态,诱导糖尿病[25]。血糖的升高也可能与高盐饮食条件下的肠道中钠-葡萄糖协同转运蛋白1表达升高有关[26]。既往研究表明,体内棕色脂肪的含量增多或活性增加可以减轻胰岛素抵抗及体内炎症情况[27],而本研究中,盐负荷小鼠皮下脂肪、附睾脂肪、肾周脂肪及棕色脂肪比重显著降低,因此,小鼠血糖的升高跟盐负荷后小鼠皮下棕色脂肪的减少可能存在某种关联。通过LCMS代谢组学方法,我们初步观察到长期高盐饮食小鼠发生高血糖的原因可能与盐负荷后出现的氨基酸代谢、胰岛中前列腺素代谢及氧化应激炎症等调控失衡有关。此外,其他差异代谢物如3-羟基辛烷基肉碱、2-辛烯酸、7,8,7’,8’-四脱氢黄质、NBD-硬脂酰-2-花生四烯醇-sn-甘油等,目前尚未明确其对人体的作用机制,需后续的继续关注与研究。
总之,本研究结果发现雄性C57BL/6J小鼠在盐负荷后,体质量减轻,心脏、肾脏比重显著增加,但皮下脂肪、附睾脂肪、肾周脂肪及棕色脂肪比重显著降低,血糖及血压均显著升高,粪便代谢组学结果显示高盐饮食小鼠存在氨基酸代谢、胰岛中前列腺素代谢及氧化应激炎症等过程调控失衡,提示盐负荷后高血糖形成机制错综复杂,有待于今后进一步深入研究。
