miR-138靶向调控FAK抑制三阴型乳腺癌MDA-MB-231细胞侵袭转移的机制
2022-04-07王栈山骆广涛王本忠
王栈山,谭 胜,骆广涛,王本忠
三阴型乳腺癌(triple-negative breast cancer, TNBC)是指ER、PR、HER-2均阴性的乳腺癌亚型[1]。MicroRNA(miRNA)是一类广泛存在于真核生物中,由19~24个核苷酸组成的内源性非编码RNA[2-3]。已往研究表明,miR-138在肺癌、结肠癌和乳腺癌等多种恶性肿瘤中表达下调,提示miR-138作为抑癌基因可能为肿瘤治疗提供新的靶点[4-6]。然而,目前关于miR-138在TNBC中的生物学功能及其下游调控机制研究较少。本研究拟选取人TNBC细胞株MDA-MB-231作为研究对象,初步探讨miR-138在TNBC侵袭、转移中的作用,并通过生物信息学以及分子生物学实验探讨miR-138的下游靶基因及其具体调控机制。
1 材料与方法
1.1 细胞株和主要实验试剂MDA-MB-231细胞株由本课题组长期保存,细胞株来源于美国模式培养物集存库(American Type Culture Collection, ATCC)。DMEM培养基购于Hyclone公司,胎牛血清(FBS)购于Gibco公司;Lipofectamine 2000购于Invitrogen公司;双荧光素酶报告基因检测试剂盒购于Promega公司;Trizol购于Invitrogen公司;Transwell小室购于Corning公司,Matrigel胶购于BD公司;Real-time PCR试剂盒购于ABI公司;DNA小抽及中抽试剂盒购于Axygen公司;miR-138 mimics、miR-138 mimics NC、miR-138 Inhibitor、miR-138 Inhibitor NC、FAK siRNA及FAK siRNA NC购于锐博公司;Western blot蛋白Marker购于Thermo Scientific公司;β-Actin抗体购于Abcam公司;FAK抗体、兔二抗和鼠二抗购于CST公司。
1.2 方法
1.2.1细胞培养 将MDA-MB-231细胞置于含10%FBS的DMEM培养基,37 ℃、5%CO2细胞培养箱中培养,根据细胞状态2~3日传代1次。
1.2.2Real-time PCR 首先运用Trizol法抽提细胞总RNA,采用逆转录试剂盒反转为cDNA。Real-time PCR使用SYBR Green PCR Master Mixture检测MDA-MB-231细胞中miR-138的相对表达量,用U6作为内参,每个样品设置3个复孔。miR-138引物序列:正向5′-GCCGCAGCTGGTGTTGTGAATCA-3′,反向5′-GTGCAGGGTCCGAGGT-3′;U6引物序列:正向5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向5′-CGCTTCACGAATTTGCGTGTCAT-3′。Real-time PCR 反应条件:50 ℃ 2 min,95 ℃ 2 min;95 ℃ 30 s,60 ℃ 40 s,72 ℃ 40 s,合计40个循环。溶解曲线条件:95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。通过2-ΔΔCt法计算样品miR-138的相对表达量。
1.2.3Transwell细胞迁移和侵袭实验 非Matrigel胶覆盖和Matrigel胶覆盖的Transwell实验分别检测MDA-MB-231细胞的迁移和侵袭能力。MDA-MB-231细胞消化、离心并弃去培养基,使用不含血清的培养基重悬,调整细胞密度至4×108/L。下室加入600 μL含10%FBS的完全培养基,24~48 h后弃去下室培养基,90%乙醇室温固定30 min。晾干后使用0.1%结晶紫染色15 min。用洁净棉签擦掉上室未穿过孔膜的细胞,显微镜下拍照并计数。Transwell迁移实验无需铺Matrigel胶,其余实验步骤与侵袭实验一致。
1.2.4miR-138下游靶基因预测 通过TargetScan、PicTar和miRanda三个miRNA靶基因在线预测工具共同预测miR-138的下游靶基因。使用这三种预测工具得到miR-138下游靶基因列表后,绘制Venn图,取列表交集并通过文献检索等方法筛选miR-138的下游靶基因。
1.2.5Western blot 使用Western blot技术检测FAK蛋白表达,内参蛋白为β-Actin。首先进行聚丙烯酰胺凝胶电泳,分离胶浓度为10%,浓缩胶浓度为5%。用移液枪将蛋白样品缓慢加入到胶孔内。设置起始电压为100 V,待蛋白样品在浓缩胶压缩呈一条直线后,改电压为150 V。电泳终止后,卸下胶板并组装“三明治”转膜装置开始转膜。转膜结束后使用5%脱脂牛奶常温摇床封闭1 h。封闭结束用TBS洗涤1次,4 ℃摇床用一抗(FAK 1 ∶1 000,β-Actin 1 ∶2 000)孵育过夜。第2天回收一抗,TBS洗10 min,共3次。常温摇床用二抗(1 ∶5 000)孵育1 h,TBS洗10 min,共3次。显影并保存曝光结果。
1.2.6双荧光素酶报告实验 在NCBI下载人FAK基因序列,设计PCR引物并扩增FAK 3’UTR。将FAK 3’UTR序列插入到psiCHECK2质粒构建psiCHECK2-FAK 3’UTR(野生型)。同时将FAK 3’UTR上miR-138相应识别位点突变后插入到psiCHECK2质粒中构建突变质粒psiCHECK2-MUT-FAK 3’UTR(突变型)。构建的FAK 3’UTR野生型质粒或突变型质粒在MDA-MB-231细胞分别与miR-138 mimics或miR-138 mimics NC共转染。实验具体分组见表1。共转染24 h后收集细胞并加入细胞裂解液,置于摇床避光低速孵育20 min。将细胞裂解液转移至新的离心管,置于冰上。检测各转染组的荧光素酶活性值。实验重复3次。
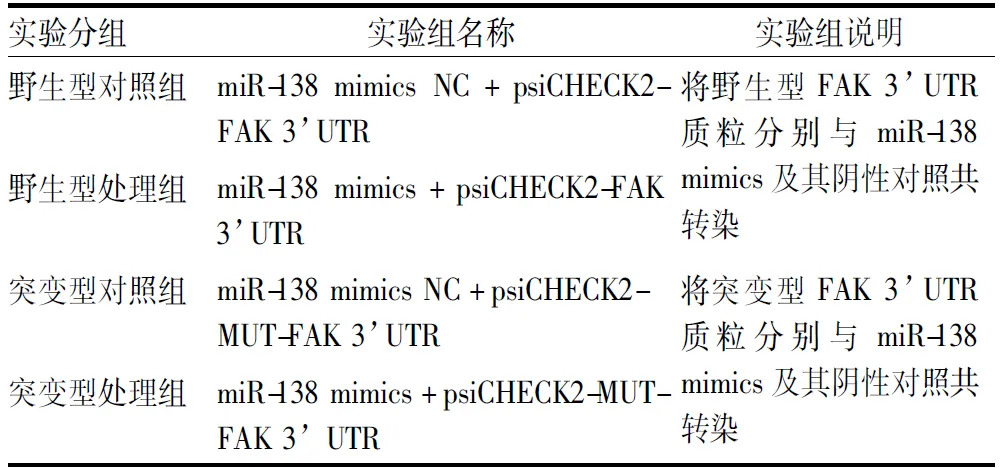
表1 双荧光素酶报告实验分组
1.2.7实验分组 miR-138过表达实验分组:MDA-MB-231细胞分别转染miR-138 mimics(miR-138组)及其阴性对照miR-138 mimics NC(NC组)。miR-138功能回复实验进行回复实验Ⅰ及回复实验Ⅱ,具体分组如表2所示。

表2 miR-138功能回复实验分组

2 结果
2.1 过表达miR-138后MDA-MB-231细胞迁移及侵袭能力的改变为验证miR-138 mimics的过表达效率,本组应用Real-time PCR检测MDA-MB-231细胞分别转染miR-138 mimics及miR-138 mimics NC后miR-138的相对表达量,结果显示:与NC组相比,miR-138组miR-138的表达量上调了约30倍(P<0.01,图1)。
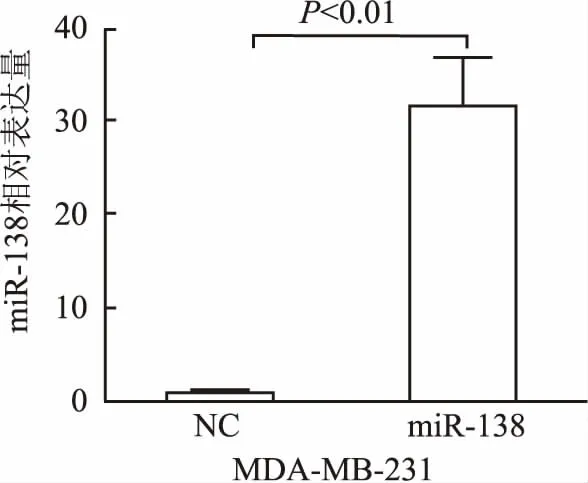
图1 MDA-MB-231细胞转染miR-138 mimics及阴性对照后miR-138表达变化
Transwell实验结果显示:与NC组相比,miR-138组MDA-MB-231细胞的迁移能力降低(P<0.01,图2);此外,miR-138组细胞侵袭能力亦较NC组降低(P<0.01,图2)。上述结果表明过表达miR-138可抑制MDA-MB-231细胞的侵袭和转移能力。
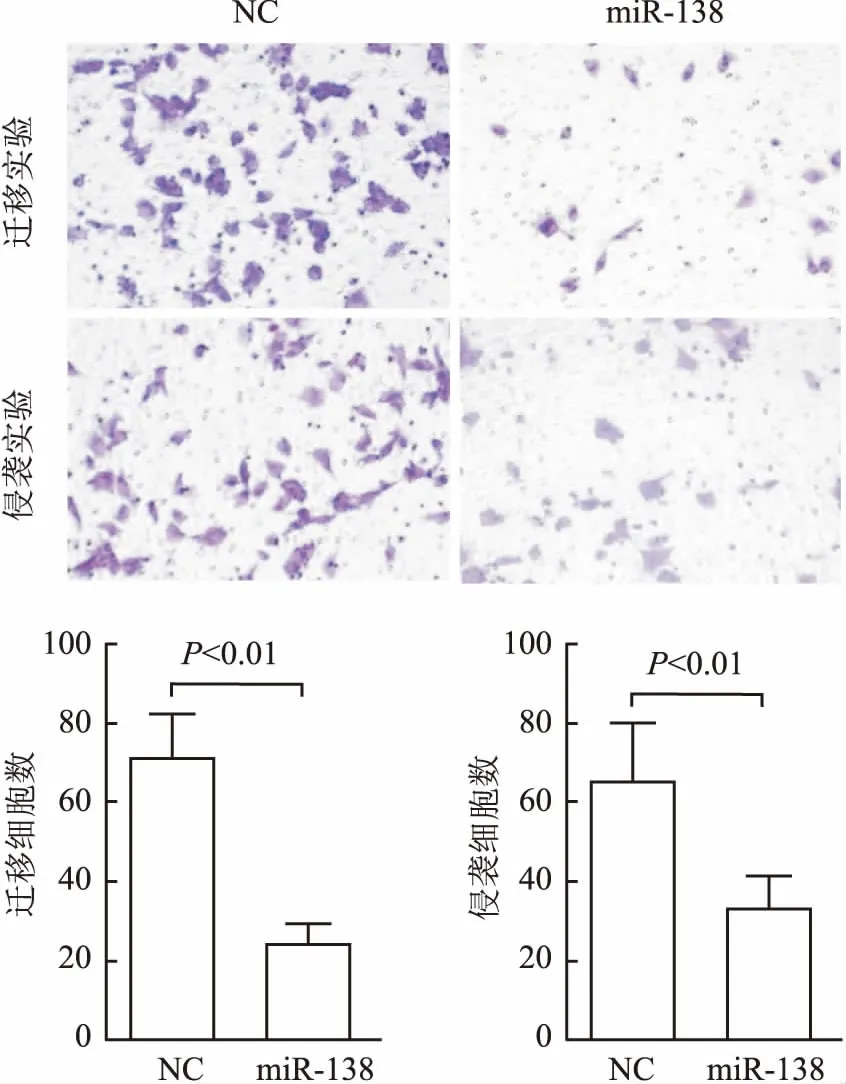
图2 Transwell迁移和侵袭实验检测MDA-MB-231细胞转染miR-138 mimics及阴性对照后迁移和侵袭能力的改变
2.2 生物信息学预测miR-138下游靶基因使用TargetScan、PicTar和miRanda三种在线预测工具得到miR-138下游靶基因列表,绘制Venn图,取列表交集发现有58个基因在三种预测工具中均是miR-138的靶基因(图3A)。进一步分析发现这58个靶基因中FAK基因3’UTR存在miR-138的结合位点,且该结合位点在包括智人、黑猩猩等多个物种中高度保守(图3B、C)。综上生物信息学结果表明:FAK可能是miR-138的下游靶基因。
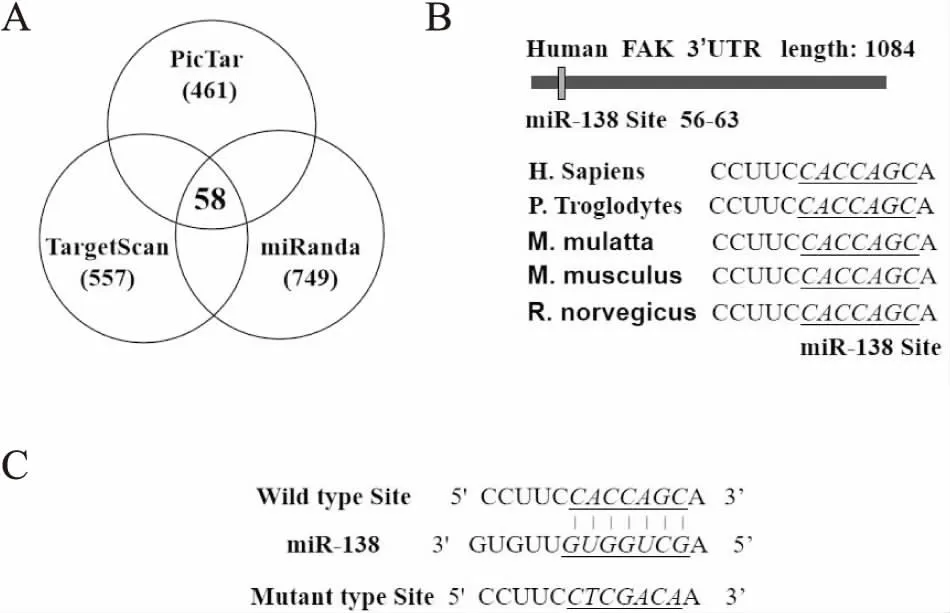
图3 生物信息学预测miR-138的下游靶基因:A.TargetScan、PicTar和miRanda预测miR-138下游基因的Venn图;B.FAK 3’UTR上miR-138的识别位点位于其3’UTR的56~63处,在智人(H.Sapiens)、黑猩猩(P.Troglodytes)、恒河猴(M. mulatta)、家鼠(M. musculus)及褐鼠(R. norvegicus)等物种中高度保守;C. FAK 3’UTR上miR-138的识别位点及FAK 3’UTR的突变位点
2.3 验证miR-138与下游靶基因FAK的靶向关系本组构建psiCHECK2-FAK 3’UTR(野生型)及psiCHECK2-MUT-FAK 3’UTR(突变型)质粒,突变位点见图3C。使用双荧光素酶报告实验和Western blot验证miR-138与FAK基因的靶向关系。双荧光素酶报告实验结果显示:与野生型对照组相比,野生型处理组荧光素酶活性显著降低(P<0.01,图4A);突变型处理组荧光素酶活性较突变型对照组相比差异无统计学意义(P>0.05)。Western blot结果显示:与阴性对照组相比,miR-138 mimics组FAK蛋白表达量显著降低(图4B)。上述结果证实FAK是miR-138的下游靶基因。
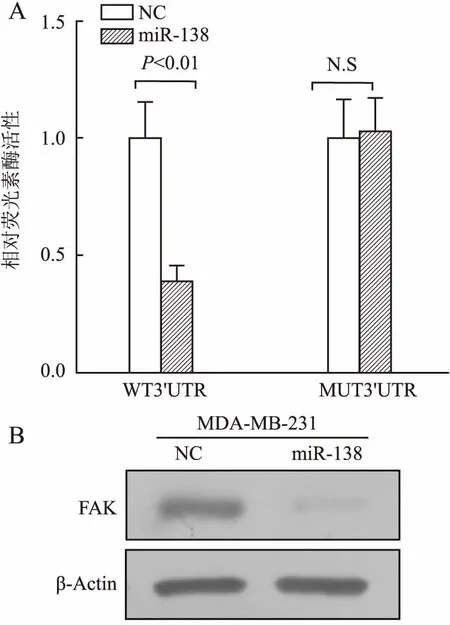
图4 双荧光素酶报告实验和Western blot验证miR-138与FAK基因的靶向关系:A.双荧光素酶报告实验检测miR-138结合FAK 3’UTR荧光素酶活性:WT 3’UTR. psiCHECK2-FAK 3’UTR(野生型);MUT 3’UTR. psiCHECK2-MUT-FAK 3’UTR(突变型);B.Western blot检测过表达miR-138后FAK蛋白表达变化
2.4 miR-138通过调控FAK表达抑制乳腺癌转移回复实验Ⅰ结果显示:与对照组相比,miR-138处理组FAK蛋白表达量下调(图5A);与miR-138处理组相比,回复组FAK蛋白表达量上调(图5A)。Transwell细胞迁移与侵袭实验结果显示:与对照组相比,miR-138处理组细胞的迁移与侵袭能力均降低(P<0.01,图5B、C);与miR-138处理组相比,回复组细胞的迁移与侵袭能力均增强(P<0.01,图5B、C)。上述结果表明上调FAK可以部分恢复miR-138过表达所抑制的细胞迁移与侵袭能力。

图5 上调FAK对miR-138过表达所抑制的细胞迁移与侵袭能力的影响(回复实验Ⅰ):A.Western blot检测MDA-MB-231细胞各转染组FAK蛋白表达改变;B.Transwell细胞迁移实验检测MDA-MB-231细胞各转染组的迁移细胞数;C.Transwell细胞侵袭实验检测MDA-MB-231细胞各转染组的侵袭细胞数;对照组:miR-138 mimics NC+Vec共转染组(NC+Vec);miR-138处理组:miR-138 mimics+Vec共转染组(miR-138+Vec);回复组:miR-138 mimics+FAK共转染组(miR-138+FAK)
回复实验Ⅱ结果显示:与对照组相比,miR-138处理组FAK蛋白表达量上调(图6A);与miR-138处理组相比,回复组FAK蛋白表达量下调(图6A)。Transwell细胞迁移与侵袭实验结果显示:与对照组相比,miR-138处理组细胞的迁移与侵袭能力均显著增强(P<0.05,图6B、C);与miR-138处理组相比,回复组细胞的迁移与侵袭能力均显著降低(P<0.05,图6B、C)。上述结果表明,使用FAK siRNA敲低FAK可以部分回复miR-138抑制所增强的细胞迁移与侵袭能力。
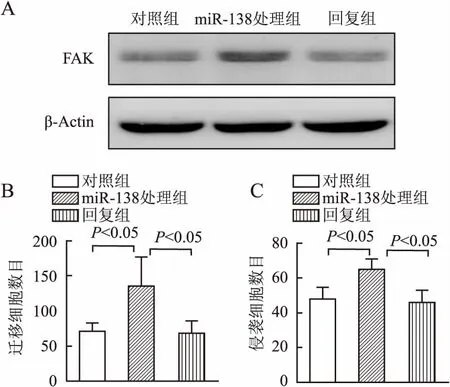
图6 敲低FAK对miR-138抑制所增强的细胞迁移与侵袭能力的影响(回复实验Ⅱ):A.Western blot检测MDA-MB-231细胞各转染组FAK蛋白表达改变;B.Transwell细胞迁移实验检测MDA-MB-231细胞各转染组发生迁移的细胞数目;C.Transwell细胞侵袭实验检测MDA-MB-231细胞各转染组发生侵袭的细胞数目;对照组:miR-138 Inhibitor NC+FAK siRNA NC共转染组(Inhibitor NC+siNC);miR-138处理组:miR-138 Inhibitor+FAK siRNA NC共转染组(miR-138 In+siNC);回复组:miR-138 Inhibitor+FAK siRNA共转染组(miR-138 In+siFAK)
3 讨论
目前,乳腺癌是全球女性发病率最高的恶性肿瘤[7]。近年来乳腺癌发病率逐年上升,根据最新研究统计,乳腺癌每年新发病例约占所有女性新发肿瘤的25%[8]。TNBC作为乳腺癌恶性程度最高的分子亚型,对内分泌治疗及靶向治疗均不敏感,具有侵袭性强,早期易复发、转移等特点,临床治疗预后极差。有研究表明伴复发转移的TNBC患者总体生存期(overall survival, OS)仅为13~18个月[9]。深入探究TNBC的侵袭转移机制,寻找新的治疗靶点,可为TNBC患者治疗策略的选择和预后判断提供新思路。
多种恶性肿瘤的miRNA表达谱发生特征性改变,导致其调控的基因网络异常,从而赋予肿瘤细胞诸如无限增殖、凋亡抵抗、侵袭转移及放化疗抵抗等恶性表型。有研究表明miR-138在多种肿瘤组织中表达下调[10]。此前,本课题组检测了14例正常乳腺组织和21例乳腺癌组织中miR-138的表达情况,结果显示:相较于正常乳腺组织,乳腺癌组织中miR-138表达量显著下调(本文未显示相关数据)。为探讨miR-138对TNBC侵袭、转移功能的影响,本课题组选择了高转移潜能的TNBC细胞株MDA-MB-231开展本实验,过表达miR-138后,MDA-MB-231细胞的迁移和侵袭能力均显著降低,表明miR-138可能在TNBC中发挥抑癌基因作用,这与既往报道的miR-138在肿瘤中的功能相一致[4-6]。
FAK是一种非受体酪氨酸激酶,在结直肠癌、前列腺癌及乳腺癌等多种肿瘤组织中高表达[11]。此前研究表明,FAK可通过PI3K/Akt信号通路调控肿瘤细胞黏附、迁移及侵袭等生物学行为,是肿瘤恶性进展的重要调控因子[11]。此外,FAK还参与整合素依赖性信号通路,介导胞内多条信号通路的串扰反应(crosstalk),进而调控肿瘤的侵袭、转移[11]。TargetScan、PicTar和miRanda三种在线预测工具均预测FAK可能是miR-138潜在的靶标基因。本实验挑选FAK作为下一步的研究基因是因为:(1)FAK在乳腺癌等多种恶性肿瘤中表达升高[11];(2)FAK与乳腺癌侵袭、转移密切相关[12];(3)包括miR-1224在内的若干miRNAs能调控FAK表达抑制肿瘤的侵袭、转移[13]。本课题组采用双荧光素酶报告实验和Western blot法证实FAK是miR-138的下游靶基因,并进一步通过回复实验证实,在TNBC细胞中miR-138通过调控FAK发挥其生物学功能。
越来越多的研究表明:FAK可通过调控特定靶点及相关信号通路“驯化”肿瘤微环境的免疫细胞,促进肿瘤的恶性进展[14-16]。Rath等[15]发现FAK上调是导致胰腺癌纤维化和免疫耐受微环境形成的重要原因。Serrels等[16]证实FAK可以通过调节TGF-β和CCL5的表达量,增加肿瘤微环境调节性T细胞的数量,从而抑制CD8+T细胞的杀伤力。近期一项研究表明:FAK通过调控外泌体miRNAs表达谱,在乳腺癌转移中扮演着重要角色[17]。外泌体是由肿瘤细胞、上皮细胞及T细胞等多种细胞在胞吞过程中产生的直径30~150 nm的膜性囊泡[18-19],是参与肿瘤发生、发展及转移的重要介质。本组前期研究发现,低氧肿瘤细胞分泌的外泌体诱导巨噬细胞发生M2型极化,极化后的巨噬细胞通过分泌TGF-β、IL-10等促进肿瘤的侵袭、转移[20]。外泌体作为体内跨越不同生物屏障进行药物传递的有效工具,除作为化疗药物理想的载体外,对siRNA及miRNA等人工合成的核酸类物质也有非常好的传递作用。理论上,通过外泌体外源性导入miR-138能通过调控其下游靶基因FAK抑制肿瘤的侵袭、转移。截至目前,人们对外泌体miRNAs及FAK在肿瘤微环境中的作用机制以及相关信号通路方面的研究尚浅。现阶段外泌体释放、靶向运输机制尚未完全阐明,外泌体的人工修饰技术亦未完全成熟。倘若在未来能够攻克这些外泌体的理论和技术难题,通过外泌体导入miR-138可能会成为一种新的TNBC靶向治疗方案。
本实验结果表明,miR-138通过靶向调控FAK抑制TNBC的侵袭、转移。本研究仅初步探讨了miR-138在TNBC中的功能,仍有诸多难题亟待解决。如miR-138对体内肿瘤转移能力的影响如何,miR-138在TNBC细胞是否存在其他下游靶基因,miR-138在TNBC分泌的外泌体中表达是否存在差异以及差异表达的外泌体miR-138是否影响TNBC的侵袭、转移,高选择性FAK抑制剂如CT-707[21]、VS-6063[22]及BI 853520[23]等是否能抑制TNBC的恶性进展。本课题组将对以上问题开展后续实验以探明内在关系。
