基于PI3K/AKT/mTOR信号通路研究双氢青蒿素对人肝癌SMMC-7721细胞自噬的影响*
2022-04-07朱海洋孙会卿张淑凤吴贺文
朱海洋,孙会卿,张淑凤,吴贺文
1.郑州大学第五附属医院,河南 郑州 450052;2.河南省人民医院,河南 郑州 450003
肝细胞肝癌(hepatocellular carcinoma,HCC)是最常见的原发性肝脏恶性肿瘤,发病人数逐年增加,具有极高的发病率及病死率且易复发转移,预后极差,严重危害人类生命健康[1]。自噬是广泛存在于真核细胞内的一种分解细胞质等自身构成成分的生理现象,当自噬激活时,自身受损的细胞器及大分子物质被包裹在囊泡中,传递至溶酶体进行降解。研究表明,自噬与肿瘤、免疫性疾病及神经退行性疾病等多种疾病的发生发展过程密切相关,在HCC的进展过程中也发挥着重要作用,可促进肿瘤细胞发生凋亡或坏死,抑制肿瘤发展[2-4]。双氢青蒿素(dihydroartemisinin,DHA)是青蒿素的衍生物,具有水溶性好、吸收迅速、代谢快、不良反应小等优点,除具有抗疟作用外,还具有抗炎、免疫调节等多方面药理作用[5-7]。近年来的研究发现,DHA还具有抗肿瘤活性,对肺癌、前列腺癌等多种肿瘤细胞有显著抑制作 用[8-9]。DHA具 有 诱 导 肝 癌 细 胞 凋 亡 的 作用[10],但其是否通过调节自噬抑制肿瘤的发生发展尚不清楚。因此,本研究基于PI3K/AKT/mTOR信号通路研究DHA对人肝癌SMMC-7721细胞自噬的作用,以期为临床治疗HCC提供理论参考。
1 材料
1.1 细胞系人肝癌SMMC-7721细胞,购于中国科学院典型培养物保藏委员会细胞库,目录号:RKX1036。细胞培养于含有10%胎牛血清、100 U·mL-1青霉素及100 mg·L-1链霉素的RPMI 1640培养基中,37℃、5%CO2培养箱内常规培养。选择生长状态良好的细胞,加入冻存培养基,置于-80℃冰箱,第2天转至液氮中保存。
1.2 药物与试剂双氢青蒿素(dihydroartemisinin,DHA,成都瑞芬思生物科技有限公司,纯度>98%,货号:S-102)。胎牛血清、青霉素(纯度≥97%)、链霉素(纯度≥98%)、3-甲基腺嘌呤(3-methyladenine,3-MA)、MTT、二甲基亚砜、戊二醛溶液(美国Sigma-Aldrich公司,货号:12103C、19532、85886、189490、M2128、D5879、G5882);0.25%胰蛋白酶(美国Gibco公司,货号:25200072);乙醇(纯度≥99.5%)、丙醇(纯度≥99.9%)、柠檬酸铅(上海阿拉丁生化科技股份有限公司,货号:E111994、P110345、L303843);细胞自噬染色试剂盒(MDC法)、ECL化学发光法检测试剂盒(北京索莱宝科技有限公司,货号:G0170、SW2020);胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1,美国Biovision公司,货号:7507-20);BCA蛋白定量检测试剂盒(上海源叶生物科技有限公司,货号:R21250-250T);兔抗人磷脂肌酰醇3-激酶(phosphatidylinositide 3-kinase,PI3K)单抗、蛋白激酶B(protein kinase B,AKT)多抗、p-AKT多抗、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)单抗、p-mTOR单抗、Beclin1单抗、微管相关蛋白轻链3B(microtubule-associated protein light chain 3B,LC3B)单抗和HRP标记的山羊抗兔IgG(美国Abcam公 司,货 号:ab278545、ab8805、ab38449、ab134903、ab109268、ab210498、192890、ab150077)。
1.3 仪器MZDH0850型显微镜(美国Lignomat公司);IX53型倒置荧光显微镜(日本Olympus公司);Avanti J-E型高速离心机(美国Beckman公司,离心半径:8 cm);JEM-1230型透射电子显微镜(日本JEOL公司);E-Gel Imager凝胶成像仪(美国Invitrogen公司);DYY-4C型电泳仪(北京六一生物科技有限公司)。
2 方法
2.1 细胞培养取常规冻存的人肝癌SMMC-7721细胞,复苏,培养于含有10%胎牛血清、100 U·mL-1青霉素、100 mg·L-1链霉素的RPMI 1640培养基中,置于体积分数5% CO2的培养箱内37℃恒温培养。用0.25%胰蛋白酶消化传代,取对数生长期细胞用于实验。
2.2 MTT法检测细胞抑制率取对数生长期细胞,调整细胞密度为1×105mL-1,接种于96孔板,每孔100μL,常规培养待细胞贴壁后,弃去培养基,加入含有不同浓度(0μmol·L-1、6.25μmol·L-1、12.5μmol·L-1、25μmol·L-1、50μmol·L-1、100μmol·L-1)DHA的培养基,每个浓度设置5个复孔,分别培养24 h、48 h、72 h后,每孔加入5 g·L-1MTT溶液20μL,孵育4 h,弃上清,每孔加入150μL二甲基亚砜,充分震荡后,用酶标仪在490 nm处读取光密度(optical density,OD)值,计算细胞抑制率,绘制细胞增殖抑制曲线,计算半抑制浓度(inhibitory concentration 50,IC50),即抑制50%细胞生长时的DHA浓度,并将此浓度用于后续的实验研究。
细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%
2.3 细胞形态学观察取对数生长期细胞,调整细胞密度为1×105mL-1,接种于96孔板,每孔100μL,待细胞贴壁后,弃去培养基,加入“2.2项”中不同浓度DHA,培养48 h后,显微镜下观察细胞形态变化,并拍照记录。
2.4 透射电镜观察细胞自噬取对数生长期细胞,调整细胞密度为1×106mL-1,取10 mL细胞悬液,接种于直径90 mm的培养皿中,随机分为对照组、DHA组、抑制剂组和激动剂组,待细胞贴壁后弃去培养基,DHA组细胞以IC50剂量的DHA进行干预,抑制剂组加入含有IC50剂量的DHA+5 mmol·L-1的3-MA(PI3K的抑制剂)的培养基,激动剂组加入含有IC50剂量的DHA+100μg·L-1IGF-1(AKT的激动剂)的培养基,对照组采用常规培养基培养。培养48 h后,收集细胞,1 000 r·min-1离心10min,弃去培养液,加入2.5%的戊二醛溶液4℃固定72 h,1%四氧化锇固定30 min,梯度乙醇和丙醇脱水,树脂包埋,切片,醋酸铀和枸橼酸铅定位染色,置于电镜下观察细胞自噬情况。
2.5 MDC染色观察细胞自噬取对数生长期细胞,调整细胞密度为1×105mL-1,接种于6孔板,每孔2.5 mL,常规培养,待细胞贴壁后,分为对照组、DHA组、抑制剂组和激动剂组,按“2.4项”下所描述的方法处理细胞,培养48 h后,弃去培养液,1×wash buffer洗涤,每孔加入100μL MDC染液,室温避光染色45 min,离心收集细胞,1×wash buffer洗涤2次后,每孔滴加50μL抗淬灭封片液封片后4℃避光保存,荧光显微镜下(激发波长355 nm、阻断波长512 nm)观察细胞自噬情况。
2.6 Western Blot检测细胞中PI3K/AKT/m TOR信号通路相关蛋白及自噬相关蛋白的表达水平取对数生长期细胞,调整细胞密度为1×106mL-1,接种于培养瓶中,每瓶5mL,待细胞贴壁后,分为DHA组、抑制剂组、对照组和激动剂组,按“2.4项”下所描述方法处理细胞,培养48 h后,收集细胞。加入细胞裂解液,离心取上清,按照BCA蛋白测定试剂盒说明书要求测定蛋白浓度,校正上样量,加入SDS上样缓冲液,100℃水浴15 min,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),电泳结束后,转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,TBST洗膜3次,每次5 min,5%脱脂奶粉封闭2 h后,TBST洗膜2次,每次5 min,加入PI3K、AKT、p-AKT、mTOR、p-mTOR、LC3B、Beclin1、βactin一抗(1∶1 000),4℃孵育过夜,TBST洗膜3次,每次5 min,加入辣根过氧化物酶标记的二抗(1∶5 000),室温孵育2 h,TBST洗膜3次,每次5 min,根据ECL化学发光试剂盒说明书滴加发光液,曝光显影后采用凝胶成像分析系统进行灰度扫描。以目的蛋白灰度值与内参β-actin灰度值的比值表示目的蛋白相对表达水平。
2.7 统计学方法采用SPSS 25.0统计学软件分析数据,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 DHA对SMMC-7721细胞增殖的影响与0μmol·L-1组比较,不同浓度DHA作用于SMMC-7721细胞后,细胞增殖抑制率显著升高(P<0.05);与24 h比较,不同浓度DHA作用于SMMC-7721细胞48 h、72 h后,细胞增殖抑制率显著升高(P<0.05);与48 h比较,不同浓度DHA作用于SMMC-7721细胞72 h后,细胞增殖抑制率无明显差异(P>0.05)。根据细胞增殖抑制曲线,DHA干预SMMC-7721细胞24 h、48 h、72 h时的IC50值分别为(36.26±4.67)μmol·L-1、(49.68±6.01)μmol·L-1、(71.24±7.79)μmol·L-1。其中,50μmol·L-1DHA作用SMMC-7721细胞48 h时,对细胞的增殖抑制率接近48 h时的IC50值,因此,后 续 实 验 选 取50μmol·L-1DHA干 预SMMC-7721细胞48 h进行相关指标的检测。见图1。
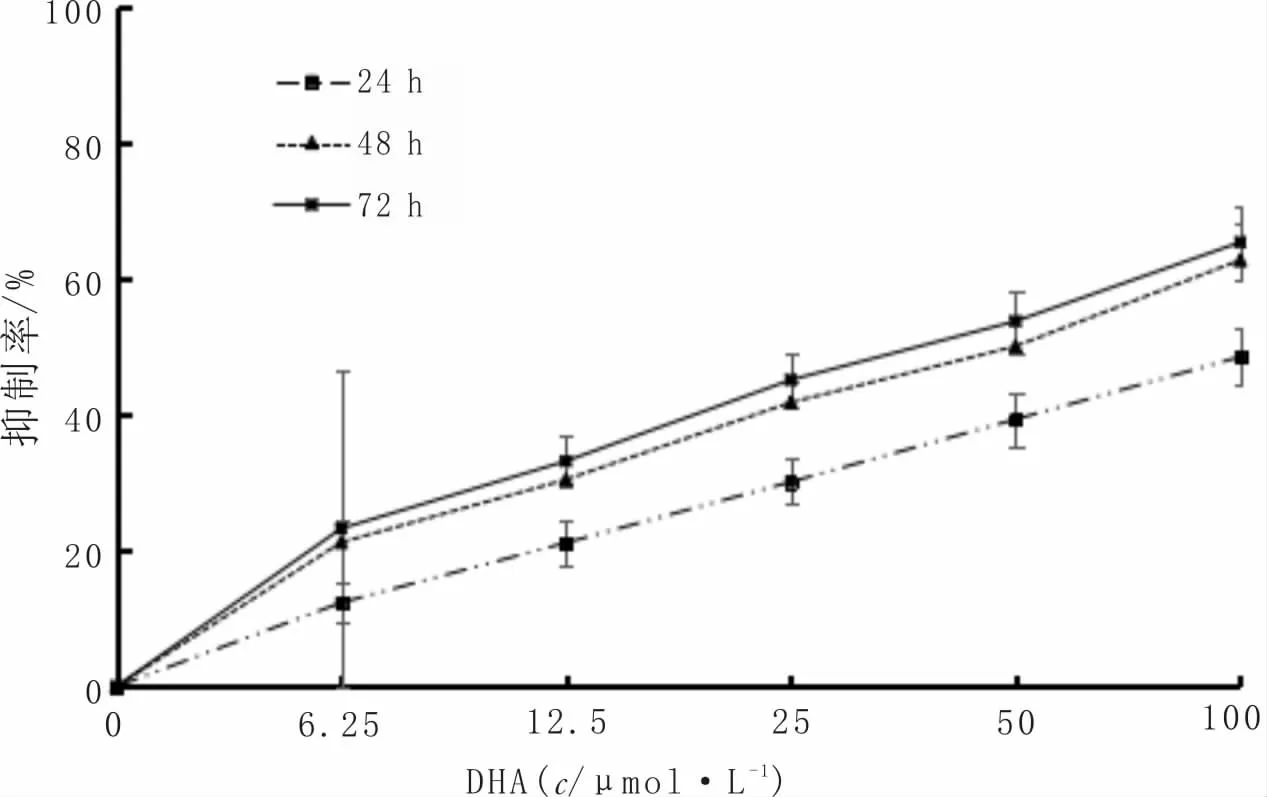
图1 DHA对SMMC-7721细胞增殖的抑制作用
3.2 不同浓度DHA对SMMC-7721细胞形态的影响0μmol·L-1组细胞形态正常,呈长梭形;其余各浓度DHA作用于细胞后,细胞逐渐失去原有形态,变短变圆,且随着浓度增加,变形细胞数目增加,细胞边缘模糊不清,不贴壁,悬浮于培养液中。见图
2。

图2 不同浓度DHA对SMMC-7721细胞形态的影响(×400)
3.3 透射电镜观察DHA对SMMC-7721细胞自噬的影响对照组可见内质网、溶酶体、高尔基复合体等正常细胞器,未见自噬泡;DHA组和抑制剂组可见圆形、大小不一、包裹细胞器或胞浆的自噬泡(箭头标注),细胞发生明显自噬;激动剂组细胞器清晰,可见少量自噬泡,细胞自噬程度较轻。提示DHA可诱导SMMC-7221细胞自噬,加入PI3K抑制剂后,不能阻断DHA诱导的SMMC-7221细胞自噬,而加入AKT激动剂后,可阻断DHA诱导的SMMC-7221细胞自噬。见图3。
3.4 MDC染色观察DHA对SMMC-7721细胞自噬的影响荧光显微镜下发现,对照组荧光强度较弱;DHA组和抑制剂组出现大量绿色荧光,荧光强度明显增强,细胞发生明显自噬;激动剂组荧光减弱,细胞自噬程度减轻。提示,DHA可促进SMMC-7221细胞自噬,加入PI3K抑制剂后,不能阻断DHA诱导的SMMC-7221细胞自噬,而加入AKT激动剂后,可阻断DHA诱导的SMMC-7221细胞自噬。见图4。

图4 MDC染色观察DHA对SMMC-7721细胞自噬的影响(×200)
3.5 DHA对SMMC-7721细胞中PI3K/AKT/m TOR信号通路相关蛋白及自噬相关蛋白表达的影响与对照组比较,DHA组、抑制剂组、激动剂组PI3K、p-AKT和p-mTOR蛋白相对表达量显著降低(P<0.05),LC3-Ⅱ/LC3-I和Beclin1蛋白相对表达量显著升高(P<0.05);与DHA组、抑制剂组比较,激动剂组PI3K、p-AKT和p-mTOR蛋白相对表达量显著升高(P<0.05),LC3-Ⅱ/LC3-I和Beclin1蛋白相对表达量显著降低(P<0.05)。提示,DHA可抑制SMMC-7221细胞中PI3K/AKT/mTOR信号通路激活,加入PI3K抑制剂后,不能阻断DHA对PI3K/AKT/mTOR信号通路的激活,而加入AKT激动剂后,可阻断DHA激活PI3K/AKT/mTOR信号通路。见表1,图5,图6。
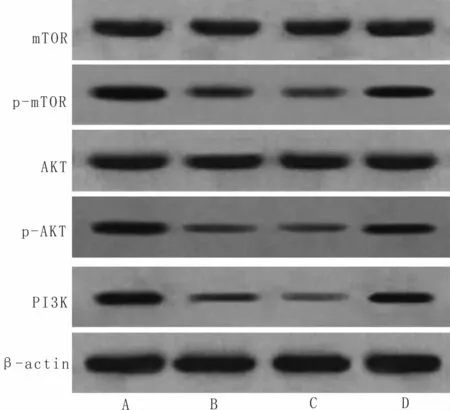
图5 SMMC-7721细胞中PI3K、AKT、p-AKT、m TOR、p-m TOR的蛋白表达比较
表1 SMMC-7721细胞中各蛋白表达水平比较 (±s,n=5)

表1 SMMC-7721细胞中各蛋白表达水平比较 (±s,n=5)
注:与对照组比较,a P<0.05;与DHA组比较,b P<0.05;与抑制剂组比较,c P<0.05
/LC3-I Beclin1对照组 0.68±0.07 0.86±0.09 0.51±0.07 0.92±0.09 0.5组别 PI3K AKT p-AKT mTOR p-mTOR LC3-Ⅱ9±0.06 0.25±0.05 0.19±0.04 DHA组 0.26+0.05a 0.87±0.08 0.15±0.04a 0.87±0.08 0.23±0.04a 1.23±0.09a 0.58±0.06a抑制剂组 0.21±0.04a 0.85±0.08 0.11±0.04a 0.83±0.08 0.21±0.04a 1.25±0.10a 0.55±0.05a激动剂组 0.55±0.06abc 0.88±0.09 0.38±0.05abc 0.93±0.09 0.46±0.05abc 0.82±0.09abc 0.38±0.04 abc
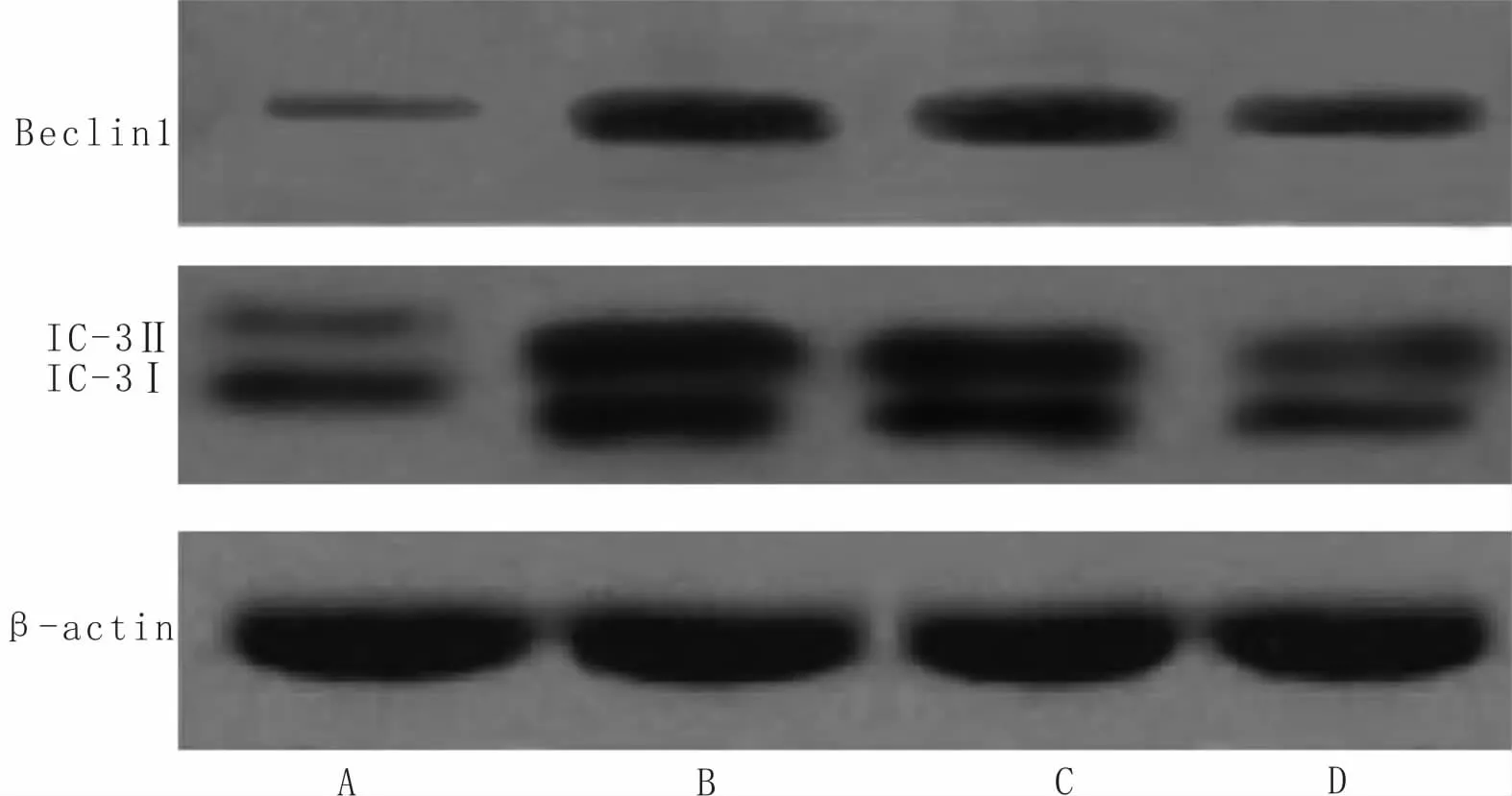
注:A:对照组;B:DHA组;C:抑制剂组;D:激动剂组
4 讨论
HCC是致死率最高的恶性肿瘤之一,目前临床上主要治疗手段为手术治疗及辅助放化疗,但是由于HCC复发率高、放化疗易使肿瘤细胞产生耐药性,导致HCC的预后极差[11-12]。因此,研究HCC的发病机制,寻找高效、低毒、安全的抗癌成分是临床工作者亟待解决的问题。
近年来的研究显示,从传统中草药青蒿中提取出的天然抗癌成分,在缓解患者临床症状、延缓病情方面疗效显著[13-14]。DHA是青蒿素的一种衍生物,能参与抑制肿瘤细胞增殖的多个环节,可通过抑制细胞增殖、诱导凋亡、介导细胞生长周期阻滞等发挥抗肿瘤活性[15-16]。同时,DHA的抗肿瘤活性还表现在诱导肿瘤细胞自噬,抑制细胞增殖等方面[17-18]。本研究采用不同浓度DHA作用于人肝癌SMMC-7721细胞发现,随着DHA浓度升高,细胞增殖抑制率升高,细胞形态发生明显改变,提示DHA对SMMC-7721细胞具有明显的增殖抑制作用。
自噬是细胞的一种自我分解代谢过程,是应急情况下维持细胞内环境稳定及代谢平衡的重要机制,其功能改变或缺失与肿瘤发生密切相关[19]。研究发现,自噬对HCC的发生发展表现出促进和抑制的双重作用,一方面,自噬可在HCC起始阶段抑制肿瘤发生发展;另一方面,自噬可在HCC发展过程中为肿瘤细胞提供营养,促进细胞增殖[20-21]。研究表明,DHA在细胞自噬过程中发挥重要作用,可诱导人脐静脉内皮细胞、人舌鳞状细胞癌细胞及胆管癌细胞系发生自噬,促进细胞凋亡[22-24]。本研究透射电镜观察发现,DHA组可见较多的自噬泡;同时MDC染色显示,DHA组荧光强度最强,提示DHA具有诱导SMMC-7721细胞自噬的作用。
自噬的发生由多种基因和蛋白通过多条信号通路共同发挥调控作用,其中PI3K/AKT/mTOR信号通路是负性调控自噬的经典途径,与多种肿瘤的发生发展有关。PI3K在自噬早期发挥重要作用,不同细胞因子刺激可导致PI3K被激活,进一步活化AKT,使AKT发生磷酸化,之后将信号传至mTOR,触发mTOR磷酸化,从而激活PI3K/AKT/mTOR信号通路,调控下游相关因子,对细胞自噬发挥抑制作用[25]。LC3是自噬体的标记蛋白,包括LC3-Ⅰ和LC3-Ⅱ两种剪切形式,自噬发生时LC3-Ⅰ向LC3-Ⅱ转化,LC3-Ⅱ是发生自噬的标志性蛋白,二者比值与自噬程度有关。Beclin1是自噬体形成过程中的必需分子,调控自噬体的形成与成熟。mTOR通过影响自噬体的形成,对自噬起负调控作用,PI3K蛋白可与Beclin-1形成复合物,参与溶酶体的形成,调控自噬。本研究发现,采用PI3K特异性抑制剂3-MA预处理细胞后,与对照组比较,细胞中LC3-Ⅱ、Beclin1蛋白表达水平显著升高,PI3K、p-AKT、p-mTOR表达水平显著下降;采用AKT特异性激动剂IGF-1预处理细胞后,细胞LC3-Ⅱ、Beclin1蛋白表达水平显著下降,PI3K、p-AKT、p-mTOR表达水平上升,表明PI3K/AKT/mTOR信号通路参与SMMC-7721细胞自噬。研究表明,miR-27a可通过靶向抑制PI3K/AKT/mTOR信号通路,促进骨关节炎关节软骨细胞的自噬和凋亡[26]。另外,抑制PI3K/AKT/mTOR信号通路,可促进自噬,减弱卵巢癌细胞恶性生物学特性[27]。本研究发现,DHA组细胞LC3-Ⅱ/LC3-I和Beclin1蛋白表达水平显著下降,PI3K、p-AKT和p-mTOR蛋白表达水平上升,与抑制剂组效果一致,而与激动剂作用相反,提示,DHA可能是通过抑制PI3K/AKT/mTOR信号通路发挥促进细胞自噬的作用。
综上所述,DHA可诱导人肝癌SMMC-7721细胞自噬,抑制细胞增殖,其机制可能与抑制PI3K/AKT/mTOR信号通路有关,为临床治疗HCC提供一定理论参考。
