青藤碱通过ERK1/2-GSK3β-NFκB信号通路对肾移植大鼠急性排斥反应的作用及机制研究*
2022-04-07王晓勃王长安吴秋杰
王晓勃,王长安,吴秋杰
郑州市第七人民医院,河南 郑州 450000
终末期肾病是各种肾脏疾病发展到肾衰竭阶段的共同综合征,肾移植是目前治疗终末期肾病最有效的方法,对于提高患者的生命质量具有重要意义[1]。随着临床移植水平的提高及各种新型免疫制剂的应用,肾移植效果得到显著改善,患者短期内的生活质量明显提高,但长期存活率依然较低[2-3]。肾移植术后的急性排斥反应仍是术后最主要的难题,也是导致慢性排斥反应和移植肾失功的首要原因,同时长期使用免疫抑制剂给患者带来较大不良反应,影响患者长期生活质量[4]。因此,寻找一种安全有效的抑制急性排斥反应的药物,是保证移植肾长期存活的关键。青藤碱(sinomenine,SIN)是从中药青风藤中提取的一种生物碱单体,具有抗炎、抗肿瘤、免疫抑制等药理学作用,对多种疾病均有较好疗效[5-6]。既往研究显示,SIN具有阻滞免疫应答减少排斥反应的作用[7],但其具体作用机制研究尚少。本研究通过建立同种异体肾移植大鼠模型,探讨SIN在肾移植急性排斥反应中的作用,为SIN用于临床治疗肾移植急性排斥反应提供理论基础。
1 材料
1.1 动物供体:Wistar大鼠,雄性,80只,7~8周龄,体质量(270±20)g,受体:SD大鼠,雄性,90只,7~8周龄,体质量(250±20)g,所有大鼠均为SPF级,购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0001。大鼠购入后保持温度(23±2)℃,湿度(50±5)%,明暗周期12 h/12 h循环,适应性饲养7 d。本研究经郑州市第七人民医院伦理委员会审核通过,伦理批号:20191015031。
1.2 药物与试剂青藤碱(≥98%,每支20 mg,成都曼斯特生物科技有限公司,批号:191016);环孢素A(cyclosporin A,CsA)注射剂(≥99%,每支250 mg,挪威Sandoz公司,货号:B28163);戊巴比妥钠(青岛捷世康生物科技有限公司,批号:191203);肝素钠(武汉德晟生化科技有限公司,批号:190901);平衡盐溶液(北京百奥莱博科技有限公司,货号:GL1724);注射用青霉素钠(山东鲁抗医药股份有限公司,批号:191108);甲醛溶液(美国Merck公司,货号:47608);白细胞介素(interleukin,IL)-2、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫分析检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:191015、190906);Trizol试剂盒(美国Invitrogen公司,货号:15596-018);反转录试剂盒(日本TaKaRa公司,货号:RR036A),兔抗大鼠细胞外信号调节激酶1/2(extranal-signal regulated kinase 1/2,ERK1/2)、p-ERK1/2、糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)、p-GSK3β、核转录因子κB(nuclear transcription factor κB,NF-κB)p65、p-NF-κB p65一抗(美国Abcam公司,货号:ab17942、ab126445、ab185141、ab68476、ab239882、ab239882)。
1.3 仪器AU5800型全自动生化分析仪(Beckman Coulter);M10125型PCR仪、Experion型电泳仪(美国Bio-Rad公司)。
2 方法
2.1 大鼠肾移植急性排斥模型的建立及分组取80只Wistar供体大鼠,术前12 h禁食不禁水,按1 mL·kg-1腹腔注射体积分数3%戊巴比妥钠进行麻醉,仰卧固定后,由剑突至耻骨联合,腹部正中切口,暴露腹腔,钝性分离输尿管及膀胱,游离腹主动脉及下腔静脉,结扎周围血管,游离左肾及肾动静脉,结扎肾上腺动静脉。用血管夹夹闭腹主动脉,将4℃肝素平衡盐溶液(含肝素钠625 U·mL-1)灌注左肾,结扎左肾静脉,待供体肾颜色变为黄白色,肾静脉流出液体变清亮时停止灌注,切断左肾相关联的输尿管、腹主动脉和下腔静脉取下,剪去供肾多余的脂肪组织及下腔静脉,适当修整后放入4℃肝素平衡盐溶液中保存。取80只SD受体大鼠麻醉后暴露左肾并切除,将供肾置入受体腹腔,静脉端行端端吻合,动脉端行端侧吻合,打开血管夹,供肾充血变红,输尿管周围可见明显渗血,连续缝合腹壁肌层。术后肌肉注射青霉素10万单位,连续3 d,预防感染,其余10只SD大鼠设为假手术组,开腹后游离左肾,不做切除,之后关腹,其他操作同上。将手术成功68只大鼠随机分为模型组17只,SIN低剂量组17只,SIN高剂量组17只,阳性对照组17只。
2.2 干预方法术后24 h,盐酸青藤碱用生理盐水稀释成质量分数1%的溶液,CsA用生理盐水稀释成0.25%的溶液,SIN低剂量组、SIN高剂量组分别按15 mg·kg-1、30 mg·kg-1体质量腹腔注射盐酸青藤碱溶液,阳性对照组按5 mg·kg-1体质量腹腔注射CsA,每天1次,假手术组和肾移植组大鼠腹腔注射等量生理盐水,至受体鼠死亡。
2.3 观察生存时间术后大鼠正常饲喂,模型组、SIN低剂量组、SIN高剂量组、阳性对照组随机各取8只大鼠,用于观察大鼠存活时间。
2.4 检测肾功能移植7 d后,模型组、SIN低剂量组、SIN高剂量组、阳性对照组剩余大鼠及假手术组大鼠,麻醉后,腹主动脉采血5mL,2 500 r·min-1(离心半径10 cm)离心20 min,取上清,一部分使用全自动生化分析仪检测血清肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)水平;另一部分于-20℃保存。
2.5 检测血清IL-2、TNF-α水平取保存血清,采用酶联免疫分析法检测血清IL-2、TNF-α水平,操作步骤严格按照ELISA试剂盒说明书,反应结束后,用酶标仪在波长450 nm处读取吸光值,根据标准品浓度和吸光值绘制标准曲线,计算各组大鼠血清IL-2、TNF-α水平。
2.6 观察肾组织病理学变化采血完毕,处死大鼠,摘取左肾,沿冠状面切开后,一半置于40 ng·L-1中性甲醛中固定24 h,取出固定好的肾脏标本,依次进行浓度梯度酒精脱水,通过二甲苯透明,放入液体石蜡进行包埋,冷却后切片(片厚约4μm),行常规HE染色,中性树胶封片后,于显微镜下观察肾形态学变化。按照Banff肾移植病理分类[8],分别对小动脉内膜增生、肾小管萎缩、间质纤维化、肾小球硬化、单个核细胞浸润等损害进行评分,每项得分0~3分,采用双盲法由2名人员单独对每只大鼠进行评分,取两人评分的均值作为最终评分。
2.7 检测大鼠肾脏ERK1/2 mRNA、GSK3βm RNA、NF-κB p65 mRNA水平左肾另一半置于液氮中保存。取液氮保存肾组织70 mg,使用Trizol试剂盒说明书提取总RNA,测定其纯度和浓度,取总RNA按照反转录试剂盒说明书反转录成cDNA,引物由上海生工生物技术有限公司合成,引物序列见表1。反应体系包括:模板cDNA 2μL,上下游引物各1μL,Taq DNA聚合酶10μL,双蒸水6μL。以β-actin为内参,进行PCR扩增。扩增条件:95℃预变性3 min,95℃变性30 s、60℃退火30 s、72℃延伸30 s,35个循环。采用2-△△CT法计算目的基因的相对表达水平。

表1 引物序列
2.8 检测大鼠肾脏ERK1/2、GSK3β、NF-κB p65及其磷酸化蛋白水平取液氮保存的肾脏80 mg,冰上研磨,离心取上清,加入RIPA裂解液裂解细胞,BCA法检测蛋白浓度,100℃水浴5 min蛋白变性,蛋白上样进行SDS-PAGE凝胶电泳,半干法将蛋白转移至PDVF膜,5%脱脂牛奶摇床封闭1 h,TBST溶液洗膜,加入稀释的一抗ERK1/2、p-ERK1/2、GSK3β、p-GSK3β、NF-κB p65、p-NFκB p65(1∶2 000)、β-actin(1∶4 000)4℃摇床过夜,TBST溶液洗膜,加入HRP标记的稀释后的二抗(1∶5 000),室温摇床孵育1 h,TBST溶液洗膜,滴加ECL试剂,暗室下显影、曝光成像。通过Image J软件分析图像,以目的蛋白与内参蛋白条带灰度比值表示目的蛋白的相对表达水平。
2.9 统计学方法采用SPSS 24.0统计软件分析数据,计量资料以平均值±标准差(±s)表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD-t检验。P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠存活时间比较与模型组比较,SIN低、高剂量组和阳性对照组大鼠平均存活时间极显著延长(P<0.01);与SIN低剂量组比较,SIN高剂量组和阳性对照组大鼠平均存活时间极显著延长(P<0.01)。见表2。
表2 大鼠存活时间比较 (±s,d)
注:与模型组比较,**P<0.01;与SIN低剂量组比较,##P<0.01,###P<0.001
存活时间模型组组别 n 7.96±0.83 SIN低剂量组 9 9.72±0.98**SIN高剂量组 9 11.75±1.16**##阳性对照组 9 12.14±1.25**###9
3.2 各组大鼠血清Scr、BUN水平比较与假手术组比较,模型组血清Scr、BUN水平升高(P<0.05);与模型组比较,SIN低、高剂量组和阳性对照组血清Scr、BUN水平降低(P<0.05);与SIN低剂量组比较,SIN高剂量组和阳性对照组大鼠血清Scr、BUN水平极显著降低(P<0.05)。见表3。
表3 各组大鼠血清Scr、BUN水平比较(±s)

表3 各组大鼠血清Scr、BUN水平比较(±s)
注:与假手术组比较,***P<0.001;与模型组比较,###P<0.001;与SIN低剂量组比较,△△P<0.01,△△△P<0.001
组别 n Scr(c/μmol·L-1)BUN(c/mmol·L-1)10 68.26±10.54 9.16±3.01模型组 9 163.58±16.21*** 53.25±5.29***SIN低剂量组 9 122.98±15.13### 36.13±3.32###SIN高剂量组 9 97.56±12.22###△△ 22.49±2.56###△△△阳性对照组 9 93.21±13.14###△△△20.18±2.61###假手术组△△△
3.3 各组大鼠血清IL-2、TNF-α水平比较与假手术组比较,模型组大鼠血清IL-2、TNF-α水平极显著升高(P<0.01);与模型组比较,SIN低、高剂量组和阳性对照组大鼠血清IL-2、TNF-α水平极显著降低(P<0.001);与SIN低剂量组比较,SIN高剂量组和阳性对照组血清IL-2、TNF-α水平极显著降低(P<0.01)。见表4。
表4 各组大鼠血清IL-2、TNF-α水平比较 (±s)
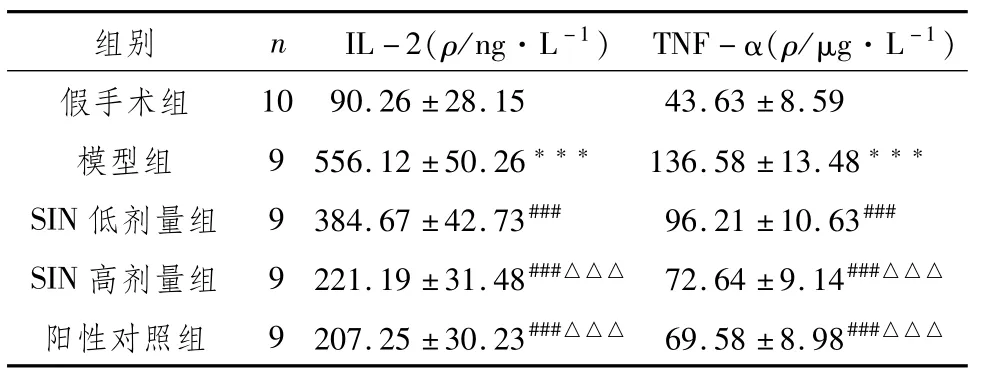
表4 各组大鼠血清IL-2、TNF-α水平比较 (±s)
注:与假手术组比较,***P<0.001;与模型组比较,###P<0.001;与SIN低剂量组比较,△△△P<0.001
组别 n IL-2(ρ/ng·L-1)TNF-α(ρ/μg·L-1)10 90.26±28.15 43.63±8.59模型组 9 556.12±50.26*** 136.58±13.48***SIN低剂量组 9 384.67±42.73### 96.21±10.63###SIN高剂量组 9 221.19±31.48###△△△72.64±9.14###△△△阳性对照组 9 207.25±30.23###△△△69.58±8.98###假手术组△△△
3.4 大鼠肾脏形态学变化假手术组大鼠肾脏肾小管及肾间质结构正常,未见明显损伤;模型组大鼠肾小管上皮细胞肿胀,部分细胞出现坏死、萎缩,肾间质充血,出现管型和间质内炎细胞浸润;SIN低剂量组、SIN高剂量组和阳性对照组均有不同程度改善,肾间质充血缓解,炎性细胞浸润减少。见图1。
与模型组比较,SIN低、高剂量组和阳性对照组Banff评分极显著降低(P<0.001);与SIN低剂量组比较,SIN高剂量组和阳性对照组Banff评分降低(P<0.05)。见图1。
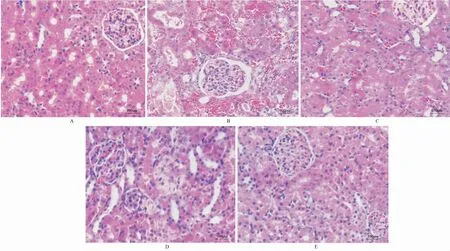
图1 各组大鼠肾脏病理学改变(HE染色,×200)
表5 肾组织Banff评分比较 (±s,分)
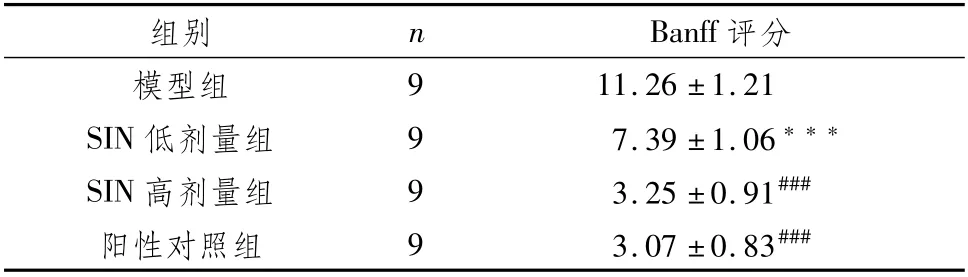
表5 肾组织Banff评分比较 (±s,分)
注:与模型组比较,***P<0.001;与SIN低剂量组比较,###P<0.001
评分模型组组别 n Banff 11.26±1.21 SIN低剂量组 9 7.39±1.06***SIN高剂量组 9 3.25±0.91###阳性对照组 9 3.07±0.83 9###
3.5 各组大鼠肾脏ERK 1/2、GSK 3β、NF-κB p65蛋白及其磷酸化蛋白水平比较与假手术组比较,模型组大鼠肾脏p-ERK1/2、p-GSK3β、p-NFκB p65蛋白相对表达量升高(P<0.05);与模型组比较,SIN低剂量组、SIN高剂量组、阳性对照组大鼠肾脏p-ERK1/2、p-GSK3β、p-NF-κB p65蛋白相对表达量降低(P<0.05);与SIN低剂量组比较,SIN高剂量组、阳性对照组p-ERK1/2、p-GSK3β、p-NF-κB p65蛋白相对表达量降低(P<0.05)。见表6,图2。
表6 各组大鼠肾脏p-ERK 1/2/ERK 1/2、p-GSK3β/GSK3β和p-NF-κB p65/NF-κB p65比较 (±s)

表6 各组大鼠肾脏p-ERK 1/2/ERK 1/2、p-GSK3β/GSK3β和p-NF-κB p65/NF-κB p65比较 (±s)
注:与假手术组比较,***P<0.001;与模型组比较,###P<0.001;与SIN低剂量组比较,△△P<0.01,△△△P<0.001
B p65假手术组组别 n p-ERK1/2/ERK1/2 p-GSK3β/GSK3β p-NF-κB p65/NF-κ 10 0.34±0.06 0.42±0.06 0.32±0.05模型组 9 0.99±0.08*** 0.96±0.09*** 0.97±0.09***SIN低剂量组 9 0.77±0.07### 0.77±0.08### 0.78±0.08###SIN高剂量组 9 0.60±0.07###△△△ 0.62±0.07###△△ 0.53±0.06###△△△阳性对照组 9 0.55±0.06###△△△ 0.61±0.07###△△△ 0.50±0.07###△△△

图2 肾组织各蛋白表达水平
4 讨论
肾移植是目前最成熟的器官移植手术之一,受者术后需使用免疫抑制剂(如CsA等)以控制肾术后急性排斥反应[9-10]。但免疫抑制剂存在肝、肾毒性及骨髓移植等不良反应,导致机体免疫力下降、感染增加,降低移植肾存活时间,减少免疫抑制剂对患者的困扰,延长移植肾存活时间,成为肾移植方向急需解决的问题[11]。研究显示,多种中药及其活性成分在抑制免疫方面具有显著效果,为解决同种异体肾移植排斥反应提供新的方法和途径[12-13]。青风藤在我国民间用于风湿痹痛历史悠久,SIN是青风藤主要活性成分,临床上用于类风湿类关节炎等多种自身免疫性疾病的治疗,疗效确切、安全性高,在器官移植术后的抗免疫排斥也凸显出良好效果,逐渐用于多方面免疫耐受的研究[14]。
当肾功能受损时,会导致Scr、BUN无法排出,浓度升高。IL-2可促进排斥反应发生,逆转已经产生的免疫耐受,TNF-α能促进炎症因的产生,发生放大效应,加重炎症细胞的聚集和浸润。SIN是从中药中提取的生物活性碱,在创伤性脊髓损伤、脓毒症等疾病中具有明显抗炎效果[15-16]。研究显示,SIN可通过降低移植物中的炎症因子,对移植器官产生抗免疫排斥作用[17]。本研究发现,SIN各组较模型组大鼠生存时间延长,大鼠血清Scr、BUN、IL-2、TNF-α水平降低,Banff评分降低,病理损伤得到改善,且SIN高剂量组与CsA的阳性对照组效果相当,提示SIN可降低肾移植大鼠炎性反应、抗肾移植急性排斥反应,发挥肾保护作用。研究报道,SIN可延长皮肤移植小鼠模型中移植皮片的存活时间,降低血浆IL-2水平,具有抑制免疫排斥反应的作用[18]。研究显示,SIN可降低肝细胞癌大鼠模型肝移植术后炎症因子水平,抑制细胞免疫反应[19]。邓卫平等[20]在巨细胞病毒性肝炎模型大鼠中得到类似结果,SIN相关制剂可阻断抗原递呈作用,减轻肝移植术后急性排斥反应。以上研究均提示,SIN在器官移植方面的抗排斥反应作用,本研究结果也显示SIN对同种异体肾移植大鼠具有一定抑制急性排斥反应作用,发挥肾保护作用。
ERK1/2是一种丝氨酸/苏氨酸类激酶,磷酸化活化后通过促使细胞内外信号转移,调控细胞的增殖、凋亡、分化等[21]。GSK3β与多条信号通路关系密切,表达失调可引起肿瘤、神经性疾病、糖尿病等多种疾病[22-24]。NF-κB在体内广泛参与炎症调节过程,通常以p50-p65异二聚体的形式存在呈非活化状态,活化后产生多种细胞因子参与炎症反应[25]。器官移植后,活化的ERK1/2通过磷酸化下游GSK3β,进而激活NF-κB,诱导下游炎症细胞因子释放,促进炎症细胞浸润,加重排斥反应[26]。研究证实,p-GSK3β和p-NF-κB p65表达异常升高,与器官移植后移植物失功有密切关系[27]。ERK1/2表达降低后,可显著抑制p-GSK3β表达,进而调控ERK1/2-GSK3β-NF-κB信号通路,减轻炎症反应[28]。研究显示,ERK1/2活化被抑制后,通过下游级联反应,降低NF-κB表达,减轻细胞炎症反应[29]。研究表明,激活ERK1/2-GSK3β-NF-κB信号通路可引起大鼠肾移植术后炎症反应,促进慢性肾失功进展,而抑制该通路后,可延缓肾失功进展[30]。本研究SIN各组大鼠肾脏p-ERK1/2、p-GSK3β、p-NF-κB p65表达均较模型组显著下降,提示SIN减轻肾移植大鼠急性排斥反应可能是与抑制ERK1/2-GSK3β-NF-κB信号通路有关。通过降低ERK1/2磷酸化水平,进而抑制其下游GSK3β活化,减轻炎症反应,减轻移植术后排斥反应。
综上所述,SIN具有一定抗肾移植大鼠移植术后急性排斥反应的作用,可能是通过阻滞ERK1/2-GSK3β-NF-κB信号通路活化发挥抑制作用,为临床治疗肾移植术后急性排斥反应提供一定实验依据。
