大蒜素对大鼠血管平滑肌细胞迁移的影响及机制研究*
2022-04-07李雯静黄丽雯
李雯静,黄丽雯
武汉科技大学附属天佑医院,湖北 武汉 430064
支架内再狭窄是经血管介入治疗后的一种常见并发症[1]。据统计,在血管介入治疗并成功植入药物洗脱支架的心脑血管疾病患者中,支架内再狭窄发生率约为10%[2]。支架内再狭窄的病理进程中,位于血管中膜的血管平滑肌细胞(vascular smooth muscle cell,VSMC)的迁移和增殖发挥着重要的作用[3]。VSMC在细胞因子及炎症因子等的诱导下,从血管中膜迁移至内膜并进行大量增殖从而引起内膜新生是支架内再狭窄发生的重要机制之一[4]。因此,有效抑制VSMC迁移是预防支架内再狭窄的有效方法。大蒜素是大蒜的主要活性成分,具有多种生物学活性。研究发现,大蒜素在抑制炎症反应及抗肿瘤细胞迁移等方面具有显著作用[5-7]。动物实验显示,大蒜素可以减轻支架内再狭窄[8-9],但其作用机制却未见报道。因此,本研究旨在从NF-κB信号通路出发阐明大蒜素发挥抑制血管再狭窄的作用机制。
1 材料
1.1 动物4周龄SPF级SD雄性大鼠5只,体质量100~140 g,购自湖北省实验动物中心,许可证号:SCXK(鄂)2015-0018,饲养于SPF级环境中,温度为25℃,相对湿度为50%,12 h光照/12 h黑暗,噪音在80 dB以下。本研究已获得武汉科技大学附属天佑医院伦理委员会批准,批准编号:WKDTY20190703。
1.2 药物与试剂大蒜素(纯度≥98%,德国默克公司,货号:17795-26-5);脂多糖(lipopolysaccharide,LPS)、BCA蛋白浓度检测试剂盒、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG(H+L)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔单克隆抗体、平滑肌细胞标志蛋白(α-smooth muscle actin,α-SM-actin)兔多克隆抗体、极超敏ECL化学发光试剂盒(上海碧云天生物技术有限公司,货号:ST1470、P0010S、A0208、AF1186、AF0048、P0018FS);细胞计数试剂盒-8(cell counting kit-8,CCK-8,日本同仁化学研究所,货号:CK04);核转录因子-κB p65(nuclear factor-κB p65,NF-κB p65)兔单克隆抗体、p-NF-κB p65兔单克隆抗体(美国CST公司,货号:8242、3033);DMEM/F12培养基(美国Hyclone公司,货号:SH30023.01);类胎牛血清(浙江天杭生物科技股份有限公司,货号:70220-8611);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-R2856c、E-EL-R0015c)。
1.3 仪器SW-CJ-2FD型超净工作台(吴江市博士净化设备有限公司);BXFM型显微镜(日本Olympus Corporation公司);Incubator 3131型CO2培养箱(美国Thermo Fisher Scientific公司);HNY-100D型温控摇床(长沙三利仪器仪表有限公司);Infinite M200 Pro型酶标仪(瑞士TECAN公司);Neofuge 18R型离心机(力康生物医疗科技控股有限公司,离心半径:9 cm);Mini-PROTEAN Tetra型电泳仪、Mini-Trans-Blot型电转仪、ChemiDoc MP型化学发光成像系统、Image Lab 6.0成像系统(美国Bio-Rad公司);Image J 1.51w软件(美国国立卫生研究院)。
2 方法
2.1 大鼠胸主动脉平滑肌细胞的分离培养和鉴定
根据文献[10]所述,获取大鼠胸主动脉血管平滑肌细胞,并采用组织块贴壁法进行培养,用抗大鼠α-SM-actin抗体进行免疫荧光染色鉴定,确定为VSMC。细胞纯度达到95%以上的第3代至第5代VSMC用于后续实验。
2.2 CCK-8检测细胞活力调整VSMC密度为2.0×105mL-1,接种于96孔板中,每孔100μL。待细胞生长融合至80%时,将细胞饥饿处理24 h。采用100μL含 不 同 浓 度(5μmol·L-1、10μmol·L-1、20μmol·L-1、40μmol·L-1、60μmol·L-1、80μmol·L-1、100μmol·L-1)大蒜素或0.1%DMSO(对照组)的无血清DMEM/F12培养基培养细胞,每个浓度设置6个复孔。24 h后弃去培养液,每孔加入100μL含10% CCK-8试剂的无血清培养液继续培养2 h,使用酶标仪检测各孔在450 nm处的光密度(optical density,OD)值。
2.3 细胞划痕实验调整VSMC密度为2.0×105mL-1,每孔1.5mL,接种于6孔板中。待细胞融合至100%时,更换无血清培养液饥饿处理24 h。使用1 mL的移液枪头竖直在各组培养皿底壁划一个“十”字形划痕,使用PBS冲洗2次后在显微镜下拍取划痕图片,记为0 h划痕。将细胞分为对照组、模型组及大蒜素组,对照组加入1.5 mL含1%类胎牛血清的培养液,模型组加入1.5mL含1%类胎牛血清+1 mg·L-1LPS的培养液,大蒜素组加入1.5 mL含1%类胎牛血清+1 mg·L-1LPS+40μmol·L-1大蒜素的培养液,继续培养48 h,显微镜下观察相同位置,拍取划痕图片,记为48 h划痕。使用Image J软件统计各组划痕面积,计算各组细胞的迁移率。实验重复3次。
细胞迁移率=[划痕面积(0 h)-划痕面积(48 h)]/划痕面积(0 h)
2.4 Transwell实验将VSMC分为对照组、模型组及大蒜素处理组。采用无血清培养液将VSMC密度调整为3.0×105mL,在Transwell培养板上室加入200μL细胞悬液。对照组下室加入600μL含有10%类胎牛血清FBS的培养液,模型组下室加入600μL含有10%类胎牛血清+1 mg·L-1LPS的培养液,大蒜素组下室加入600μL含有10%类胎牛血清+1 mg·L-1LPS+40μmol·L-1大蒜素的培养液。培养18 h后取出小室,PBS小心冲洗3次,每次5 min,将上室底部内面未穿过的细胞轻轻擦去,4 ng·L-1多聚甲醛室温固定15 min,PBS冲洗3次,使用1 mg·L-1DAPI在室温下避光染色2 min,PBS洗涤后在荧光显微镜下拍取被染色的细胞核的代表性图片,使用Image J软件进行细胞计数。实验重复3次。
2.5 Western Blot检测蛋白表达根据文献[11]所述进行操作,具体如下:将细胞分为对照组、模型组和大蒜素组,待3组细胞融合至50%时,更换无血清培养液饥饿处理24 h,对照组给予含10%类胎牛血清的培养基,模型组给予含10%类胎牛血清+1 mg·L-1LPS的培养基,大蒜素组给予含10%类胎牛血清+1 mg·L-1LPS+40μmol·L-1大蒜素的培养基,培养24 h后提取各组细胞总蛋白,根据BCA蛋白浓度测定试剂盒操作说明书测定各组蛋白浓度,然后加入上样缓冲液煮沸后备用。取等量蛋白质进行上样,电泳、电转后室温封闭2 h。加抗NF-κB p65(1∶1 000)、抗p-NF-κB p65(1∶1 000)、抗GAPDH一抗(1∶1 000),4℃水平摇床中孵育过夜。PBST洗涤3次,每次5 min;加入HRP标记的二抗(1∶4 000),室温孵育1~2 h。然后放入化学发光成像系统,滴加按等体积配好的化学发光试剂A液和B液,打开Image Lab成像系统拍取图像,通过软件测定各蛋白条带的灰度值,然后进行半定量分析。
2.6 ELISA法测定细胞培养液中TNF-α、IL-6含量将细胞分为对照组、模型组和大蒜素组,待三组细胞融合至50%时,更换无血清培养液饥饿处理24 h,对照组给予含10%类胎牛血清的培养基,模型组给予含10%类胎牛血清+1 mg·L-1LPS的培养基,大蒜素组给予含10%类胎牛血清+1 mg·L-1LPS+40μmol·L-1大蒜素的培养基,继续培养24 h后收集各组细胞培养液,4℃、3 000 r·min-1离心去除细胞碎片,按照ELISA试剂盒说明书操作,检测细胞培养上清液中TNF-α、IL-6的水平。每组设6个复孔。
2.7 统计学方法采用SPSS 22.0统计软件进行数据分析。结果以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较用t检验。P<0.05表示差异具有统计学差异。
3 结果
3.1 大蒜素对VSMC活力的影响与对照组比较,大蒜素浓度为80μmol·L-1和100μmol·L-1时,VSMC活力明显减弱(P<0.05);当大蒜素浓度≤60μmol·L-1时,对VSMC活力无明显影响(P>0.05),故本实验选取40μmol·L-1大蒜素进行后续实验。见图1。

图1 大蒜素对血管平滑肌细胞活力的影响
3.2 大蒜素对VSMC迁移的影响细胞划痕实验结果显示:与对照组比较,模型组VSMC迁移率显著提高(P<0.01);与模型组比较,大蒜素组VSMC迁移率明显降低(P<0.01)。Transwell实验结果显示:与对照组比较,模型组穿出小室的细胞数显著增多(P<0.01);与模型组比较,大蒜素组穿出小室的细胞数明显减少(P<0.01)。见图2。

图2 大蒜素对血管平滑肌细胞迁移的影响
3.3 大蒜素对NF-κBp65和p-NF-κB p65蛋白表达的影响与对照组比较,模型组p-NF-κB p65/NF-κB p65的水平显著增加(P<0.01);与模型组比较,大蒜素组p-NF-κB p65/NF-κB p65的水平明显降低(P<0.01)。见图3。
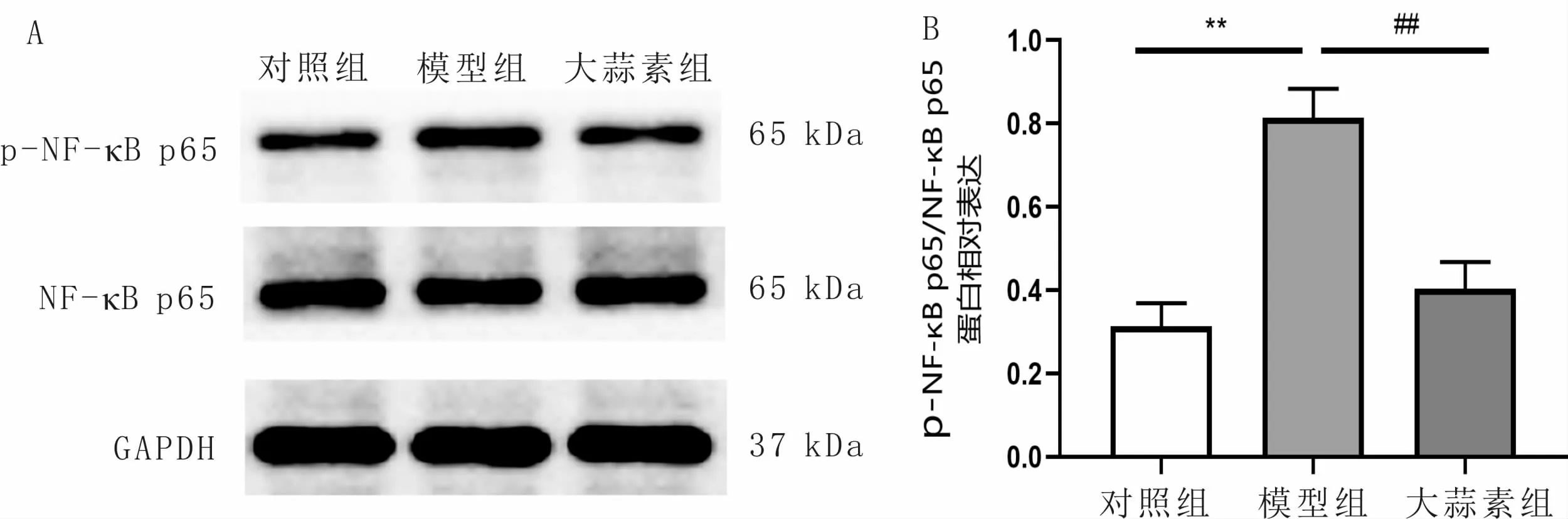
图3 大蒜素对各组细胞内p-NF-κB p65和NF-κB p65蛋白表达的影响
3.4 大蒜素对VSMC培养液中炎症因子水平的影响与对照组比较,模型组细胞培养液中TNF-α和IL-6的水平显著升高(P<0.01);与模型组比较,大蒜素组细胞培养液中TNF-α和IL-6的水平显著降低(P<0.01)。见图4。
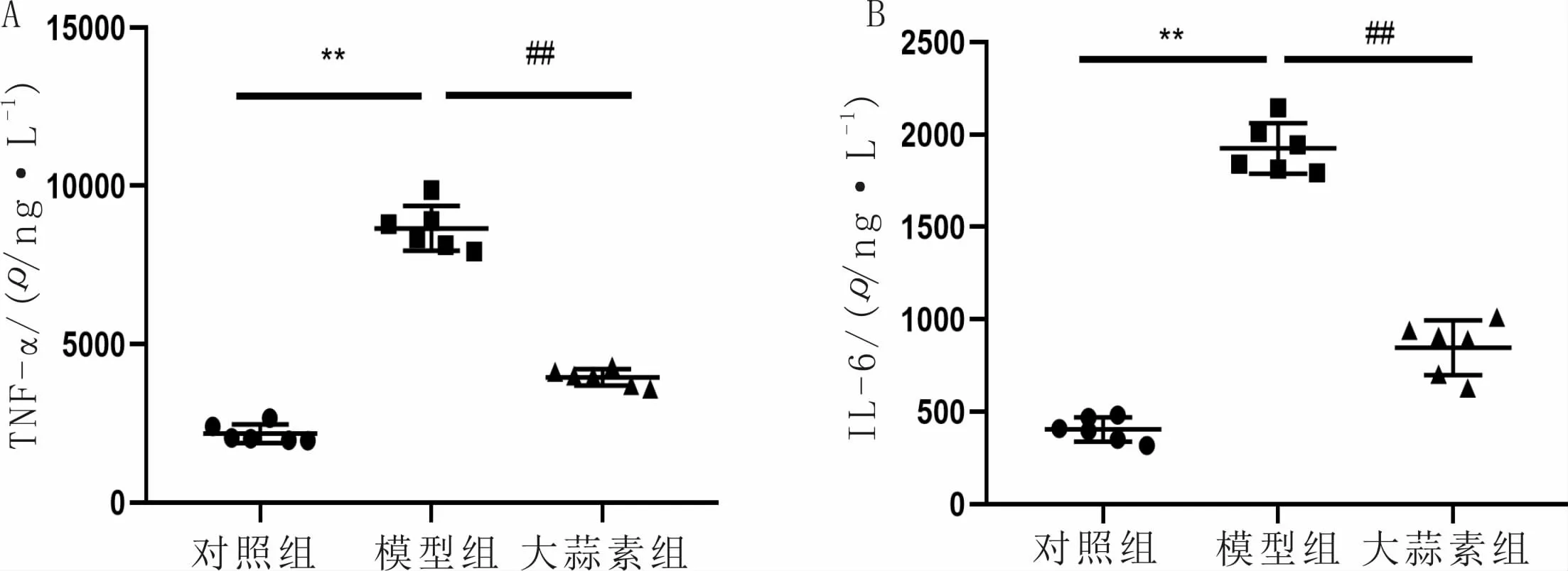
图4 大蒜素对VSMC培养液中炎症因子水平的影响
4 讨论
持续性炎症反应可通过促进VSMC的迁移和增殖在不良的血管重塑、血管增生或闭塞性疾病(包括动脉粥样硬化、支架内再狭窄和静脉移植失败)中起关键作用[12]。本研究考察了大蒜素在LPS介导的大鼠胸主动脉VSMC迁移中的潜在作用,发现大蒜素可显著抑制VSMC迁移能力,同时可明显降低VSMC培养液中炎症因子TNF-α和IL-6的浓度,抑制VSMC内NF-κB p65磷酸比。
经皮腔内血管成形术、支架植入术及搭桥术等在内的介入或外科手术均可通过恢复严重狭窄或闭塞血管的血供有效改善患者预后[13-14]。然而,随着术后时间的延长,机体的炎症反应及其诱导的VSMC迁移至血管内膜并大量增殖常会导致血管再次狭窄甚至重新闭塞[15-17]。研究显示,血管壁的损伤可诱导多种促细胞迁移的炎症介质表达,而有效抑制血管壁损伤后的炎症反应,可明显减弱血管内VSMC迁移至内膜及过度增殖,从而起到抑制内膜新生的作用,降低血管再狭窄或闭塞的发生率[18-19]。
大量研究证实,VSMC过度迁移至内膜是导致血管再狭窄的重要因素[20-22]。因此,准确检测VSMC细胞的迁移能力对判定血管再狭窄具有重要意义。目前,关于检测VSMC迁移水平的方法有很多,最常用的是细胞划痕实验和Transwell实验。本研究中,通过细胞划痕实验和Transwell实验检测发现,VSMC细胞经LPS诱导后其迁移能力明显增强,而大蒜素可明显减弱VSMC细胞的迁移能力。推测大蒜素对VSMC迁移引起的血管再狭窄具有缓解作用。
NF-κB信号通路是介导炎症反应的经典通路[23-25],NF-κB蛋白常以p65和p50亚基形成同源/异源二聚体的形式存在,并在细胞质中与抑制蛋白IκB结合形成三聚体复合物而处于失活状态[26]。当受到炎症相关诱导因素刺激后,信号将传递给IKK激酶(IκB kinase),使IκB蛋白磷酸化并从三聚体中解离出来,NF-κB二聚体暴露出核定位序列并被磷酸化,并迅速从细胞质进入细胞核内,与核内DNA上的特异序列结合,促进炎症相关基因的转录,如TNF-α和IL-6等[27-28]。研究显示,NF-κB信号通路介导的炎症反应参与血管再狭窄的发生和病理进展[29-30],在损伤的大鼠血管增生内膜中可检测到NF-κB活性增强[31]。抑制NF-κB信号通路活性可减轻VSMC及血管内膜炎症反应,并最终抑制损伤血管再狭窄的严重程度[3]。本研究显示,体外LPS诱导后,VSMC中NF-κB p65的磷酸化水平显著升高,并增加其下游炎症因子(包括IL-6,TNF-α)的表达,同时VSMC迁移活性也增强。这些结果表明,NF-κB信号通路介导的炎症反应在VSMC迁移中起重要作用。此外,我们在LPS刺激的基础上加入大蒜素处理VSMC后发现,大蒜素的干预可降低NF-κB p65磷酸化,同时炎症因子(包括IL-6,TNF-α)的表达减弱;进一步检测VSMC的迁移活性发现,VSMC的迁移受到抑制。
综上,大蒜素可显著抑制LPS诱导的血管平滑肌细胞迁移,其作用机制与抑制NF-κB p65的磷酸化相关。
